湿法超微粉碎结合水酶法提取辣木籽油及其氧化稳定性分析
2019-08-22王标诗胡小军张卫国彭元怀张世奇杨胜远
王标诗,胡小军,张卫国,江 敏,彭元怀,张世奇,杨胜远
(1.岭南师范学院 化学化工学院,广东 湛江 524048; 2.广东省辣木资源开发与利用工程技术研究中心,广东 湛江 524048)
辣木(Moringaoleifera),又称鼓槌树,被称为穷人的牛奶树,日本誉其为不可思议之树[1-2]。2012年,国家卫生部第19号公告批准辣木叶为新资源食品,为辣木产品标准化生产和市场化推广开辟了新途径。辣木浑身是宝,除辣木叶外,辣木籽也有很高的开发利用价值。
辣木籽中含有丰富的油脂,在国外辣木籽油被作为可持续的生物能源。国内外对辣木籽油的提取已有相关报道,如Bhutada等[3]报道了有机溶剂提取辣木籽油,也有借助超声波技术辅助有机溶剂提取辣木籽油[4],但是有机溶剂用量大,污染环境。Zhao等[5]报道了超临界CO2萃取技术提取辣木籽油工艺,但是成本较高。Nguyen等[6]首先应用乙醇对辣木籽进行预处理,再进行超临界CO2提取,出油率可适度提高。水酶法是一种环境友好的油脂提取新工艺[7-8],马李一[9]、刘华勇[10]和Yusoff[11]等报道了水酶法提取辣木籽油的工艺,但提取率都不太高。超微粉碎技术是近20年迅速发展起来的高新技术,能把原材料制成微米甚至纳米级的微粉,已经在各行业得到了应用,如陈体强等[12]利用超微粉碎结合超临界CO2技术分离灵芝孢子挥发油。
本文研究湿法超微粉碎结合水酶法提取辣木籽油工艺条件,并探讨辣木籽油的氧化稳定性。为辣木的深加工和副产物高值化综合利用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
辣木籽,购于湛江市旭异南药种植专业合作社。
胰蛋白酶(5万 U/g),国药集团化学试剂有限公司;中性蛋白酶(6万 U/g)、酸性蛋白酶(5万 U/g)、碱性蛋白酶(20万 U/g),北京奥博星生物技术有限责任公司;风味蛋白酶(5万 U/g)、复合蛋白酶(5万 U/g),江苏瑞阳生物科技有限公司;2,6-二叔丁基-4-甲基苯酚(BHT)为食品级抗氧化剂,其他试剂均为分析纯。
1.1.2 仪器与设备
pHS-3C型pH机,DHG-9240A型电热恒温鼓风干燥箱,DZF-6050 型真空干燥箱,FA2104N型电子精密分析天平,SXT-06索氏提取器,80-2电动离心机,HZS-HA水浴振荡器,FM-CF型湿法超微粉碎机,JYL-350A料理机。
1.2 实验方法
1.2.1 辣木籽的湿法超微粉碎预处理
辣木籽经去壳后压碎成小颗粒,用50%乙醇浸泡12 h后进行湿法超微粉碎处理(功率3 kW),再于低温(40℃)真空干燥箱中烘48 h。瓶装后置于干燥器中,备用。
同时将去壳后的辣木籽经普通的料理机微粉碎后直接低温干燥48 h,过40目筛备用,做对照样品。
1.2.2 辣木籽含油率的测定
参考GB/T 5009.6—2003,以无水乙醚为抽提剂,用索氏抽提法测定辣木籽含油率。
辣木籽含油率=辣木籽油质量/辣木籽质量×100%
1.2.3 辣木籽油水酶法提取工艺
准确称取经预处理后的辣木籽粉3 g于200 mL锥形瓶中,按比例加入一定量的水,混匀后于90℃水浴中灭酶10 min,冷却至室温后调pH(用磷酸盐缓冲溶液调节),加酶,置于120 r/min恒温振荡器中,在设定的酶解温度及酶解时间下进行酶解,酶解完成后置于90℃水浴锅中灭酶10 min,冷却至室温后以4 500 r/min离心30 min,收集上层油相,残渣于105℃烘箱内烘12 h,测定残渣含油量并计算辣木籽油提取率。
提取率=(原料中油质量-残渣中油质量)/原料中油质量×100%
1.2.4 辣木籽油酸价、过氧化值的测定
酸价的测定,采用GB/T 5530—2005《动植物油脂 酸值和酸度测定》;过氧化值的测定,采用GB/T 5538—2005《动植物油脂 过氧化值测定》。
1.2.5 辣木籽油氧化稳定性分析
参考叶丽红等[13]实验方法。分别取15 g辣木籽油置于50 mL广口瓶中,分别在2℃、室温、60℃、室温自然光、室温避光条件下存放,24 h搅拌1次,取样测定辣木籽油的过氧化值,研究温度和光照对辣木籽油氧化稳定性的影响;采用 Schaal 烘箱加速法,选择BHT作为抗氧化剂,按0.01%的比例添加到辣木籽油中,混合均匀,密封置于恒温箱中,在(60±1)℃条件下加速氧化,同时以不添加BHT的辣木籽油为对照,24 h搅拌1次,通过定时取样测定辣木籽油的过氧化值来确定其抗氧化效果。
以上实验均平行3次,实验结果以“均值±标准偏差”的形式表示。
2 结果与分析
2.1 辣木籽的含油率
以无水乙醚为有机抽提溶剂,通过索氏提取器抽提得到辣木籽油,经过计算可得辣木籽含油率为36.84%±0.45%。段琼芬等[4]研究表明, 辣木籽含油率的平均值为37.24%,与本实验较为接近。刘华勇[10]研究表明,辣木籽中粗脂肪含量为38.03%,也与本实验的测定结果比较接近。樊建麟等[14]研究表明,辣木籽中粗脂肪含量为40.12%,比本实验测定结果稍高,可能是原料的来源不同等原因所致。
2.2 酶种类的选择
分别在每种酶的最适pH、最适温度下,酶添加量2.0%,料液比1∶5,按照1.2.3的方法酶解6 h, 考察胰蛋白酶、碱性蛋白酶、酸性蛋白酶、中性蛋白酶、风味蛋白酶、复合蛋白酶、酸性蛋白酶+复合蛋白酶(比例1∶1,复合酶1)及中性蛋白酶+复合蛋白酶(1∶1,复合酶2)对辣木籽油提取率的影响,结果如图1所示。

图1 酶种类对辣木籽油提取率的影响
由图1可知,在其他条件相同及各种酶的最适条件下,提取率最高的是中性蛋白酶+复合蛋白酶(1∶1),提取率达72.13%,其次是中性蛋白酶,说明中性蛋白酶与复合蛋白酶复配能使辣木籽内的蛋白质很好地分解,释放出游离油。而提取率最低的为胰蛋白酶,仅为40.82%。因此,确定水酶法提取辣木籽油的最适酶为中性蛋白酶+复合蛋白酶(1∶1)。
2.3 粉碎方式对水酶法提取辣木籽油的影响
为了探讨湿法超微粉碎对水酶法提取辣木籽油的影响,以普通的微粉碎处理作对比分析,在复合酶添加量2.0%、酶解温度 55℃、料液比 1∶5、pH 5下酶解6 h, 考察粉碎方式对水酶法提取辣木籽油的影响,结果如图2所示。
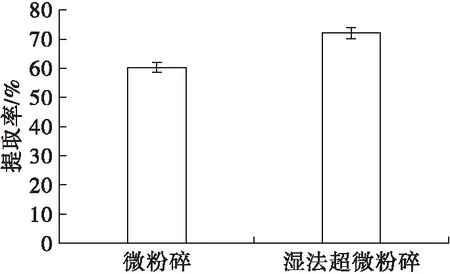
图2 粉碎方式对水酶法提取辣木籽油的影响
由图2可知,湿法超微粉碎的样品经水酶法提取后,辣木籽油提取率达到72.13%,而微粉碎的样品经水酶法提取后,辣木籽油提取率仅60.35%,可见湿法超微粉碎能明显提高辣木籽油的提取率,可使提取率增加11.78个百分点。
2.4 辣木籽油水酶法提取单因素实验
2.4.1 复合酶添加量对辣木籽油提取率的影响
在料液比1∶9、pH 6.0、酶解温度45℃下酶解6 h,探讨中性蛋白酶+复合蛋白酶(1∶1)添加量对辣木籽油提取率的影响,结果如图3所示。
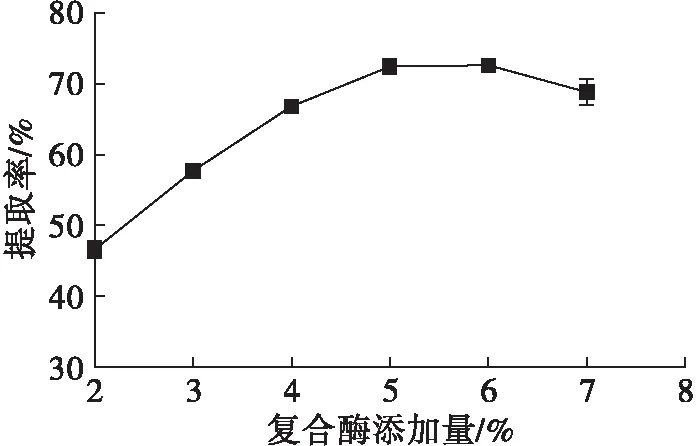
图3 复合酶添加量对辣木籽油提取率的影响
由图3可知,在2%~5%范围内,随着复合酶添加量的增大,辣木籽油提取率逐渐增加且上升趋势明显,当复合酶添加量达到5%时,辣木籽油提取率达到72.40%,继续增加复合酶添加量至6%时,辣木籽油提取率增加不明显,之后再增加复合酶添加量,辣木籽油提取率开始降低且降幅相对较为明显。考虑到经济成本等诸多方面的影响因素,确定最佳复合酶添加量为5.0%。
2.4.2 pH对辣木籽油提取率的影响
在料液比1∶9、复合酶添加量5.0%、酶解温度45℃下酶解6 h,探讨不同pH对辣木籽油提取率的影响,结果如图4所示。
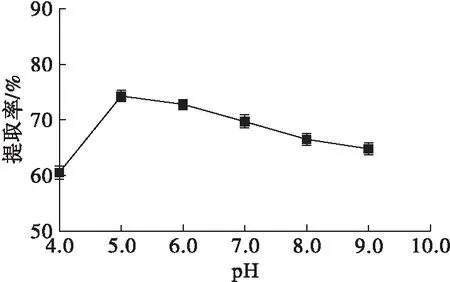
图4 pH对辣木籽油提取率的影响
由图4可知,当pH达到5.0时,辣木籽油提取率最高,达到74.30%,当pH高于5.0或者小于5.0时,辣木籽油的提取率都相应降低。因此,水酶法提取辣木籽油的最适pH应控制在5.0左右。
2.4.3 料液比对辣木籽油提取率的影响
在复合酶添加量5.0%、pH 6.0、酶解温度45℃下酶解6 h,探讨不同料液比对辣木籽油提取率的影响,结果如图5所示。
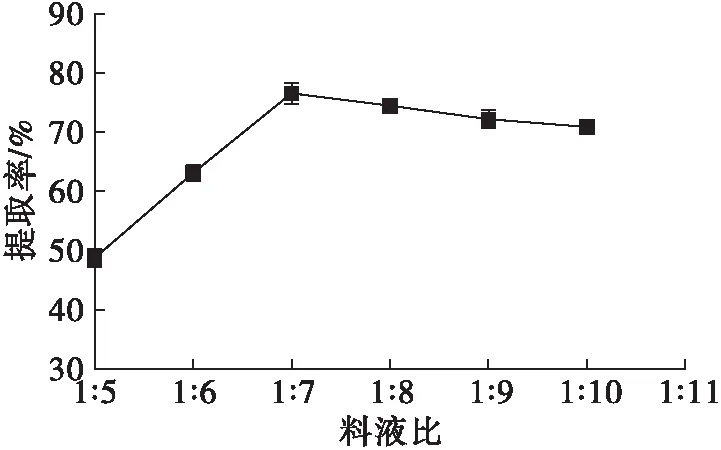
图5 料液比对辣木籽油提取率的影响
由图5可知,料液比从1∶5到1∶7,辣木籽油提取率逐渐上升,料液比1∶7时辣木籽油提取率最大,达到76.61%。之后随料液比增大,辣木籽油提取率呈下降趋势。可能由于料液比过低时,反应体系流动性差,不利于蛋白酶的作用,油脂不能很好溶出,因而油脂提取率较低;当底物浓度和酶浓度达到合适的比例时,反应速率加快,油脂提取率也随之增加,但料液比过大时,底物浓度和酶浓度均被稀释,影响酶与底物的反应速率从而使提取率降低。因此,水酶法提取辣木籽油的最佳料液比为1∶7。
2.4.4 酶解时间对辣木籽油提取率的影响
在料液比1∶9、复合酶添加量5.0%、pH 6.0、酶解温度45℃下进行酶解,探讨不同酶解时间对辣木籽油提取率的影响,结果如图6所示。
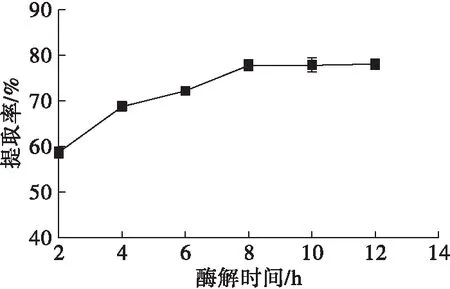
图6 酶解时间对辣木籽油提取率的影响
由图6可知,随着酶解时间的延长,辣木籽油提取率呈上升趋势,当酶解时间达到8 h以上时,辣木籽油提取率趋于平稳。可能由于酶解时间越长,油料细胞被蛋白酶降解越充分,酶作用越完全。因此,从节约能源和材料的角度考虑,水酶法提取辣木籽油的最佳酶解时间为8 h左右。
2.4.5 酶解温度对辣木籽油提取率的影响
在料液比1∶9、复合酶添加量5.0%、pH 6.0下酶解6 h,探讨不同酶解温度对辣木籽油提取率的影响,结果如图7所示。

图7 酶解温度对辣木籽油提取率的影响
由图7可知,随着酶解温度的升高,辣木籽油提取率呈现先升高后下降的趋势,当酶解温度达到55℃,辣木籽油提取率最高,达到74.96%。过低或过高的温度都会影响酶的活性,甚至可能导致酶蛋白变性,进而影响酶与底物的作用,从而降低提取率。因此,水酶法提取辣木籽油的最佳酶解温度为55℃。
2.5 辣木籽油水酶法提取正交实验
以单因素实验为基础,选择中性蛋白酶和复合蛋白酶按1∶1组成的复合酶为酶解用酶,pH为5.0,以辣木籽油提取率为考察指标,复合酶添加量(A)、料液比(B)、 酶解时间(C)、酶解温度(D)为考察因素,进行 L9(34)正交实验,优化提取辣木籽油的最佳工艺条件。正交实验设计及结果见表1。
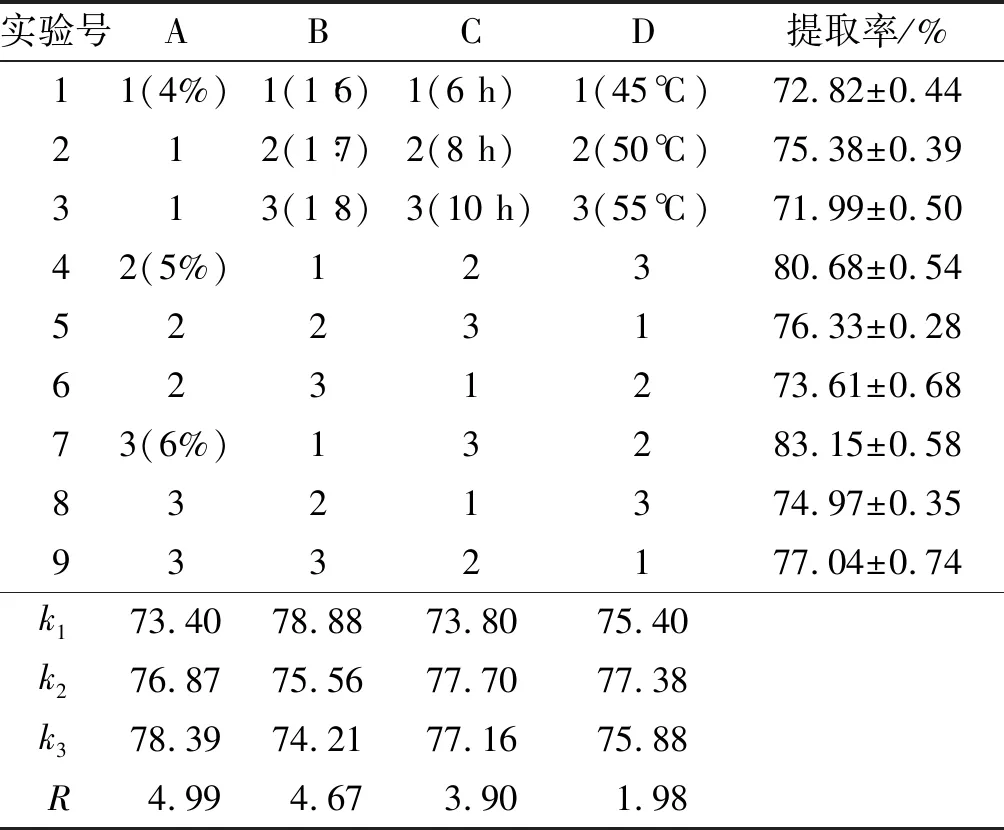
表1 正交实验设计及结果
由表1可知,各因素对辣木籽油提取率的影响大小依次为复合酶添加量(A)>料液比(B)>酶解时间(C)>酶解温度(D)。由极差分析中直观得出最佳组合为A3B1C2D2,即复合酶添加量为6%,料液比为1∶6,酶解时间为8 h,酶解温度为50℃。在该条件下做3次重复验证实验,得到辣木籽油提取率为85.23%±0.72%。马李一等[9]研究结果表明,水酶法提取辣木籽油最高得油率为28.6%,如果换算成提取率不超过70%,故本实验最佳条件下的提取率要远高于其实验结果;而刘华勇[10]研究表明,水酶法提取辣木籽油最高提取率为76%,低于本实验结果,其预处理方法与本实验明显不同。本实验结果提取率较高的主要原因可能是对原料进行了超微粉碎预处理,对辣木籽细胞壁的破坏力更强,并在处理过程中使用复合蛋白酶对辣木籽进行处理,使油脂更容易与蛋白质等成分分离,故提取效果更好。
2.6 辣木籽油的酸价和过氧化值
利用上述最佳工艺条件提取辣木籽油,用国标法测出其酸价(KOH)为0.012 mg/g,过氧化值为1.03 meq/kg。与马李一等[9]报道的辣木籽油酸价较为接近,而本实验得到的过氧化值更低。
2.7 辣木籽油的氧化稳定性
2.7.1 温度对辣木籽油氧化稳定性的影响 (见图8)
由图8可知,在各温度下放置10 d,随着放置时间的延长,辣木籽油的过氧化值均呈上升趋势,且温度越高,过氧化值增加越明显,说明辣木籽油的自动氧化一直在不断进行,且温度越高,辣木籽油的氧化程度越高。因此,低温有利于辣木籽油的保存,能够延缓辣木籽油的自动氧化。
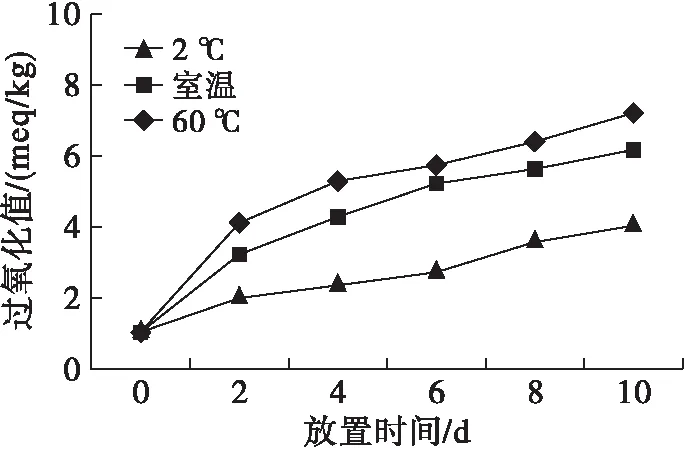
图8 温度对辣木籽油氧化稳定性的影响
2.7.2 光照对辣木籽油氧化稳定性的影响(见图9)
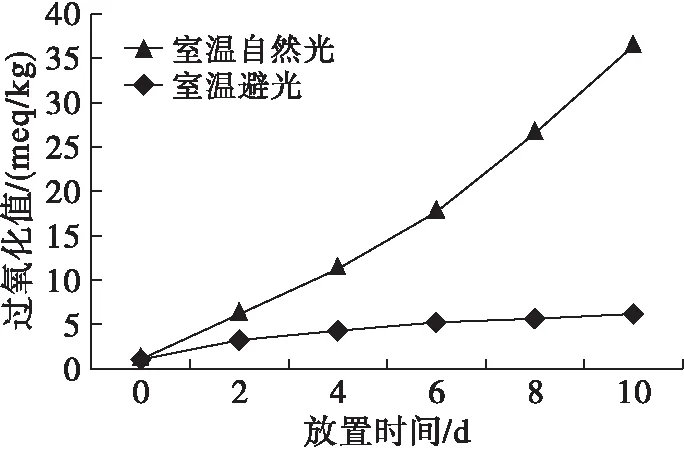
图9 光照对辣木籽油氧化稳定性的影响
由图9可知,随着放置时间的延长,辣木籽油的过氧化值一直在不断增加,在室温避光条件下辣木籽油的过氧化值变化幅度较小,而放置在室温自然光条件下的辣木籽油过氧化值随着放置时间的延长变化较为剧烈,放置10 d,辣木籽油过氧化值达到36.37 meq/kg,这是因为光能促进过氧化物的分解,还能引发游离基,促进氧化反应的进行。可见,在较长时间的保存过程中,光照对辣木籽油的影响较大。这与段琼芬等[15]的研究结果基本一致。
2.7.3 抗氧化剂对辣木籽油氧化稳定性的影响(见图10)
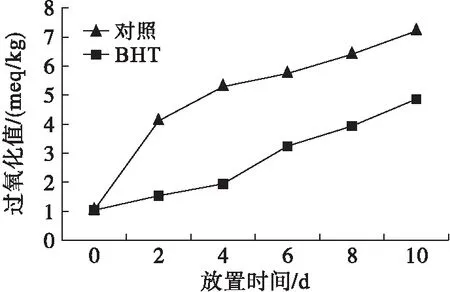
图10 抗氧化剂对辣木籽油氧化稳定性的影响
由图10可知,在辣木籽油中添加一定量抗氧化剂BHT的情况下,于60℃烘箱中进行加速氧化反应,随着辣木籽油保存时间的延长,其过氧化值逐渐增加,在相同时间内,不添加抗氧化剂的辣木籽油过氧化值更高,说明添加抗氧化剂BHT能抑制辣木籽油的氧化。因此,在辣木籽油的贮藏过程中,可以通过添加抗氧化剂的方法延长辣木籽油的保质期。这与叶丽红等[13]研究的番木瓜籽油氧化稳定性结果基本一致。
3 结 论
(1)采用湿法超微粉碎预处理后再经水酶法提取辣木籽油,在单因素实验的基础上通过正交实验优化得到的最佳工艺条件为:以中性蛋白酶+复合蛋白酶(1∶1)为酶解用酶,酶添加量6%,料液比1∶6,酶解时间8 h,pH 5.0,酶解温度50℃。在最佳工艺条件下,辣木籽油提取率为85.23%±0.72%。各因素对辣木籽油提取率的影响大小依次为复合酶添加量>料液比>酶解时间>酶解温度。
(2)温度、光照、氧气均会引起贮藏过程中辣木籽油过氧化值的升高。其中光照比温度对辣木籽油过氧化值的影响更大。因此,贮藏辣木籽油时,应尽量放置低温、阴凉、避光处。添加抗氧化剂可明显抑制辣木籽油氧化,有效延长辣木籽油的保质期。
