红细胞分布宽度及尿酸与慢性心力衰竭患者左心室肥厚的相关性
2019-08-21刘姗姗吴桂平刘兆奕张亚利
刘姗姗,吴桂平,刘兆奕,张亚利
(1.沈阳医学院研究生院2016级硕士研究生,辽宁 沈阳 110034;2.沈阳医学院附属第二医院心内二科)
慢性心力衰竭(chronic heart failure,CHF)是一种以心脏结构和(或)功能异常,引起静息或负荷时心输出量减少和(或)心内压力增高,从而导致的典型症状(如呼吸困难、踝部水肿和疲乏),也可伴有体征(如颈静脉压升高、肺部啰音和外周水肿)为特征的临床综合征[1]。心室重构是CHF发生发展的主要机制。红细胞分布宽度(red cell distribution width,RDW)是临床上反映红细胞体积变异程度的参数。近年来越来越多的研究发现RDW与心血管疾病之间有着密切的关系[2-4]。该参数的增加被称为胞质异常症,并且对于一般人群以及心衰患者的不良心血管事件及死亡的未来风险预测具有很重要的意义[5-6]。近年来研究表明CHF常合并肾功能异常,肾脏损害是 CHF 的独立危险因素[7],尿酸(uric acid,UA)是重要的肾功能指标。但是有关RDW、UA与CHF患者心室肥厚的相关性的研究不多。本研究探讨RDW、UA与CHF患者心室肥厚的相关性,并探究可能存在的相关机制,目的为临床诊疗提供新的思路。
1 资料与方法
1.1 临床资料 选择2016年5月至2018年5月于沈阳医学院附属第二医院心血管内科住院的CHF患者283例为研究对象,其中男157例,女126例,平均年龄(68.2±11.2)岁。所有入选对象均符合《2016 ESC急、慢性心力衰竭诊断和治疗指南》[1]的诊断标准。排除标准:消化道出血,自身免疫性疾病,恶性肿瘤、放化疗及器官移植,先天性心脏病,慢性阻塞性肺部疾病、急慢性感染,甲状腺功能亢进症,急性心肌梗死发作6个月以内、近3个月接受经皮冠状动脉介入治疗(PCI)或其他外科手术,严重肝肾功能损害、血液透析者,脑出血、恶性肿瘤、恶性贫血等。多次入院的患者采用首次入院资料。所有研究对象均签署知情同意书。
1.2 研究方法 记录内容包括一般人口学特征,性别、年龄、本人病史和服药史,心血管及相关疾病家族史,专业人员进行身高、体重测量,血常规、血生化、肝肾功能、心室结构的测定等。
1.2.1 血常规及生化指标的检测 入院后首日或次日采集空腹肘静脉血,测定RDW、红细胞计数(RBC)、血红蛋白(Hb)、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDH-C)、尿酸(UA)、肌酐(SCr)等。
1.2.2 超声心动图测量左心室结构 入院72 h内由2名超声科专业医师利用彩色超声心动图测量左室舒张末期内径(LVEDD)、室间隔厚度(IVST)、左心室后壁厚度(LVPwd)、左心室射血分数(LVEF)。每个指标均测量3个心动周期后取平均值。采用Devereux修正公式[8-9]计算左心室质量(LVM)和左心室质量指数(LVMI):LVM=0.8×1.04×[(LVEDD+ IVST+ LVPwd)3-LVEDD3]+0.6。LVMI=LVM/BSA,按照 Stevenson公式计算体表面积(BSA)=0.006×身高+0.013×体重-0.153进行计算。
1.2.3 试验分组 按照左心室肥厚(LVH)的诊断标准[10]:男性LVMI≥125 g/m2,女性LVMI≥120 g/m2,为CHF伴LVH;CHF伴LVH组患者103例,CHF伴非LVH组患者180例。
1.3 统计学方法 采用SPSS 22.0软件进行统计学分析,计量资料采用均数±标准差表示,组间比较采用独立样本t检验;计数资料用百分比(%)表示,组间比较采用χ2检验。采用Pearson进行相关性分析;使用受试者工作特征(ROC)曲线分析RDW、UA对CHF发生心室肥厚的预测。以P<0.05为差异有统计学意义。
2 结果
2.1 基本临床资料比较 2组患者在年龄、性别等临床资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者基本资料比较
2.2 实验室指标及心脏彩超结果比较 LVH组RDW、UA、LVMI均显著高于非LVH组,差异有统计学意义(P<0.01);LVEF显著低于 LVH组(P<0.01),见表2。
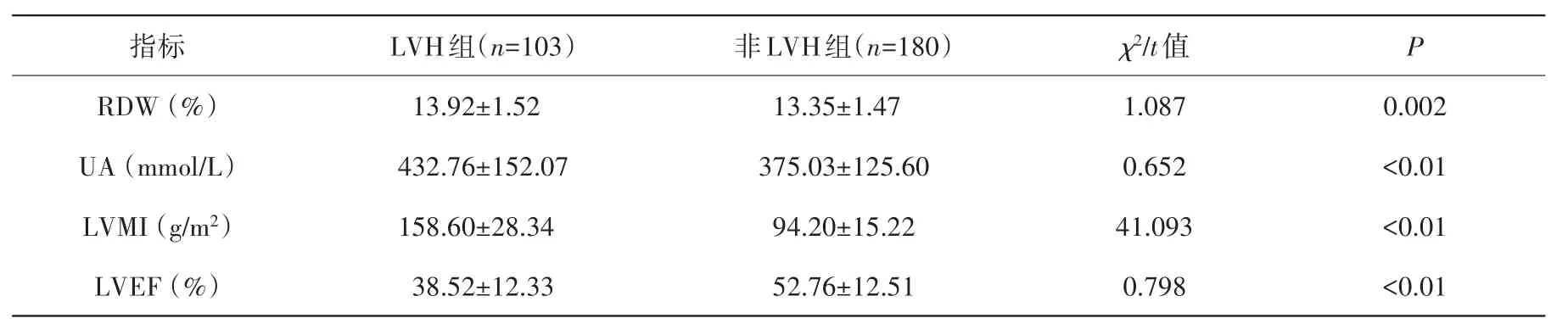
表22组患者RDW、UA、LVMI、LVEF比较
2.3LVMI、LVEF与RDW、UA相关性分析 RDW和 UA 与 LVMI均呈正相关(r=0.218、0.264,P<0.01),与LVEF均呈负相关(r=-0.395、-0.352,P<0.05),肌酐与LVMI、LVEF无显著相关性(P>0.05)。2.4 RDW和UA预测早期发生心室肥厚的ROC曲线 RDW预测早期发生心室肥厚的曲线下面积为 0.634(P<0.05),95%CI为 0.567~0.701,预测发生心室肥厚的敏感度为60.20%,特异度为33.90%,RDW的界值为13.35%;UA预测早期发生心室肥厚的曲线下面积为0.620(P<0.05),95%CI为0.552~0.687,预测发生心室肥厚的敏感度为74.30%,特异度为52.00%,UA的界值为347.2 mmol/L;RDW与UA联合检测判断发生心室肥厚的曲线下面积为0.657,95%CI为0.592~0.722。见图1、图2。
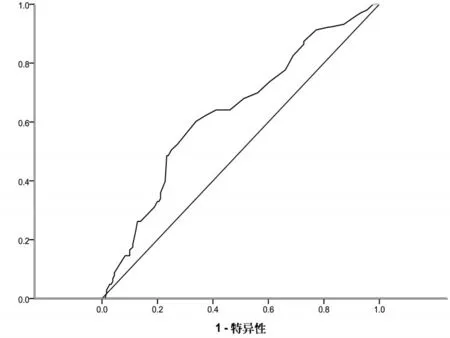
图1 RDW预测早期发生心室肥厚的ROC曲线
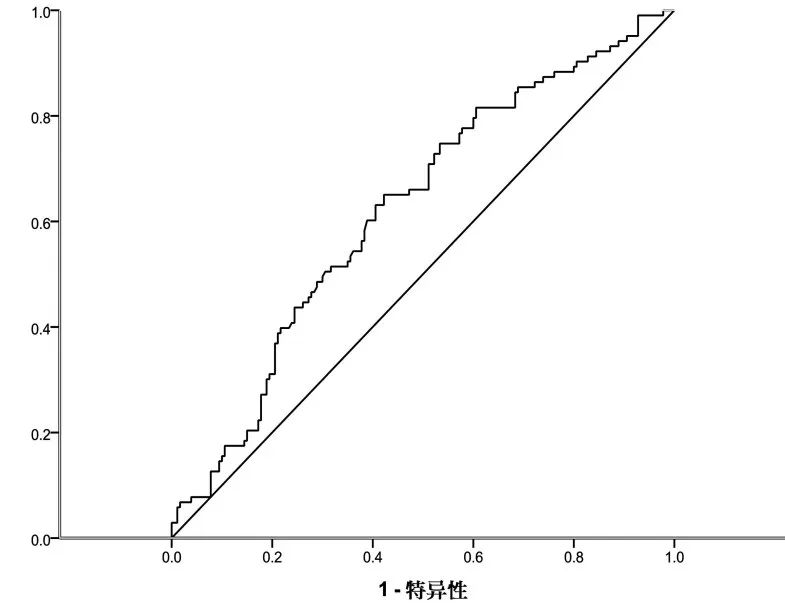
图2 UA预测早期发生心室肥厚的ROC曲线
3 讨论
RDW可以用全自动血液分析仪测量得到,以往通常用作贫血的鉴别诊断及形态学分类,临床上用于测量红细胞大小的方法不同,尤其是血液分析仪器的不同,可能会导致测量值的不同,临床上RDW的正常参考范围为11%~15%[11]。RDW超过正常值意味着平均红细胞体积增大或规模不同,变形性降低,脆性增加,从而增加血液粘度,提示存在各种类型的贫血(如造血异常或先天性红细胞异常)或导致高血压、心血管疾病的发生。国内外研究证明,RDW对CHF患者预后的预测作用比目前公认的预后因子NT-proBNP、NYHA 心功能 分级更 强[12-13]。RDW 在CHF伴心室肥厚患者中增加的机制可能涉及多个方面的综合影响:(1)CHF心室重构涉及炎症反应,炎症反应抑制促红细胞生成素(EPO)导致红细胞生成障碍及铁代谢障碍[14-15],进而引起RDW升高。(2)CHF患者由于心功能受损导致体循环障碍,包括消化系统在内的多个系统功能障碍,引起胃肠功能减退,影响铁代谢,维生素B12及叶酸的吸收,进而影响红细胞的生成,红细胞在循环中体积大小发生很大的差异,导致RDW升高。(3)RDW通过氧化应激激活信号通路导致心室肥厚的发生[16]。而本研究中可以得出RDW与LVMI呈正相关,与LVEF呈负相关,但相关性并不强,预测准确性并不太高,这可能与所搜集患者均是长期CHF患者并经过正规有效的药物治疗,减慢了心室肥厚的进展有关。
UA通过黄嘌呤氧化酶(XOD)催化黄嘌呤生成,临床及流行病学显示,高尿酸血症(UA≥420 mmol/L)是冠心病、肾脏病、高血脂、高血压等的独立危险因素[17]。UA在CHF伴心室肥厚患者中增加的机制尚不完全清楚,可能与以下机制有关:(1)CHF导致组织肾脏缺血缺氧,抑制了肾小管对UA的分泌,导致外周血UA增高;(2)UA本身可以刺激单核细胞趋化蛋白,使一氧化氮失活,促进内皮细胞增加,基质增生,导致心室重构[18]。本研究中UA在LVH组和非LVH组间比较差异有统计学意义(P<0.05),且与LVMI呈正相关,与LVEF呈负相关,但早期检测对于预测发生心室肥厚的价值不太高。
对于CHF患者来说,心室肥厚是其发生发展的主要病理基础。有效预防心室肥厚,对CHF的预后有很好的价值。RDW和UA具有检测方便、廉价,可以普遍应用于临床,为早期发现和干预CHF心室重构有重要的价值。本研究并未得出有显著价值的临床结果,这可能与本研究为单中心回顾性研究,且纳入病例有限有关,因此在之后的进一步研究中,可以在本研究的基础上再进行增加样本量的多中心前瞻性研究。
