银杏内酯B抗心肌氧化应激损伤作用机制研究❋
2019-08-21苗雨欣李朝阳孙雅涵何玛丽徐菁蔓
苏 琦,赵 娜,苗雨欣,李朝阳,肖 童,孙雅涵,何玛丽,田 炜,徐菁蔓△
(1.华北理工大学医学实验研究中心,河北 唐山 063210; 2.华北理工大学实验动物中心,河北 唐山 063210; 3.国家科技部老年医学国际科技合作基地,河北 唐山 063210)
心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)是指缺血心肌在恢复血流之后发生的更加严重的损伤,常出现梗死面积扩大和心率失常[1]。氧化应激(oxidative stress,OS)是机体受到多种有害因素刺激后,活性氧簇(ROS)产生过多,抗氧化能力下降对机体造成损伤。在MIRI中ROS大大增加,造成病理损伤[2]。近年来,磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号途径已成为研究热点,Akt对下游信号分子的活化起重要作用,如糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)[3],GSK-3β磷酸化失活对于抗氧化应激损伤尤为重要,故本实验以此作为研究方向。
银杏内酯B(ginkgolide B,GB)是银杏叶(ginkgo biloba L)提取物。银杏叶化学成分丰富,其主要有效成分为萜内酯类化合物,包括银杏内酯A、B、C等[4],其中GB生理活性最强[5]。研究发现,GB可以用于治疗心血管疾病,具有抗炎、抗氧化等作用[6],但在MIRI方面研究甚少。本实验意在探讨GB能否具有发挥抗氧化应激损伤的作用及其作用机制,以期为MIRI临床治疗提供方向。
1 材料与方法
1.1 细胞株
H9c2细胞株(来源于大鼠胚胎心脏组织)购自美国ATCC 公司。
1.2 试剂与仪器
实验药物银杏内酯B(Ginkgolide B GB)由北京百威灵科技有限公司提供(纯度>99%);H2O2(批号STBB6350)购自美国Sigma 公司;兔源单克隆抗体p-Akt(Ser473)、p-GSK-3β(Ser9)、鼠源微管蛋白β-Tubulin(多克隆抗体)及辣根过氧化物酶标记山羊抗兔IgG二抗均购自美国Cell Signaling Technology公司;荧光染料罗丹明123(Rhodamine 123)购自上海碧云天生物技术研究所,改良Eagle 培养基(dulbecco'smodified eagle medium DMEM),四甲基偶氮唑盐比色法[3-(4、5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT] 细胞增殖及毒性检测试剂盒、聚氰基丙烯酸正丁酯(Butyleyanoacrylate,BCA)蛋白浓度检测试剂盒、电化学发光免疫分析(ElectrogeneratedChemiluminescence,ECL)发光检测试剂盒,均购自上海碧云天生物技术研究所,37 ℃二氧化碳CO2 培养箱购自美国Thermo Forma 公司;荧光酶标仪购自美国Molecular Devices公司;生物安全柜购自新加坡ESCO 公司;5804R 高速冷冻离心机购自德国Eppendorf 公司;JY200C 电泳仪购自北京君意东方电泳设备有限公司;酶标仪和湿转运系统购自美国Bio-Rad 公司。
1.3 试验方法
1.3.1 细胞培养 从液氮罐中取出冻存的H9c2细胞,放入37 ℃恒温水浴箱中溶化,在超净工作台中将溶好的细胞悬液移入装有5 mlDMEM培养基(含10%胎牛血清、双抗)的无菌离心管中,置于离心机离心(1000 rm,离心5 min)后弃上清,将细胞重悬于25 ml培养瓶中,并使其均匀分布,放置于细胞培养箱(CO2浓度为5%,温度为37 ℃,饱和湿度)中进行培养;在培养24~48 h之后显微镜观察H9c2细胞状态,待其长至大约>90%时,选择状态良好的H9c2细胞弃培养基,用无菌磷酸盐缓冲溶液(phosphate buffered saline, PBS)将细胞冲洗3遍,用0.25%胰蛋白酶200 μL 消化2 min,用10 ml培养基终止消化,反复轻轻吹打为均匀的细胞悬液,分配到2个培养瓶中即可,每周传代2~3次;选取生长状态良好的细胞,在处于对数生长期且细胞数目达到80%~90%时同传代步骤相同,将细胞消化离心后加入500 μL冻存液,使其悬浮充分混匀后移入1.5 ml冻存管中,用封口膜封口并标记,保存于-80 ℃冰箱中(如需长期保存转入液氮罐中)。
1.3.2 实验分组及处理条件 实验共分为4组。Control组:正常培养的H9c2细胞不进行任何药物处理;H2O2组:650 μmol/L 处理20 min;GB+H2O2组:加入不同浓度GB(15.0、30.0、60.0 和120.0 μmol/L)处理20 min,加入H2O2650 μmol/L处理20 min;之后的研究中GB+H2O2组均采用60.0 μmol/L预处理20 min,然后用650 μmol/L处理20 min, GB组:只加入60.0 μmol/L的GB处理20 min。
1.3.3 MTT 法检测细胞存活率 选取对数生长期且细胞状态良好的细胞重复培养步骤,待其消化离心重新悬浮后进行细胞计数,稀释为1×104个/ml,96 孔板加入100 μL/孔,约1000个细胞培养24~48 h,待其长到75%左右后按照各组要求加药处理细胞,处理后把液体全部吸出,PBS冲洗,重新加入完全培养基100 μL,再加入10 μL MTT,继续在细胞培养箱内培养4 h后,加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),放置于摇床慢摇15 min后,在显微镜下观察到蓝色结晶物完全溶解,用酶标仪在570 nm 处测定每孔吸光度值(optical delnsity,OD),计算细胞的存活率(survival rate,SR)。细胞存活率%=实验组OD值/ 对照组OD值×100%。
1.3.4 检测线粒体膜电位 选取对数生长期且细胞状态良好的细胞重复细胞培养步骤,待其消化离心重新悬浮后进行细胞计数,稀释为1×104个/ml,96 孔板加入100 μL/孔,约1000个细胞,培养24 h长至75%左右后按照各组要求处理细胞,处理后把培养基全部吸出,PBS冲洗2遍,重新加入含有2 μmol/l R123的培养基100 μL培养40 min后,倒掉其中培养基,PBS洗2遍,再加入100 μL完全培养基,用酶标仪在507~529 nm处检测定每孔吸光度值。
1.3.5 Western blot 检测 Akt 和 GSK-3β 磷酸化蛋白表达 在2 ml小皿中细胞培养48 h后,选择生长状态良好的细胞按照分组处理再弃培养基,PBS冲洗3遍,加入40 μL裂解液冰上裂解30 min, 将细胞收集于Eppendorf 管中,超声破碎15 s,4℃ 12 000 r/min,离心15 min 后取上清液,使用二喹啉甲酸(Bicinchoninic acid,BCA)法进行蛋白定量。以25μg/孔上样,依次进行电泳及转膜,使用10%脱脂奶粉室温慢摇2 h,孵育p-Akt(Ser473)、p-GSK-3β(Ser9)及β-Tublin一抗(1∶1000稀释),4 ℃慢摇过夜(8~12 h),Tris-HCl 缓冲盐溶液洗3次,每次10 min;二抗(1∶1000稀释)室温慢摇孵育2 h,Tris-HCl 缓冲盐溶液洗3次,每次10 min;增强化学发光法(enhanced chemiluminescence,ECL)荧光显色,用Image J 进行灰度扫描及定量分析。
1.4 统计学方法
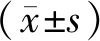
2 结果
2.1 GB对心肌氧化应激损伤的影响
2.1.1 GB对细胞存活率的影响 表1显示,与对照组比较, H2O2组的细胞存活率下降。不同浓度的GB预处理,MTT检测OD值均升高,其中GB为60 μmol/L 时效果最为明显,差异有统计学意义,表明GB能减轻H2O2引起的细胞存活率下降,60 μmol/L为其最适浓度。
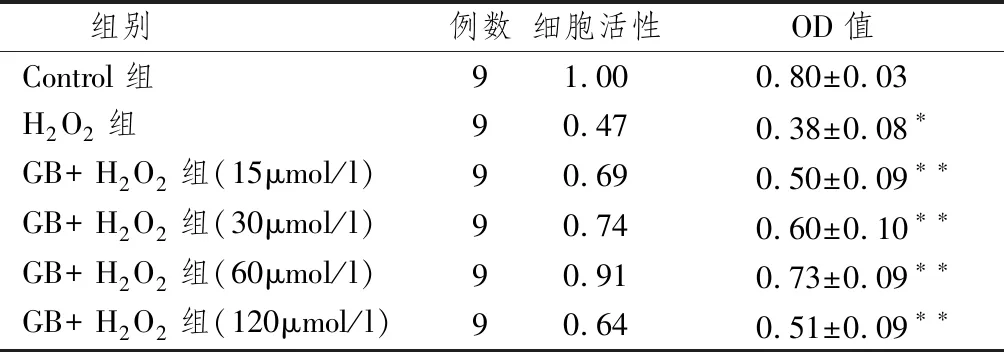
表1 MTT法测定GB对H9c2细胞存活率的影响
注:与control组比较:*P<0.05;与H2O2组比较:**P<0.05
2.1.2 GB对心肌细胞线粒体通透性转换孔(mitochondrial permeablity transition pore,mPTP)开放的影响 表2显示,与对照组比较, H2O2组的荧光强度下降。60 μmol/L 的GB预处理,荧光酶标仪检测荧光强度升高,差异有统计学意义,表明GB能够减轻H2O2引起的mPTP开放。

表2 荧光酶标仪检测GB对H9c2线粒体膜电位的影响
注:与control组比较:*P<0.05;与H2O2组比较:**P<0.05
2.1.3 GB对Akt磷酸化蛋白表达的影响 图1显示,与对照组比较, H2O2组的Akt蛋白磷酸化水平降低, GB预处理组中Akt蛋白磷酸化水平增强,差异有统计学意义(P<0.05),表明GB能够上调Akt蛋白磷酸化水平。
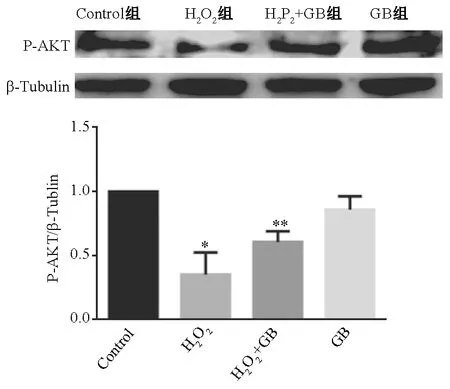
注:与control组比较:*P<0.05;与H2O2组比较:**P<0.05图1 P-Akt (Ser473)蛋白表达比较
2.1.4 GB对GSK-3β磷酸化蛋白表达的影响 图2显示,与对照组比较, H2O2组的GSK-3β蛋白磷酸化水平降低,GB预处理组中GSK-3β蛋白磷酸化水平增强,差异有统计学意义(P<0.05),表明GB能够上调GSK-3β蛋白磷酸化水平。
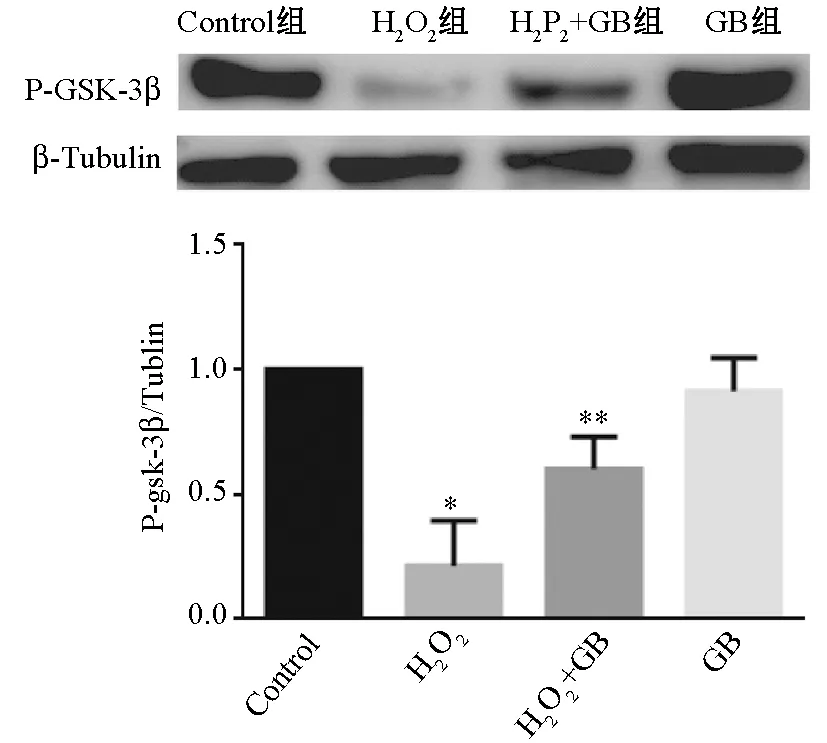
注:与control组比较:*P<0.05;与H2O2组比较:**P<0.05图2 p-GSK-3β(Ser9)蛋白表达比较
3 讨论
GB作为银杏叶中活性最强的成分,曾被称为 “活化石”,具有极高的观赏、经济和药用价值,化学成分极为丰富。有研究发现,GB在抗脑缺血/再灌注损伤中可发挥保护作用,明显减轻大脑损伤[7], 还可降低氧化应激所导致的内皮细胞损伤[8]。近年来相关研究显示,GB在I/R损伤方面可发挥其保护作用,降低损伤程度[9]。从本研究MTT检测结果可以看出,GB能够明显减轻氧化应激损伤,提高H9c2细胞存活率。
线粒体是机体各种生命活动的能量来源,在维持机体正常代谢中扮演着重要角色。而mPTP是一种位于线粒体内、外膜之间的膜通透性转换孔,在正常情况下mPTP处于关闭状态,阻挡离子和其他代谢物质通过[10]。但当各种有害因素刺激细胞时,如H2O2会导致线粒体钙超载和氧化应激程度增加,线粒体膜及电子传递链发生氧化损伤, ATP 产生大大减少,线粒体稳定状态被破坏,从而产生大量ROS[11],使细胞发生应激性损伤,没有足够的ATP就会使mPTP处于开放状态[12],大量本被阻挡在线粒体外的分子、离子涌入线粒体内,导致损伤引发细胞凋亡。近年来发现,若能抑制mPTP开放,就有可能降低细胞氧化应激损伤[13]。本研究荧光酶标仪检测结果表明,银杏内酯B能够抑制mPTP 开放,发挥抗氧化应激损伤作用,这表明银杏内酯B也可通过线粒体机制发挥心肌保护作用。
PI3K/AKT信号通路是细胞内非常重要的信号传导通路之一,可以在机体多种生命活动过程中影响下游效应分子(一氧化氮合酶、Bcl-2 家族、胱天蛋白酶9(caspase-9)等)的活化状态,从而发挥抗凋亡、减轻细胞损伤的作用。由于AKT磷酸化之后可产生级联放大效应,因此若采用阻断此通路中关键环节的方法,就可能有效防治I/R损伤及细胞凋亡等[14]。目前已有研究显示,通过药物靶向治疗Akt通路的关键环节,可明显减轻心肌损伤和细胞凋亡[15]。本研究结果显示,GB能够使Akt磷酸化蛋白表达明显增加,提示GB可能是通过PI3K/Akt通路发挥抗心肌细胞氧化损伤作用。
GSK-3β是GSK-3亚型之一,属于丝氨酸/苏氨酸蛋白激酶家族成员,具有重要的细胞调节功能,广泛分布于哺乳动物真核细胞中[16]。在正常状态下GSK-3β处于激活状态,当其被磷酸化后则失活,若能抑制GSK-3β活性就可提高心肌细胞抗氧化应激能力。近年来各项研究表明,GSK-3β与I/R损伤等心血管疾病密切相关[17],同时也是参与肝糖代谢的关键酶,广泛参与体内多种功能活动的调节。GSK-3β也与细胞凋亡、损伤等紧密关联,主要是通过磷酸化多种底物蛋白来调节糖原的合成代谢,参与细胞的分化、增殖等[18]。有研究认为,GSK-3β是心肌保护通路的一个重要交点,GSK-3β磷酸化在上游信号AKT作用下增强,从而减轻MIRI。本研究结果显示,GB能够上调GSK-3β磷酸化蛋白的表达,提示GB可能是通过此途径发挥心肌保护作用的。
本实验结果表明,GB预处理可以使H9c2细胞存活率升高,并提示 GB可能是通过PI3K/Akt 途径抑制GSK-3β活性, 减少mPTP 开放,从而减轻氧化应激引起的心肌细胞损伤。
