涎腺分泌性癌7例临床病理分析*
2019-08-21杨雯贺晓燕陈方园高露蔡梅窦朝念张菊杨勇徐澍
杨雯,贺晓燕,陈方园,高露,蔡梅,窦朝念,张菊,杨勇,徐澍
550004 贵阳,贵州医科大学附属医院 病理科(杨雯、徐澍);550004 贵阳,贵州省肿瘤医院 病理科(杨雯、贺晓燕、高露、蔡梅、窦朝念、张菊、杨勇);400064 重庆,南岸区人民医院 内科(陈方园)
涎腺分泌性癌(mammary analogue secretory carcinoma,MASC)是2017年世界卫生组织头颈肿瘤分册收录的新肿瘤类型[1],因其形态与原发于乳腺的分泌性癌类似,并同样具有特征性ETV6-NTRK3基因融合转录而得名。在被明确分类定义之前,这类肿瘤最常被诊断为涎腺腺泡细胞癌(acinic cell cancinoma,AciCC),其次为低级别非特异性癌、黏液表皮样癌等[2-4]。MASC的发现者Skálová认为[5],MASC与AciCC主要有三点不同:1).MASC不存在胞浆内嗜碱性颗粒,而这是AciCC最重要的组织学特征;2).MASC具有与AciCC完全相反的免疫表型,前者总是强阳性表达S-100蛋白和Mammaglobin,不表达DOG1;3).MASC存在ETV6-NTRK3融合基因转录。因此,本研究通过回顾性收集我院2011年至2018年期间诊断的涎腺上皮源性恶性肿瘤117例,从中筛选出符合MASC组织学特征及免疫组化特点的病例7例,总结其临床病理特征,以减少误诊。
1 材料与方法
1.1 材料
回顾性收集我院病理科2011年1月至2018年10月诊断为涎腺上皮源恶性肿瘤的病例117例,其中腺泡细胞癌25例,腺样囊性癌 29例,粘液表皮样癌 35例,癌在多形性腺瘤中 11例,涎腺导管癌3 例,非特异性腺癌 4例,肌上皮癌及上皮-肌上皮癌10例。
1.2 方法
标本均由4%中性甲醛固定,常规石蜡包埋及HE染色。117例病例由两名高年资病理医师重新观察切片,严格根据2017年版WHO头颈肿瘤分册中所描述的MASC镜下形态学特征鉴别[1]:肿瘤细胞排列呈腺管状、微囊性、实体性、滤泡样和乳头状,并且胞浆嗜酸性、透明或泡沫状,从中筛选出7例病例(最初均被诊断为腺泡细胞癌),并对这7例病例采用EnVision二步法进行免疫组织化学染色,DAB显色、苏木素对比染色。抗体包括S-100、Vimentin、CK7、GATA-3、Mammaglobin、P63、Ki-67、CD117、DOG1,抗体均为北京中衫公司生产。
1.3 免疫组化结果判读
S-100定位于细胞核和细胞质,CK7、Mammaglobin与Vimentin定位于细胞质,P63、GATA-3与Ki-67定位于细胞核,CD117与DOG1定位于细胞质或细胞膜,阳性强度判读:1)在高倍镜(×400)下选取10个视野,计算细胞阳性率评分(阳性瘤细胞数/总瘤细胞数)×100%, 0分:阳性细胞数<5%;1分:5%~25%;2分:26%~50%+;3分:>50%;2)着色强度评分:0分:无色;1分:浅黄色;2分:棕黄色;3分:深棕色;3)阳性强度(细胞阳性率评分+着色强度评分):阴性:0分;1+:1~2分;2+:3~4分;3+:5~6分。
2 结 果
2.1 临床资料
7例患者详细资料见表1,其中:1)性别和年龄:7例MASC病例,女性2例,男性5例。发病年龄21~63岁,中位年龄44岁;2)发病部位:腮腺6例,颌下腺1例;3)临床表现:7例病例均为自行发现的肿大包块,其中1例为外院手术后复发,术后病理诊断不详。病程2周至3年不等,包块缓慢增大;4)治疗和预后: 7例病例中2例行肿块及同侧腺叶+颈淋巴结清扫并术后放疗,其中1例颈部IV区淋巴结见肿瘤转移,5例因术前或术中冰冻未明确性质,仅行肿块及同侧腺叶切除术,术后未遵照医嘱返院治疗。7例病例,4例获得随访资料,3例失访,随访时间8~43个月,均无肿瘤复发。
表1 7例MASC 临床资料
Table 1. Clinical Data of 7 Cases of MASC

CaseSexAgeLocationSize (cm)Clinial presentationOriginal diagnosisStage TreatmentFollow up1M63Right Parotid3.5×2.5Painless nodule for 1 yearAciCCT2N0M0RP+ND+RTNED (10)2F53Right sub-mandi-bular3.0×3.0Slow growing, painless nod-ule for 3 yearsAcicc with lymph node metastasis in right IV area T2N0M0RP+ND+RTNED (8)3M63Right Parotid3.2×2.6Painless nodule for 2 weeksAciCCT2N0MORP NED (27)4F29Left Parotid3.0×3.0Painless nodule for 2 yearsAciCCT2NOM0RPLost5M44Left Parotid1.3×1.1Painless nodule for 1 monthAciCCT1NOM0RPNED (43)6M43Right Parotid2.6×1.8Painless nodule for 1 year and postoperative recurrence for 2 months AciCCT2N0M0 RPLost7M21Right Parotid2.5×1.7Painless nodule in 6 monthsAciCCT2N0M0RPLost
AciCC: acinic cell cancinoma; ND: neck dissection; RP: radical parotidectomy; RT: radiotherapy; NED: no evidence of disease.
2.2 病理学检查
大体观察:7例病例均为单发结节,结节直径1.3~3.5cm,平均直径(2.77±1.33)cm,2例结节界限清楚,5例与周围涎腺分界不清,肿块切面多为灰白色,质地偏软或中等硬度。组织学形态如图1所示:镜下显示2例病例具有薄包膜,5例向周围涎腺组织浸润性生长,肿瘤呈多结节状,结节被纤维组织分隔(图1A),其中1例间质富于淋巴细胞(图1B),肿瘤细胞排列成腺管状,微囊样及实性(图1C),腺腔及微囊内可见嗜酸性分泌物,类似甲状腺滤泡(图1D),其中2例具有乳头状结构,乳头内细胞呈鞋钉状突起(图1E),肿瘤细胞呈圆形、卵圆形,细胞核圆,可见小核仁,胞浆嗜酸性或空亮,核分裂少见(图1F)。

图1 MASC的组织学形态
Figure1.HistopathologyofMASC
A. All cases showed a mass divided by fibrous septa (40×); B. One case showed a background of abundant lymphocyte (200×); C. The tumors are composed of solid structures (200×); D. The tumors are composed of microcystic and tubular with abundant homogeneous secretion (200×); E. The tumors are composed of papillary structures (200×); F. The tumour cells have eosinophilic granular or vacuolated cytoplasm with small, uniform nuclei (400×).
2.3 免疫组化染色
7例病例均弥漫强阳性表达CK7(图2A)、Vimetin(图2B)、S-100(图2C)及Mammaglobin(图2D),强弱不等地表达GATA-3(图2E),7例均不表达P63、DOG1(图2F)及CD117,Ki-67增殖指数均较低(2%~15%)。详见表2。
表2 7例MASC免疫组化结果
Table 2. Results of Immunohistochemical Study: 7 Cases of MASC

CaseImmunohistochemical markerCK7VimentinS-100MammaglobinP63GATA-3DOG1CD117Ki-671++++++++++++-+--6%2++++++++++++-++--2%3++++++++++++-++--15%4++++++++++++-+--10%5++++++++++++-+++--10%6++++++++++++-++--10%7++++++++++++-+--8%

图2 MASC的免疫组织化学特征
Figure2.ImmunohistochemistryofMASC
A. Immunostaining for CK7 shows cytoplasmic positive results(100×). B. Immunostaining for Vimentin shows cytoplasmic positive results (100×). C. Immunostaining for S-100 shows strong, diffuse nuclear and cytoplasmic positive results (100×). D. Immunostaining for Mammaglobin shows cytoplasmic positive results (100×). E. Immunostaining for GATA-3 shows moderate nuclear positive results (200×). F. Immunostaining for DOG-1 shows negative results (100×).
3 讨 论
涎腺分泌性癌是新近命名的一种恶性涎腺型肿瘤,特征为存在t(12;15)(p13;q25)特异性ETV6-NTRK3基因融合,在2010年由Skálová 等首次报道[6]。他们发现了16例涎腺肿瘤具有与发生于乳腺的分泌性癌一样的形态学特征,肿瘤呈分叶状生长方式,肿瘤细胞排列成微囊样和腺样,部分可呈实性及乳头状结构,腺腔及微囊内可见嗜酸性分泌物,细胞核卵圆形,异型性小,胞浆淡染或嗜伊红,核分裂及坏死少见;肿瘤细胞弥漫强阳性表达CK7、CK8、CK18、S-100、Vimentin、EMA、STAT5、Mammaglobin,但是基底细胞/肌上皮细胞标记物P63、calponin、CK14、SMA和CK5/6不表达,Ki-67阳性率不高(5%~28%),并且14例病例中提取的RNA可满足ETV6-NTRK3融合基因转录分析,其中13例检测结果为阳性,具有ETV6-NTRK3融合转录。因此,他们认为这是一类有别于涎腺其他类型肿瘤的独立分类,将其命名为MASC。随后,国内外多位学者对这类肿瘤进行了报道[6],发现MSAC常发生于腮腺,少数可见于小涎腺[7],男性多见,临床表现多为缓慢生长的肿物,病程2至36个月不等[8-9]。我们本组研究病例的中位年龄、性别比例、临床资料以及镜下表现及免疫组化表达特征均与文献报道一致。
在鉴别诊断中,最容易与MASC混淆的涎腺肿瘤为AciCC[10],并且目前研究报道的MASC大多都被诊断为AciCC[11-12]。Connor等[13]认为,S100、STAT5和Mamoglobin是诊断MASC比较特异的标记物,而CK7、CK8、CK18、CK19、GCDFP15和EMA在涎腺的其他肿瘤中也会表达。MASC的免疫表型特征证实了其来源与AciCC不同,前者来源于涎腺纹状管,而后者来源于腺泡细胞和润管。Bishop等[14]认为,AciCC具有明显的胞浆内颗粒,并且很少发生于腮腺以外的小涎腺,免疫组化能很好地区分两者,MASC表达Mammaglobin、S-100和Vimentin,不表达DOG1,而AciCC表达刚好相反,两者的具体鉴别见表3[15]。在我们的研究中,7例MASC既往均被诊断为AciCC,通过再次阅片,发现这7例病例肿瘤细胞胞浆均嗜酸性,胞浆内不能观察到酶原颗粒,由此可见并不符合AciCC的形态学特点,与文献报道一致,表达Mammaglobin、S-100及Vimentin,不表达DOG1及CD117。由于开展本研究时条件受限,未能获得适宜的标本,故未行基因检测。
表3 AciCC与MASC鉴别要点
Table 3. Clinicopathologic Differences between MASC and AciCC
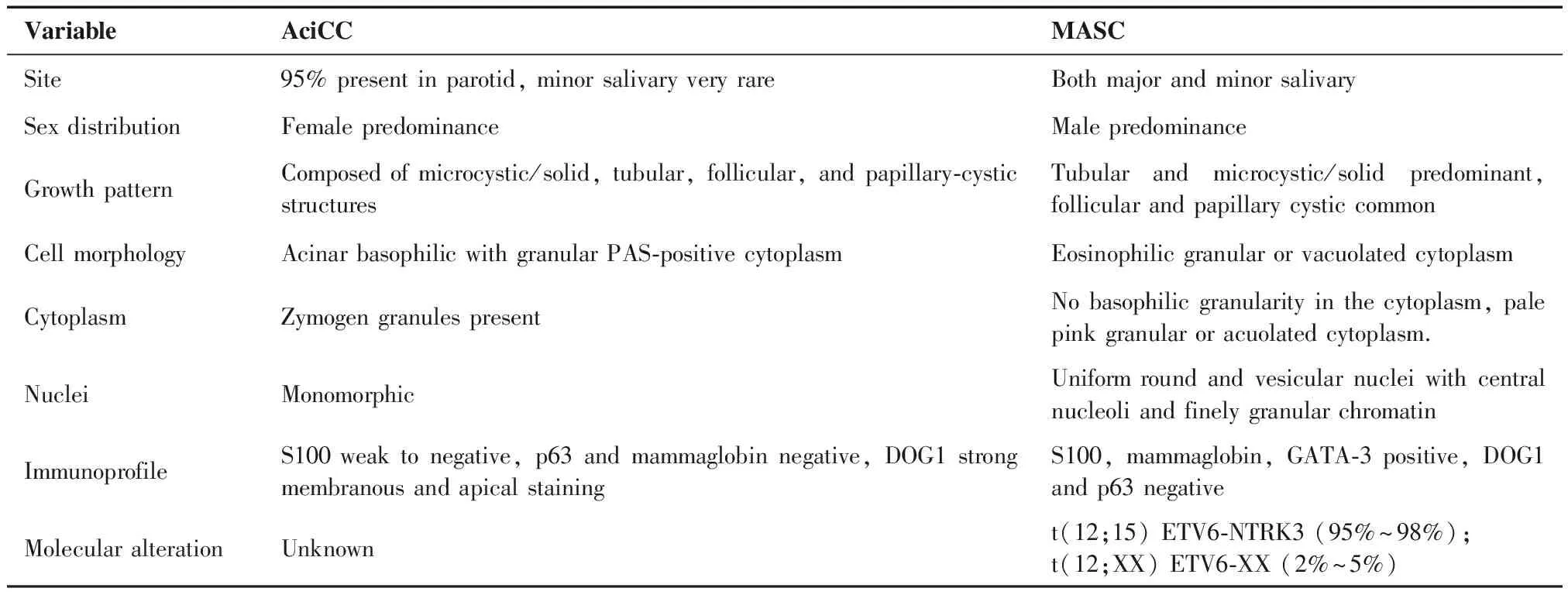
VariableAciCCMASCSite95% present in parotid, minor salivary very rareBoth major and minor salivarySex distributionFemale predominanceMale predominanceGrowth patternComposed of microcystic/solid, tubular, follicular, and papillary-cystic structuresTubular and microcystic/solid predominant, follicular and papillary cystic commonCell morphologyAcinar basophilic with granular PAS-positive cytoplasmEosinophilic granular or vacuolated cytoplasmCytoplasmZymogen granules presentNo basophilic granularity in the cytoplasm, pale pink granular or acuolated cytoplasm.NucleiMonomorphicUniform round and vesicular nuclei with central nucleoli and finely granular chromatin ImmunoprofileS100 weak to negative, p63 and mammaglobin negative, DOG1 strong membranous and apical stainingS100, mammaglobin, GATA-3 positive, DOG1 and p63 negativeMolecular alterationUnknownt(12;15) ETV6-NTRK3 (95%~98%);t(12;XX) ETV6-XX (2%~5%)
MASC大多数为低度恶性,生物学行为较惰性,但也可以局部复发和远处转移。据文献报道[16],MASC的无瘤生存时间从71至115个月不等,较AciCC短(92至148个月),淋巴结转移率也比AciCC高。在本研究中,7例病例4例获得随访资料,均无复发、死亡及远处转移。Connor等[13]认为具有实性结构的MSAC比具有微囊结构的更具有侵袭性,少数高级别转化的病例可导致死亡[17]。在治疗方面,MASC没有统一的治疗标准和特殊的治疗方法,和AciCC一样以手术切除为主,并进行术后放疗。据文献报道[18],对于腮腺浅叶肿瘤及病理诊断为低级别的恶性肿瘤应行腮腺全切,腮腺全切是影响患者术后复发转移的独立因素。Drilon等[19]报道了一例MSAC患者对酪氨酸激酶抑制剂恩曲替尼(Entritinib)治疗长期敏感;恩曲替尼主要针对携带NTRK(NTRK1,NTRK2和NTRK3)、ROS1或ALK基因融合的患者,但此患者最终因为 NTRK3 G623R突变而耐药。
MASC属于少见肿瘤,其全球发病率尚无文献报道。我们的研究中回顾了117例涎腺恶性肿瘤的病理切片,发现MASC占同期涎腺恶性肿瘤的5.98%(7/117)。随着对其认识的深入,发病率可能会有所提高。由于这类肿瘤为新定义的肿瘤,并且易被误诊为AciCC,故临床病理医生应在日常工作中提高警惕加强对这类肿瘤诊断要点及鉴别诊断的认识,避免误诊及漏诊。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:全部作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
