3D打印模板联合CT引导粒子植入治疗前列腺癌一例报告并文献复习
2019-08-21张宏涛苏晓华梁岩松高贞于慧敏赵金鑫隋爱霞王娟
张宏涛 苏晓华 梁岩松 高贞 于慧敏 赵金鑫 隋爱霞 王娟
放射性粒子植入因其微创、不开刀、并发症少、疗效确切等优点在欧美等国家已经作为早期前列腺癌的首选根治性治疗手段[1-3]。目前所用标准术式仍为1983年Holm教授首创:患者取截石位,直肠超声探头联合模板引导,经会阴部沿身体长轴穿刺前列腺进行粒子植入[4]。此术式可重复、精准的按照术前计划植入粒子。但是该术式复杂的过程给老年患者带来一定负担,如全身麻醉的潜在风险、手术时间较长、患者长时间保持截石位,均增加了下肢静脉血栓的发生风险,且穿刺针道较多加重手术创伤。另外,超声图像在识别粒子位置方面不如计算机断层扫描(CT)图像清晰明确。临床亟需一种简洁、安全且精准的术式来弥补传统前列腺癌粒子植入术的不足。3D打印模板引导粒子植入手术前后剂量参数有很好的一致性[5],本研究开创性地将3D打印模板应用于前列腺癌的粒子植入,改变了传统术式对麻醉、手术体位及引导方式的要求,报告如下。
1 病例报告
患者 男性,62岁,主因“尿频、尿急2年余,前列腺癌放疗后22 d”于2018年6月12日入我院。患者于2015年11月因尿频、尿急就诊于当地医院,血清前列腺特异抗原(PSA)为12.75 ng/ml,于直肠超声引导下行前列腺穿刺活检,病理回报为前列腺腺泡腺癌,Gleason评分3+4=7分。分期cT4N1M0Ⅳ期,遂给予内分泌治疗(比卡鲁胺片50 mg口服,1次/d,醋酸戈舍瑞林缓释植入剂3.6 mg间隔28 d皮下注射1次),2个月后患者PSA降至 4.4 ng/ml。2017年9月8日患者血清PSA为4.19 ng/ml,改为口服氟他胺,效果不佳。2018年3月12日患者血清PSA升至10.06 ng/ml。行强化CT及核磁共振(MRI)检查示前列腺癌较前增大,侵犯精囊。于当地医院行前列腺癌放疗,处方剂量66 Gy/33次。放疗至60 Gy/30次时因患者不能耐受放疗直肠不良反应而停止放疗,肿瘤放疗剂量不足,故入我科行进一步治疗。患者2年前曾患前壁心肌梗死,治疗后好转,无高血压、糖尿病、肝炎、结核等病史。本次查体:肛门及外生殖器未见异常,无外痔、肛裂、脱肛及肛瘘等。直肠指诊:直肠前壁质地稍硬,可触及质硬前列腺,体积稍大,边界不清,未触及明显结节,退出指套无染血。MRI检查示前列腺癌侵犯双侧精囊及膀胱后壁。血清PSA为10.16 ng/ml。诊断:前列腺腺癌cT4N1M0Ⅳ期放疗后;冠心病,陈旧前壁心肌梗死。
因患者冠心病不能耐受全麻和连硬外麻醉,故于2018年6月19日在局麻下行3D打印模板引导后入路125I放射性粒子植入术。术前一周用负压真空垫俯卧位固定患者,强化CT扫描,行术前计划。根据肿瘤与直肠、膀胱、尿道、血管、骨骼等危及器官的关系设计进针路径,载入粒子(图1)。剂量参数为:靶区 D90:51.9 Gy,D100:25.8 Gy,V90:94.9%,V100:91.8%,V150:58.7%,直肠:D2cc:26 Gy,尿道:D10:75.2%,D30:61.8 Gy,粒子活度 0.3 mCi。达到靶区及危及器官剂量要求后将计划数据发送至北京启麟科技有限公司,公司将数据经三维重建处理后(图2)连接3D打印机打印3D模板(图3)。手术时按术前定位体位固定患者,消毒后将3D打印模板按患者体表标记点固定于臀部皮肤上,局部1%利多卡因麻醉,扫描CT确认模板位置无误后在模板预设针道上穿刺(图4),一般先穿刺至预计深度的1/3~1/2,再次扫描CT,确定植入针位置,如果位置准确,直接穿刺到预计深度,如果有偏移,调整后再次扫描CT确认,直至准确穿刺到预计位置为止(图5)。根据术前计划植入粒子。即刻扫描CT,行术后验证计划(图6),剂量不足及时补充。术后验证示所有粒子按术前计划精准植入到肿瘤内部,共植入粒子50 颗 。 靶 区 D90:53.4 Gy,D100:32.2 Gy,V90:96.9%,V100:93.6%,V150:60%,直肠:D2cc:21.4 Gy,尿道:D10:100.7 Gy,D30:91.5 Gy,各参数与术前计划基本一致(图7)。尿道及直肠前壁剂量在耐受剂量以下。术后3 d拔出尿管,无排尿不畅。术后2个月复查:PSA降至6.93 ng/ml。影像学检查评价为肿瘤稳定(图8)。患者无排尿排便不适。
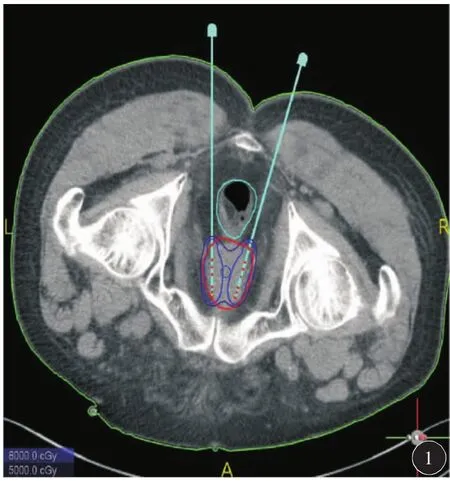
图1 术前计划设计进针路径,经直肠两侧穿刺前列腺。载入粒子计算等剂量线分布
2 讨论
1.前列腺癌粒子植入术式变迁:1914年Pasteau等[6]最早经尿管用镭针治疗前列腺癌,拉开了前列腺癌近距离治疗的序幕。但经尿道照射使得尿道剂量高于靶区剂量,并发症发生率较高。1917年Barringer等[7]在直肠指诊引导下经会阴用镭针插植治疗前列腺癌,开启了前列腺癌组织间插植放疗的先河。1920年美国纪念医院的Failla等[8]开始将镭包在微型玻璃管内永久性植入前列腺癌内部,1926年他又开始用金包裹的镭粒子治疗前列腺癌[9]。因为镭的半衰期为1600年,永久性植入防护困难且容易造成放射性污染,1972年Whitmore等[10]首创耻骨后术中直视下永久性125I粒子植入治疗前列腺癌术式,为前列腺癌125I粒子植入技术奠定了基础。但此术式是在术中直视下人工植入,操作相对复杂且剂量分布不一,后期医生们更倾向于前列腺根治术或外放疗[4]。随着超声引导在粒子植入术中的广泛应用[11],1983年Holm等[12]首创的直肠超声联合模板引导经会阴粒子植入术式在1990年基本完善[13],几十年来一直作为前列腺癌粒子植入标准术式被广泛应用。20世纪80年代末,被Ragde引入美国,经过20余年的应用和研究,积累了大量临床数据,证实了此技术在前列腺癌中的良好效果[14-15]。
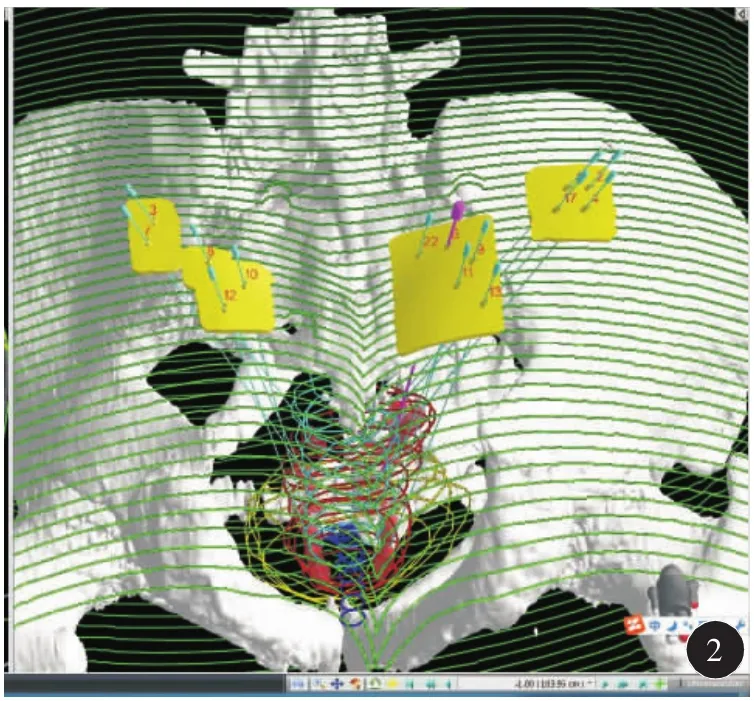
图2 计算机三维重建靶区、危及器官、针道及模板

图3 根据术前计划设计打印个体化3D微创导向模板
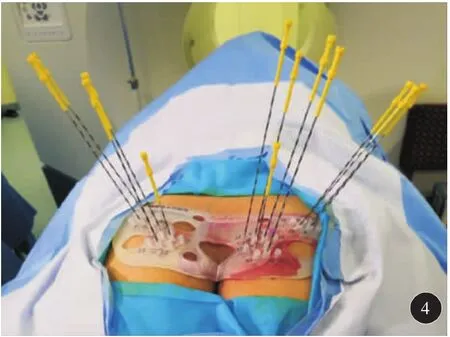
图4 术中模板复位准确后在模板预设针道引导孔内穿刺粒子植入针
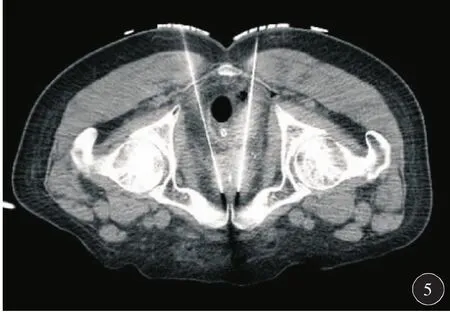
图5 CT扫描确认植入针实际位置与计划一致
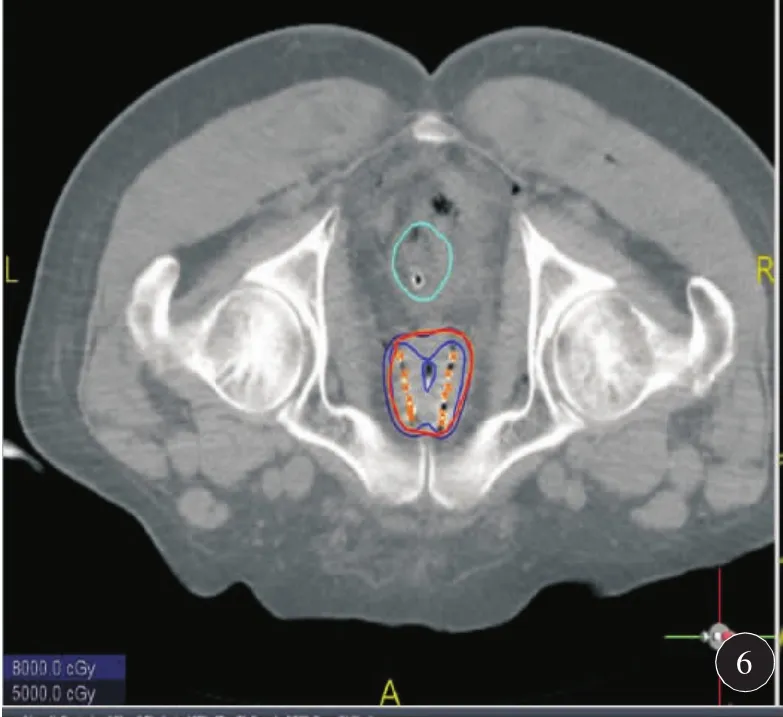
图6 按术前计划植入粒子后CT扫描确认粒子位置并行术后剂量验证
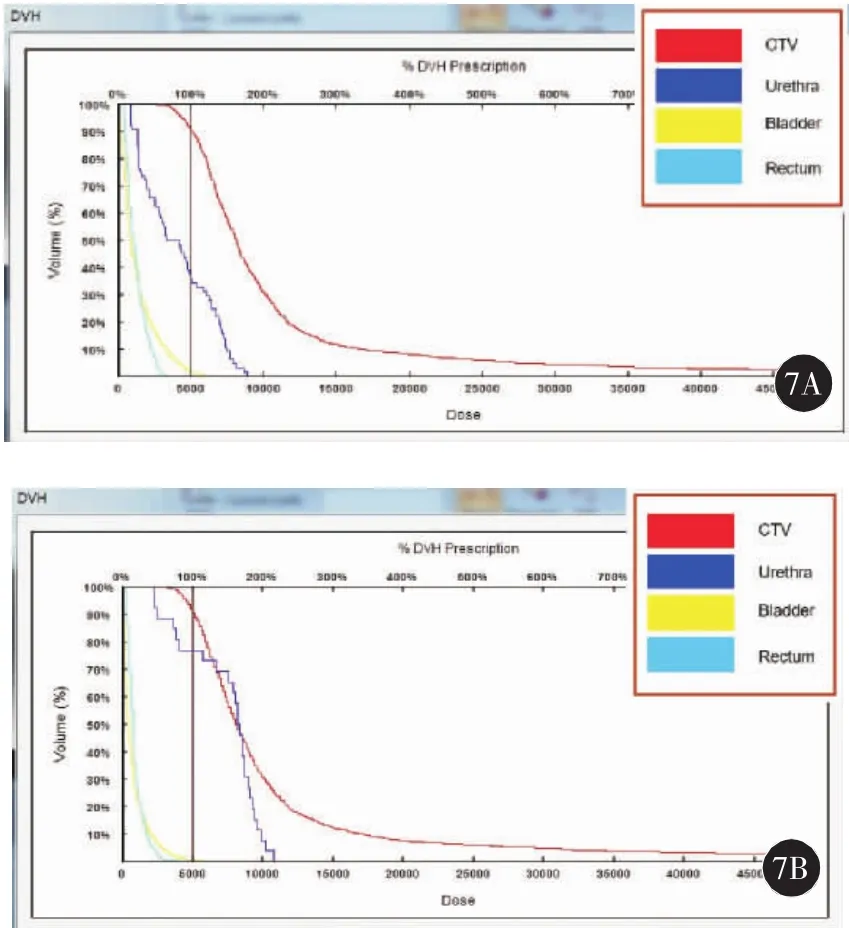
图7 手术前后剂量体积直方图(DVH)对比,术后剂量参数满足术前计划要求(7A:术前;7B:术后)
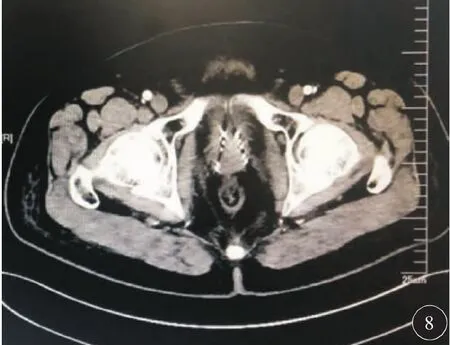
图8 术后2个月复查,肿瘤大小无变化、肿瘤稳定
2.前列腺癌粒子植入标准术式不足及应用中易出现的问题:前列腺癌粒子植入标准术式需要手术医师同时具备放疗剂量学及超声学知识,同时需要麻醉师对患者进行全麻或连硬外麻醉。在我国,超声科医生多做诊断方面的工作,无放疗相关资质,放疗科医生熟悉CT影像而很少应用超声。泌尿外科医生多以外科手术治疗为主,很少关注粒子植入,因此该术式在我国开展并不广泛。传统的前列腺癌粒子植入术需要对患者进行硬膜外麻醉后取截石位经直肠超声引导下完成,部分患有心肺脑血管疾病的老年患者难以耐受麻醉及手术,且手术时间较长,部分患者不能耐受,长时间截石位增加了下肢静脉血栓的风险,穿刺针道较多加重了手术创伤,需要超声、介入、放疗多科医生配合,超声图像识别粒子困难。即使美国近距离治疗协会及美国医学物理学家协会有明确的指南来规范此术式的流程及质控指标,但是仍有部分医院不能按照指南要求植入粒子,导致部分患者出现严重并发症。2002-2012年间,美国在前列腺癌粒子植入手术过程中出现诸多差错,致使《纽约时报》长篇报道[16],美国原子能管理委员会(NRC)介入调查[17]。期间共有346例前列腺癌患者被确定为不良事件,仅2008年不良事件就超过了100例。其中104例不良事件来自植入针及粒子位置错误导致术后剂量与术前计划不一致[18]。此问题的主要原因为手术医师未能准确识别超声图像,术中超声设备故障和粒子植入技术不佳[18]。由此可见,超声引导的标准术式有其固有的不足之处,需要解决。如果术中用CT引导,则基本可以避免此类错误发生。数年来,应用平面模板联合CT及MRI引导粒子植入的研究从未中断,但因为穿刺针道必须平行,难免损伤前列腺周围的危及器官,至今尚难以取代传统术式[19-21]。
3.3D打印模板在粒子植入术中的应用:为了解决模板引导时针道多角度穿刺的问题,Huang等[22]在2012年即开始应用个体化模板引导粒子植入治疗头颈部肿瘤。本课题组2016年3月最早发表关于3D打印模板引导粒子植入相关论文,其中一例直肠癌复发患者在局麻下由3D打印模板引导成功实施粒子植入手术[5]。后期的系列研究证实了3D打印模板引导粒子植入在各部位肿瘤中均有良好的穿刺准确性和术前术后剂量一致性[23-27]。在充分的前期研究基础上,本研究首次在局麻下应用3D打印模板及CT引导从臀部皮肤进针,经直肠两侧穿刺前列腺并植入粒子,术后验证剂量参数与术前基本一致,取得了成功。
本方法虽然存在术前计划设计耗时、3D打印模板复位需要一定技巧和穿刺路径较长致针道偏移等问题,但是任何新技术都有一个学习曲线。除了以上些许不足,此术式相比于传统术式优势明显。首先,该术式适应证更加广泛,局麻下经皮后入路降低了对患者心肺功能的要求,提高了患者的术中舒适度,患有心肺脑血管疾病的老年患者亦可接受治疗;其次,该术式提高了手术效率,不用按照全麻手术进行术前准备,不用特殊的肠道准备,简化手术流程,可由任何一位具有一定穿刺经验和CT影像学知识的医师完成,降低了对多学科协作的依赖性,缩短了手术时间。另外,该术式术前通过计算机提前将针道设计完成,所有针道均避开血管、肠管等危及器官,术中完成模板复位固定后,即可按术前计划精准穿刺肿瘤,同时针道数目也少于传统术式,因此该术式穿刺的副损伤更小。
