美洲大蠊提取物抑制LPS诱导的人牙龈细胞与牙周膜细胞的炎症反应
2019-08-19薛丽张双高鹰李黎仙杜俊蓉
薛丽 张双 高鹰 李黎仙 杜俊蓉
目前,抗生素是临床牙周病治疗的常用药物,但长期服用抗生素不仅容易产生耐药性,而且会进一步加重口腔菌群紊乱、促进疾病发展[1]。人牙龈成纤维细胞(human gingival fibroblasts,HGFs)和牙周膜细胞(human periodontal ligament cells,HPDLCs)是牙周组织的主要细胞类别[2]。研究表明,牙周组织感染的细菌裂解后释放脂多糖(lipopolysaccharide,LPS),可作用于HGFs与HPDLCs细胞膜上模式识别受体Toll 样受体4(toll-like receptor 4,TLR4),从而激活TLR4/NF-κB信号通路,上调NF-κB转录调控的多种炎症因子的表达,介导牙周组织的炎症反应和损伤,促进牙周病的发生发展[3]。因此,建立体外原代的HGFs与HPDLCs细胞模型,筛选干预LPS介导的炎症反应的有效天然产物,可望为进一步研发安全有效的牙周病防治健康产品提供科学依据。
美洲大蠊(Periplanetaamericana L.),属于昆虫纲蜚蠊科蜚蠊亚目,俗称“蟑螂”,其药用历史悠久,可用于治疗儿童疳积、扁桃腺炎、痈疮肿痛等。近年来,人们对美洲大蠊的研究日益增多,研究结果显示美洲大蠊具有促进伤口愈合、抗肝炎、抗溃疡、提高免疫力等多种药理活性[4-8];肖小芹等[9]报道美洲大蠊提取物(periplanetaamericana extract,PAE)具有显著的抗炎活性,可抑制小鼠耳廓炎性肿胀和大鼠足跖炎性肿胀。目前,PAE对牙周病的研究尚未见报道。本实验旨在从细胞水平探讨PAE对LPS诱导的2 种人源牙周病细胞模型的炎症反应的影响及潜在的作用机制,以期为牙周病的防治提供新的治疗策略。
1 材料与方法
1.1 细胞与药物来源
人牙龈成纤维细胞和牙周膜细胞源于四川大学华西口腔医院;PAE源于云南白药集团股份有限公司。
1.2 试剂
LPS(E. coli O55:B5)(Sigma公司,美国);DMSO、MTT、青霉素和链霉素(Amresco公司,美国);α-MEM培养基(Hyclone公司,美国);胎牛血清(北京民海生物科技有限公司);IL-6 ELISA试剂盒(北京达科为生物技术有限公司);羊抗兔NF-κB-p65单克隆抗体(北京中杉金桥生物技术有限公司);兔抗MMP2多克隆抗体(沈阳万类生物科技有限公司);兔抗TLR4单克隆抗体、羊抗兔FITC、SABC试剂盒、DAB显色试剂盒、Mayor's苏木素(武汉博士德生物技术有限公司)。
1.3 细胞培养
将冻存的原代HPDLCs和HGFs复苏,用α-MEM培养基(含10%胎牛血清、1%青霉素、1%链霉素),在37 ℃、5%CO2培养箱中培养,按1∶3传代,选取4~8 代细胞用于实验。
1.4 实验分组
将HGFs和HPDLCs随机分为对照组,LPS组(1 μg/ml LPS)和PAE干预组。其中HGFs细胞所用PAE药物浓度分别为0. 5、1和2 mg/ml(PAE-0.5组,PAE-1组,PAE-2组),HPDLCs细胞所用PAE药物浓度分别为0.05、 0.1和 0.2 mg/ml PAE(PAE-0.05组,PAE-0.1组,PAE-0.2组)。
1.5 MTT法测定PAE对细胞活性的影响
将细胞悬浮液 (1×104个/孔) 接种于96 孔板,于37 ℃、5%CO2孵箱中培养24 h,按分组给药,每组设3 个复孔,24 h后,每孔加入10 μl(5 mg/ml)MTT ,再继续培养4 h,弃上清,每孔加入150 μl DMSO,常温下震荡10 min。于490 nm 波长处测吸光度值,计算细胞存活率(细胞存活率=实验组A490/空白组A490×100%)。实验重复3 次。
1.6 ELISA法测定IL-6含量
将生长良好的HGFs和HPDLCs(1×104个/孔)接种于96 孔板,于37 ℃、5%CO2培养箱中培养24 h,按分组给药,每组设9 个复孔,收集细胞培养上清,按ELISA试剂盒说明书检测IL-6含量。
1.7 免疫染色法测定TLR4、MMP2的表达及NF-κB-p65的核转状况
将生长良好的HGFs和HPDLCs(1.5 ×104个/孔)接种于含细胞爬片的24 孔板,于37 ℃、5%CO2孵箱中培养24 h。按实验分组进行TLR4、MMP2和NF-κB-p65的免疫染色,光学显微镜下观察TLR4、MMP2的阳性表达及NF-κB-p65的核转状况。
1.8 统计学分析
2 结 果
2.1 PAE对HGFs和HPDLCs细胞活性的影响
与对照组相比,LPS组、PAE干预组HGFs(表 1)和HPDLCs(表 2)细胞活性均无显著差异(P>0.05)。


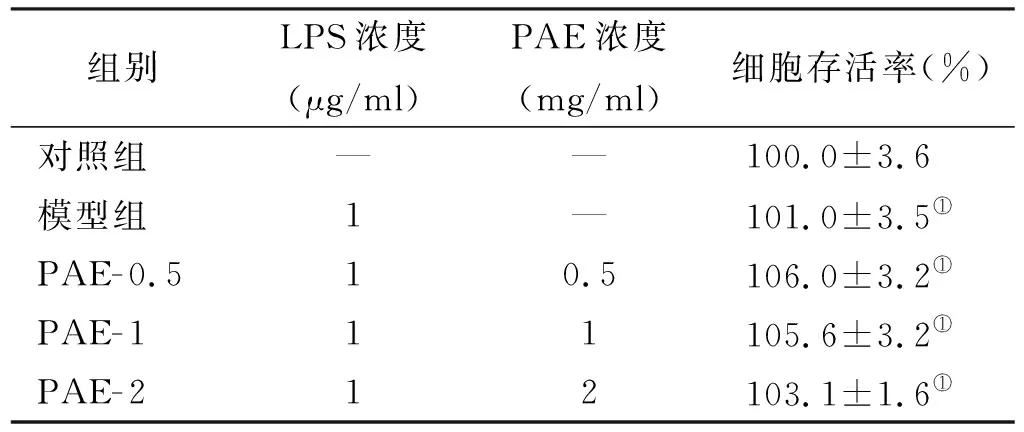
组别LPS浓度(μg/ml)PAE浓度(mg/ml)细胞存活率(%)对照组——100.0±3.6模型组1—101.0±3.5①PAE-0.510.5106.0±3.2①PAE-111105.6±3.2①PAE-212103.1±1.6①
注: ①与对照组比较,P>0.05


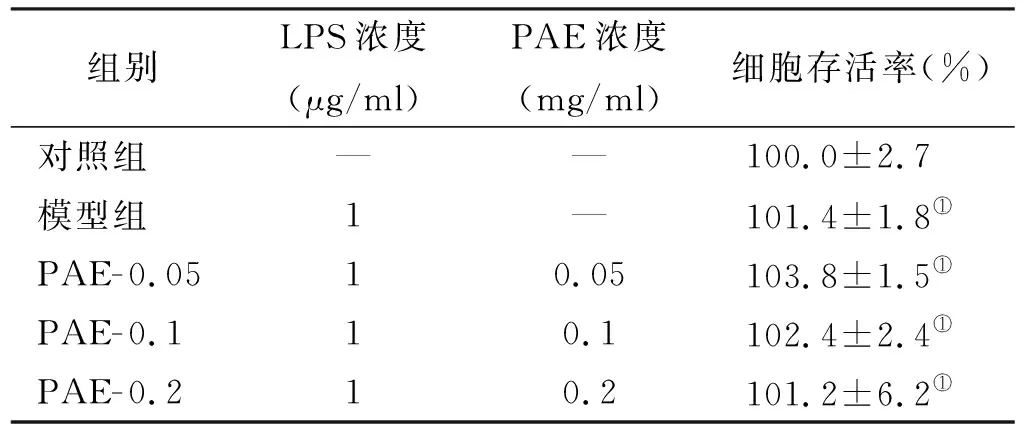
组别LPS浓度(μg/ml)PAE浓度(mg/ml)细胞存活率(%)对照组——100.0±2.7模型组1—101.4±1.8①PAE-0.0510.05103.8±1.5①PAE-0.110.1102.4±2.4①PAE-0.210.2101.2±6.2①
注: ①与对照组比较,P>0.05
2.2 PAE对IL-6含量的影响
与对照组相比,LPS组IL-6含量显著增高,表明LPS诱导可引起细胞的炎症反应。与LPS组相比,PAE干预组HGFs中IL-6含量呈浓度依赖性的下降,其中PAE-2组(2 mg/ml)显著下降(A);PAE干预组HPDLCs中IL-6含量呈浓度依赖性显著下降(B),表明PAE抑制牙龈成纤维细胞(A)和牙周膜细胞(B)IL-6的分泌(图 1)。
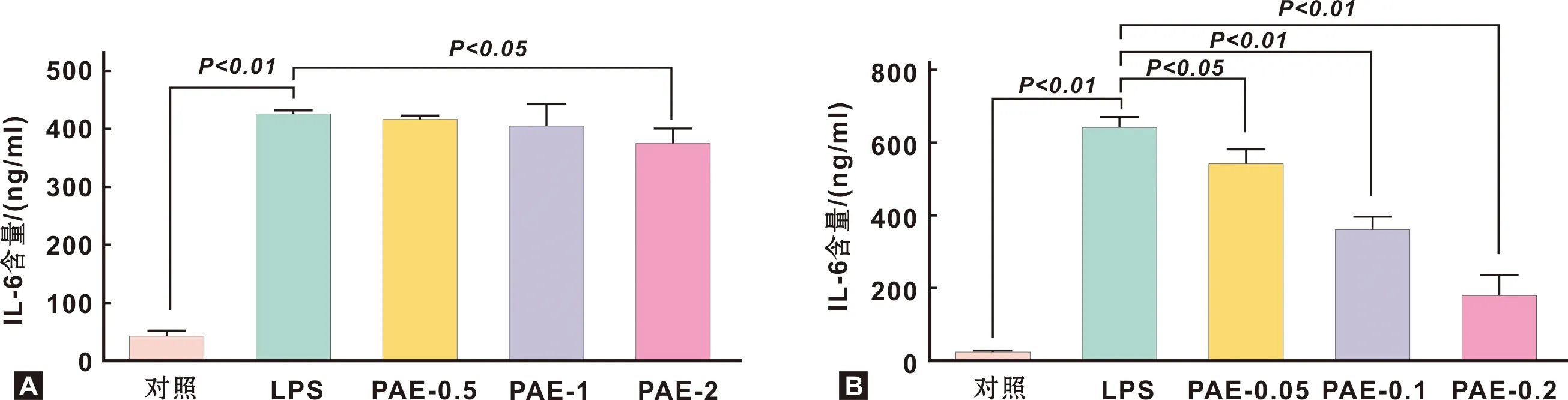
图 1 PAE抑制人牙龈成纤维细胞(A)和牙周膜细胞(B)IL-6的生成
2.3 PAE对TLR4与MMP2蛋白表达的影响
如图 2,与对照组相比,LPS组的TLR4和MMP2阳性表达颜色较深,表明LPS组的TLR4和MMP2蛋白表达明显上调。与LPS组相比,PAE-2组(2 mg/ml)和PAE-0.2组 (0.2 mg/ml) TLR4和MMP2阳性表达颜色明显变浅,提示PAE能有效抑制TLR4和MMP2的蛋白表达。
2.4 PAE对NF-κB活化的影响
如图 3,对照组NF-κB-p65基本分布在胞浆中,LPS组NF-κB-p65核内转明显增多,PAE-2组(2 mg/ml)和PAE-0.2组(0.2 mg/ml)NF-κB-p65的核内转明显减少,提示PAE能有效抑制NF-κB活化。
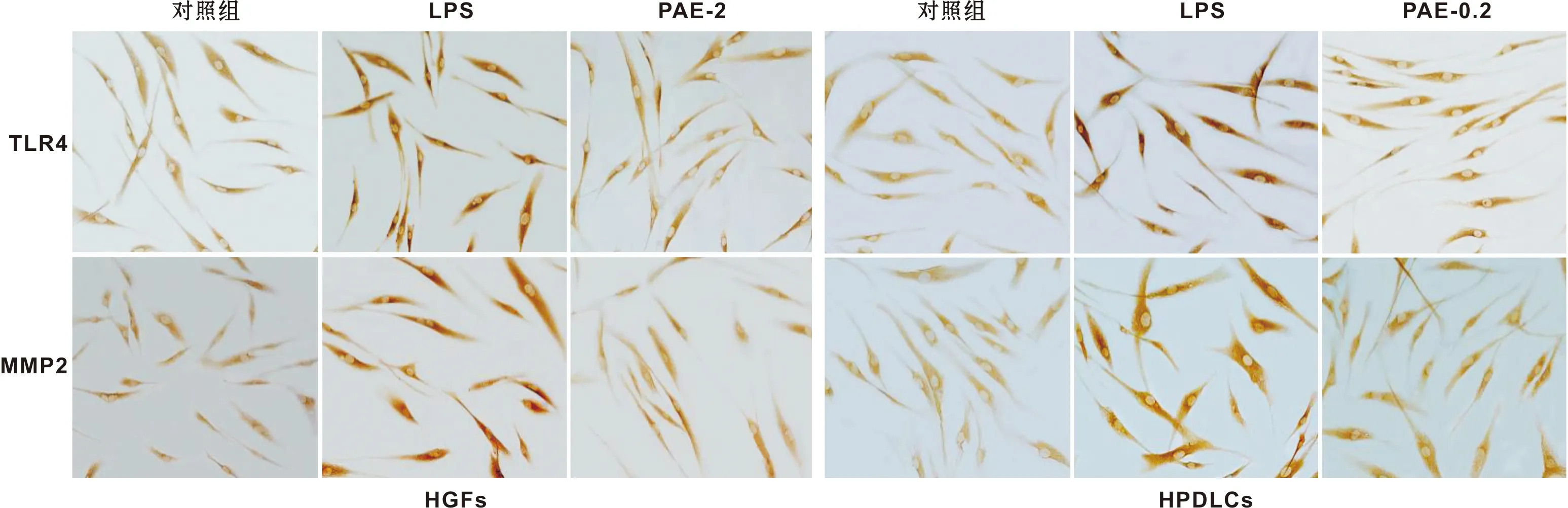
图 2 PAE对人牙龈成纤维细胞和牙周膜细胞TLR4和MMP2蛋白表达的影响 (免疫组化, ×200)
Fig 2 The effects of PAE on the expression of TLR4 and MMP2 in HGFs and HPDLCs (IHC, ×200)
3 讨 论
牙周病是常见的口腔炎症性疾病,其主要致病因子是革兰氏阴性菌的LPS[3]。研究表明,大肠杆菌的LPS与牙周病致病菌牙卟啉单胞菌和伴放线菌聚集菌共享宿主细胞反应的生物活性,引发炎症反应[10-11]。牙龈成纤维细胞和牙周膜细胞是牙周组织的主要细胞群,在牙周组织的再生和修复中起重要作用[2]。在正常状态下,二者能够合成、分泌少量的胶原酶和其他金属蛋白酶,维持细胞外基质。在病理状态下,HGFs和HPDLCs被炎症介质激活,合成及分泌MMPs和炎症因子增加,促使细胞外基质降解[2]。研究表明,与正常人相比,牙周病患者牙周组织中MMP2、IL-6等的表达显著增加[12]。因此,本实验采用大肠杆菌的LPS来刺激HGFs和HPDLCs建立牙周病体外细胞模型,探讨PAE对LPS诱导的HGFs和HPDLCs炎症反应的作用及潜在作用机制。
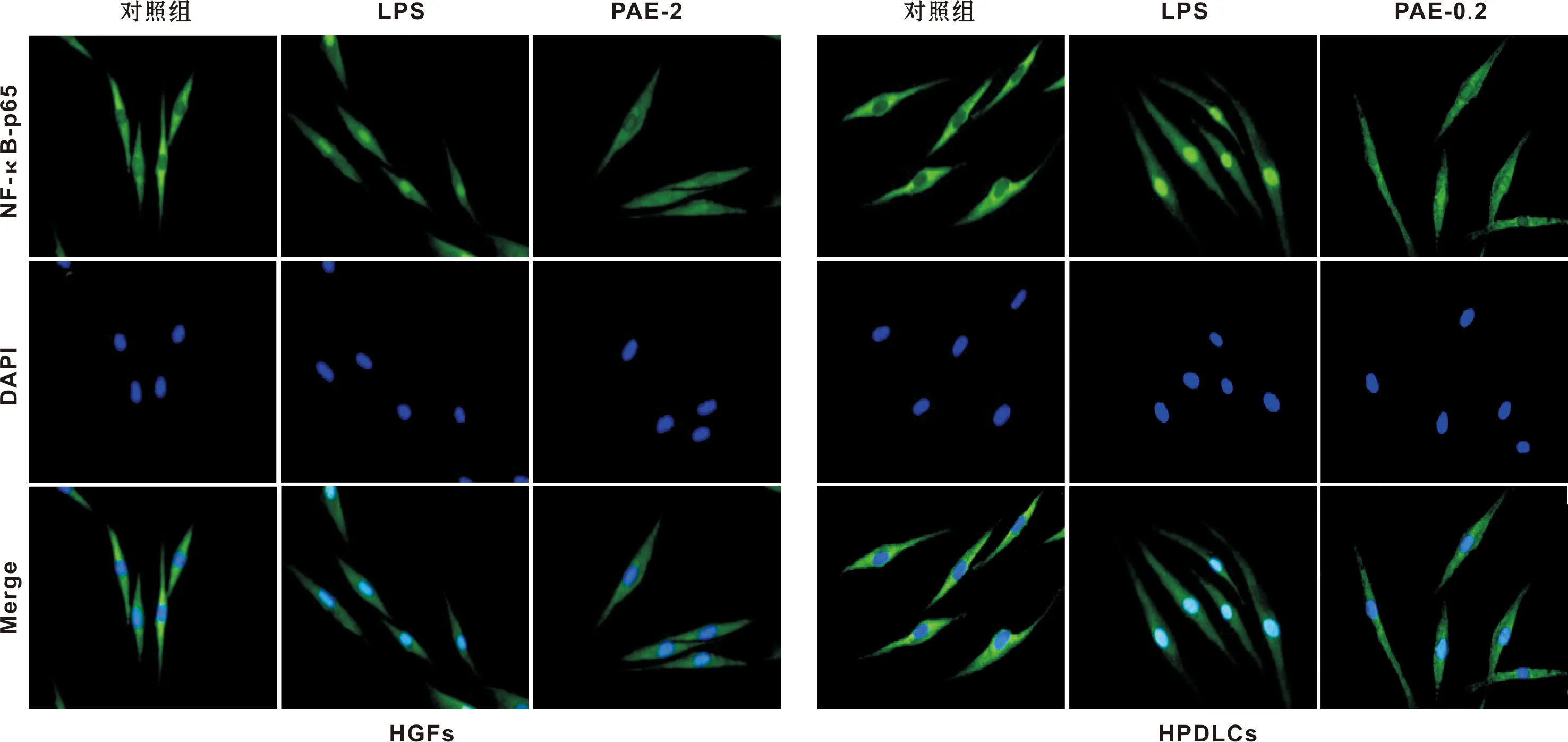
图 3 PAE对人牙龈成纤维细胞和牙周膜细胞NF-κB活化的影响 (免疫荧光技术, ×400)
Fig 3 The effects of PAE on the activation of NF-κB in HGFs and HPDLCs (Immunofluore scence, ×400)
TLR4是LPS的第一模式识别受体[3],不仅存在于单核细胞、巨噬细胞、中性粒细胞等免疫细胞表面,还存在于牙周组织的牙龈成纤维细胞和牙周膜细胞等非免疫细胞表面[2]。LPS与细胞膜TLR4结合后,通过一系列磷酸化的级联反应,促使NF-κB-p65核内转,通过与核内下游靶基因结合,促进其转录及表达,进而诱发IL-6等细胞因子和MMP2等基质金属蛋白酶的炎症表达[13-14]。研究表明,LPS刺激30 min到1 h后,可激活TLR4/NF-κB信号通路的炎症反应[15]。因此,本实验选择LPS作用1 h后,检测TLR4 /NF-κB信号通路及炎症介质表达。本研究结果显示,与对照组相比,LPS组TLR4与MMP2表达、NF-κB-p65活化及IL-6的产生明显增多,PAE-2和PAE-0.2组TLR4与MMP2表达、NF-κB-p65活化及IL-6的产生明显减少。
综上所述,PAE可能通过TLR4/NF-κB信号通路,抑制IL-6的分泌,下调MMP2表达,抑制LPS诱导的人牙龈成纤维细胞和牙周膜细胞的炎症反应。目前,以PAE为有效成分的上市药物主要包括康复新、肝龙胶囊、心脉隆注射液等,分别用于溃疡性结肠炎、乙型肝炎及心衰的治疗。本研究结果为PAE应用于牙周病防治提供了新的实验依据。值得注意的是,PAE对HGFs和HPDLFs 2 种牙周病细胞模型的有效剂量分别是2 mg/ml和0.2 mg/ml,表明HGFs和HPDLFs对PAE的敏感性存在差异。因此,PAE用于在牙周病防治的量效关系还需开展体内有效性研究。
