舌鳞状细胞癌中Bmi-1和P16的表达及对癌细胞侵袭的调控作用
2019-08-19李斌王芳李咏蔡扬
李斌 王芳 李咏 蔡扬
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)具有较高的侵袭力和早期淋巴结转移的特点,尽管目前治疗TSCC方面的诊疗技术在不断的提高,但是TSCC患者的预后仍然不佳,究其原因与TSCC的区域性和远处淋巴转移密切相关[1]。B细胞淋巴瘤滤过性病毒插入位点1(B cell-specific moloney leukemia virus insert site-1,Bmi-1)目前已经被证实属于致癌基因,其在肿瘤的发展过程着扮演着重要角色,Bmi-1的高表达与人类多种肿瘤如胰腺癌、乳腺癌等的预后不良有关[2-3],此外,Bmi-1还可以促进黑色素瘤上皮间质转化的发生,促进肿瘤的侵袭和迁移[4],但目前关于Bmi-1在TSCC中的表达及调控TSCC侵袭的作用及机制报道不多,本研究综合TSCC临床病理及细胞研究,探讨Bmi-1在TSCC侵袭过程中的作用及可能机制,为TSCC的临床治疗研究提供可能靶点。
1 材料与方法
1.1 病理标本
本实验所需53 例TSCC石蜡标本均来自于贵州医科大学附属医院口腔诊疗中心,所有TSCC标本均为肿瘤原发灶,其中高分化33 例、中低分化20 例,其中有淋巴结转移组34 例、无淋巴结转移组19 例。Ⅰ~Ⅱ期12 例,Ⅲ~Ⅳ期41 例。本研究由贵州医科大学附属医院伦理审查委员会批准。
1.2 细胞系
舌鳞癌细胞株(CAL27)由上海交通大学医学院第九人民医院口腔医学重点实验室惠赠。
1.3 试剂
兔抗人Bmi-1多克隆抗体(Santa Cruz,美国);MMP9单克隆抗体(CST,美国);SP免疫组化试剂盒及DAB染色试剂盒(中杉金桥);GAPDH单克隆抗体、山羊抗兔二抗、山羊抗鼠二抗、鼠抗人P16单克隆抗体(福州迈新);Bmi-1抑制剂PTC-209(Selleck,美国);Traswell小室等(Coring,美国);本实验余所用实验仪器均由湖南医药学院生物研究中心提供。
1.4 实验方法
1.4.1 免疫组化 严格按照SP免疫组化试剂盒说明书操作,同时设置阳性和阴性对照组,工作浓度Bmi-1(1∶150),p16(1∶50)。评价标准[5]:Bmi-1阳性为TSCC细胞核染棕黄色或者棕褐色颗粒,胞浆也可有少量棕黄色样颗粒,P16阳性为TSCC细胞核染棕黄色样颗粒,胞质中也可有淡黄染色。最后结果判定用染色强度和染色百分比进行评估:染色强度:阴性染色1分,弱染色2分,中等强度染色3分,强染色4分;染色百分比:阳性细胞百分率≤10%为1分、11%~50%为2分、51%~75%为3分、>75%为4分;根据染色强度和百分比的乘积判定结果,分数≤4分为(-),5分以上为(+)。上述结果至少由两位病理科医生在双盲情况下观察所判定。
1.4.2 细胞培养 TSCC细胞(CAL27)接种于含12% FBS的DMEM/F12培养基中,培养条件为37 ℃,5%CO2的培养箱中培养。
1.4.3 Transwell实验检测 Matrigel基质胶与无血清培养基按照1∶5配比,然后取60 μl均匀铺于Transwell小室的上室中,计数细胞调整细胞密度约为4×108个/L,上室加入终浓度为10 μmpl/L的抑制剂PTC-209处理TSCC细胞,小室下室加入含10% FBS的培养基,24 h后无菌棉签拭去上室多余细胞和基质胶,PBS冲洗,再甲醛固定,0.1%结晶紫染色,于倒置相差显微镜下取4 个视野拍照并计算细胞数目。
1.4.4 蛋白质印迹法检测 Bmi-1抑制剂PTC-209处理后相关蛋白表达的影响 应用10 μmol/L Bmi-1抑制剂PTC-209处理TSCC细胞24 h后,收集细胞,冰上裂解,提取细胞总蛋白。经蛋白浓度定量及水浴变性后行SDS电泳分离蛋白,PVDF膜湿转后,5% BSA封闭2 h,再加入Bmi-1(1∶1 000)、P16(1∶500)、MMP9(1∶1 000)一抗4 ℃恒温冰箱过夜,次日用二抗孵育1 h,化学发光法显影,仪器扫描记录。
1.5 统计学方法
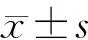
2 结 果
2.1 Bmi-1、P16在TSCC组织中的表达
检测结果如图 1、表 1。53 例TSCC病理组织切片中,Bmi-1(+)有34 例(64.15%),Bmi-1染色强度与临床分期(P<0.05)和淋巴结转移(P<0.05)相关,与分化程度无关(P>0.05),P16(+)有25 例(47.17%),P16染色强度与临床分期(P<0.05)和淋巴结转移(P<0.05)相关,与分化程度无关(P>0.05)。
2.2 Bmi-1/P16表达与TSCC临床病理因素的相关性
如表 2所示:在53例TSCC病理切片中,Bmi-1表达阳性合并P16表达阴性的TSCC病理组织染色强度与临床分期(P<0.05)和淋巴结转移(P<0.05)相关,而与分化程度无关(P>0.05),表 3中再通过Spearman法分析二者相关性显示Bmi-1与P16的表达具有负相关性(r=-0.555,P<0.05)。
2.3 PTC-209对TSCC细胞侵袭能力的影响
如图 2所示:应用抑制剂PTC-209处理TSCC细胞24 h后,与空白对照组比较,抑制剂处理组舌鳞癌细胞的侵袭能力明显降低(P<0.001),提示抑制Bmi-1的表达能降低舌鳞癌细胞的侵袭能力。
2.4 PTC-209处理TSCC细胞Bmi-1、P16及MMP9蛋白表达的影响
应用Bmi-1抑制剂PTC-209处理TSCC细胞后,Bmi-1蛋白表达下调(P<0.001),P16蛋白表达升高(P<0.001),MMP9表达被抑制(P<0.01)(图 3)。

表 1 Bmi-1、P16的表达与临床病理因素间的关系
注: ①P<0.05
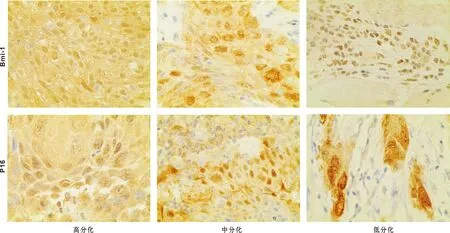
图 1 Bmi-1与P16在TSCC组织中表达情况 (SP, ×400)
Fig 1 Bmi-1 and P16 expression in tongue squamous cell carcinoma (SP, ×400)
表 2 Bmi-1/P16表达与TSCC临床病理因素的关系
Tab 2 Relationship between co-expression of Bmi-1 and P16 and clinicopathological factors

临床病理因素nBmi-1(+)/P16(-)χ2P值组织学分级 高分化33140.7900.374中/低分化2011淋巴结转移 无1948.1070.004①有3421临床分期 Ⅰ/Ⅱ1219.3890.002①Ⅲ/Ⅳ4124
注: ①P<0.05
表 3 TSCC中Bmi-1与P16表达的相关性
Tab 3 Analysis of the correlation between Bmi-1 and P16 expression in TSCC

Bmi-1(-)(+)r值P值P16(-)325-0.5550.000①P16(+)169
3 讨 论
Bmi-1基因是属于PCG(polycomb-group)家族的重要成员之一,在肿瘤的发生、发展过程中扮演着重要角色,广泛参与多种肿瘤的增殖,干细胞的自我更新等活动[6-7]。目前已经被证实,在乳腺癌、胰腺癌等肿瘤

图 2 TSCC细胞中Bmi-1表达对细胞侵袭能力的影响 (×100)
Fig 2 The effect of Bmi-1 on the ivasion of TSCC cells (×100)

图 3 抑制剂PTC-209对Bmi-1、P16和MMP9表达影响
Fig 3 The effect of inhibitor PTC-209 on the expression of Bmi-1, P16 and MMP9
中Bmi-1往往处于高表达水平,通过RNA干扰技术沉默Bmi-1,可以降低肿瘤的恶性生物学行为,达到抑制肿瘤的作用[4,6]。目前关于Bmi-1的表达与肿瘤临床病理因素的关系报道有差异,Vonlanthen等[8]研究非小细胞肺癌的患者时发现,有58%病理组织中Bmi-1的高表达与肿瘤的分化程度、组织学分类以及患者预后无关;而Bmi-1在胃肠道间质瘤中高表达,与胃肠道间质瘤的淋巴结转移、临床分期有关患者5 年生存率等相关[9]。本实验在研究TSCC时亦发现,Bmi-1的高表达与TSCC的淋巴结转移及临床分期相关,与分化程度无关。P16蛋白是一种细胞周期蛋白依赖性蛋白激酶抑制物,在淋巴瘤等等都有检测到P16表达突变或者缺失,进而诱导肿瘤细胞周期调节失控,导致细胞的异常增生[10]。P16在肿瘤组织中的表达丰度,可以作为宫颈癌,胰腺癌癌前病变或癌变的重要指标,为患者的预后提供参考[11]。本研究中,应用免疫组化法染色TSCC组织发现,P16的低表达(或失表达)与TSCC的淋巴结转移及临床分期相关,与分化程度无关。
关于Bmi-1与P16的关系,Wang等[9]研究胃肠道间质瘤时发现组织中Bmi-1高表达的同时也可伴有P16的低表达,且相关性分析显示二者呈负相关性,而本实验也有类似的发现,同时还发现Bmi-1表达阳性合并P16表达阴性的舌鳞癌组织中,有淋巴结转移组较无淋巴结转移组高,同样地临床分期Ⅲ/Ⅳ组较Ⅰ/Ⅱ组高,这提示Bmi-1和P16可能共同参与了舌鳞癌的侵袭和转移过程,二者可能具有叠加效益。
Bmi-1的高表达作为肿瘤恶性程度的重要指标,其广泛参与肿瘤的增殖,干细胞的自我更新,甚至参与肿瘤细胞的上皮间质转化进程,促进肿瘤的侵袭[6]。前面免疫组化发现P16的失表达与TSCC的淋巴结转移相关,而上调P16的表达,可以抑制肝细胞癌的侵袭能力;Bmi-1作为P16的上游基因,其可以通过抑制P16的表达促进肿瘤的发展,这些都提示,在肿瘤侵袭甚至发生淋巴结转移的过程中Bmi-1和P16均有参与。MMP9是基质金属蛋白酶家族主要成员之一,其可以降解肿瘤基底膜的主要成分(IV型胶原蛋白),并在肿瘤血管化、侵袭以及转移的过程中发挥着主要的作用[12]。本研究为证明Bmi-1对舌鳞癌侵袭的作用,再以舌鳞癌细胞株为研究对象,应用Bmi-1抑制剂处理舌鳞癌细胞24 h后发现,舌鳞癌细胞的侵袭能力显著降低,这表明Bmi-1的表达能促进舌鳞癌细胞的侵袭,进而影响舌鳞癌的淋巴结转移和临床分期等。为进一步探讨其可能作用机制,实验应用蛋白印记法检测抑制剂PTC-209处理细胞后相关蛋白表达变化,舌鳞癌细胞Bmi-1表达下降,P16表达上调,此外MMP9表达抑制,而这表明Bmi-1可通过抑制P16蛋白或上调MMP9蛋白,从而促进舌鳞癌细胞的侵袭。
综上所述,Bmi-1的表达与舌鳞癌的淋巴结转移及临床分期密切相关,Bmi-1和P16在TSCC中的表达异常,可能共同参与了舌鳞癌的侵袭过程,Bmi-1可通过下调P16,上调MMP9促进舌鳞癌的侵袭。
