黄原胶对大豆分离蛋白乳状液聚集稳定性的影响
2019-08-19杨晋杰邵国强王胜男赵玲玲董田田杨立娜朱力杰何余堂韩金莲
杨晋杰 邵国强 王胜男 赵玲玲 董田田 潘 杨 杨立娜 朱力杰 李 君 何余堂 韩金莲 张 明 刘 贺
(渤海大学食品科学与工程学院1 ,锦州 121013)(盘锦宋大房食品有限公司2,盘锦 124000)(锦州亿和豆业有限公司3,锦州 121013)
乳状液由两种互不混溶的液体相互分散形成,是一种热力学不稳定的多相体系[1]。食品乳状液中常添加蛋白质和多糖作为稳定剂。蛋白质和多糖可通过静电作用或氢键形成复合物,多糖促进蛋白质在界面上的吸附,提高乳状液的稳定性[2]。
大豆分离蛋白作为一种天然高分子乳化剂,乳化活性高,但其形成的乳状液易受温度、pH等因素的影响,导致乳状液易失稳[3]。黄原胶是一种由细菌Xanthomonascampestris产生的具有三糖侧链的刚性线性阴离子多糖,其特定的聚集态结构及分子间作用力,赋予了其增加乳状液分散相黏度、形成凝胶网络和良好的流变学特性(如假塑性、剪切稀化行为和高模量等),从而抵抗油滴的布朗运动或重力引起的分层等,提高乳状液的稳定性,已被广泛应用于食品乳状液中[4]。流变学特性是研究食品最重要的性质之一,通过测定流体食品的流变学特性,包括黏度随剪切速率的变化,以及振荡流变特性(储能和损耗模量)随温度和频率的变化,可用于研究不同条件下蛋白质-多糖间相互作用的变化[5]。黏弹性等流变行为作为评估乳状液性质的重要手段,可以表征乳状液液滴的聚集,广泛用于乳状液稳定性的预测。Vázquez-Solorio等[6]运用流变学对冷藏期间乳蛋白-黄原胶复合水包油乳状液的性质进行了表征,发现黄原胶流变学在乳状液流变学中占主导地位。Moschakis等[7]运用流变学研究了XG对酪蛋白酸钠稳定的乳状液的相分离的时间依赖性演变,发现低于0.02% (m/V)的XG对乳状液的流变性影响不显著,而0.03%~0.05% (m/V)的XG,产生了具有高低应力剪切黏度的凝胶状网络,抑制了相分离。
目前,关于XG对SPI凝胶性的影响及二者水溶液间的互作的研究较多,而对XG-SPI乳化体系流变特性的研究并不多见。因此,本研究通过分析和表征乳状液储藏过程中流变学特性的变化,再结合粒径和Zeta-电位,明确不同浓度的XG对SPI-XG乳状液流变学特性及稳定性的影响,以期为改良食品乳状液加工工艺和功能特性方面的研究提供参考。
1 材料与方法
1.1 材料与试剂
SPI;非转基因大豆油;XG;叠氮化钠;其他试剂均为分析纯。
1.2 仪器与设备
FJ-200高速分散均质机;FB-110S高压均质机;DHR-1流变仪;BT-9300激光粒度分布仪;Nano-ZS90马尔文激光粒度仪;GB-2A磁力搅拌器。
1.3 方法
1.3.1 乳状液的制备
将SPI配制成0.067 g/mL的水溶液,然后取60 mL SPI溶液与40 mL大豆油混合,形成初级乳状液;再将XG分别配制成0、0.002、0.003、0.004、0.005、0.006 g/mL的水溶液,磁力搅拌过夜至完全水合,然后分别取100 mL XG溶液与初级乳状液以1∶1混合后,利用高速剪切机在10 000 r/min下剪切2 min,再通过高压均质机在50 MPa下均质3次,最终使乳状液包含2%SPI、20%大豆油和0~0.3%XG,最后添加0.02%的叠氮钠抑制微生物的生长,制成的乳状液在4 ℃下储藏,每7 d进行取样分析,检测14 d。将未添加XG的SPI乳状液作为对照组[8]。
1.3.2 粒径大小及分布测定
利用BT-9300ST激光粒度分布仪测定乳状液的粒径大小及分布情况,取0.5 mL乳状液于样品池中,参数设置如下:通用分析模式,以水为分散剂,颗粒折射率1.520,分散剂折射率1.333,激光波长633 nm。采用面积平均径(d3,2)和体积平均径(d4,3)来表征液滴粒径大小[9]。
1.3.3 Zeta-电位测定
利用Nano-ZS90马尔文激光粒度仪测定乳状液的Zeta-电位,取1 mL稀释10 000倍的乳状液于样品池中,测试温度为25 ℃[10]。
1.3.4 流变学特性测定
1.3.4.1 黏度测定
利用DHR-1流变仪对乳状液黏度进行测定,取1 mL乳状液于样品台上,25 ℃下采用40 mm平行板,剪切速率为0.01~100 s-1[5]。
1.3.4.2 频率扫描测定
取1 mL乳状液于样品台上,25 ℃下采用40 mm平行板,扫描频率为0.01~3 Hz,应力为0.8 Pa,检测整个过程乳化体系的模量变化,实验过程中加盖密封圈以避免水分过度蒸发[11]。
1.3.4.3 降温扫描测定
取1 mL乳状液于样品台上,采用40 mm平行板,频率为1 Hz,温度以2 ℃/min由85 ℃降温至25 ℃,检测整个过程乳化体系的模量变化,实验过程中加盖密封圈以避免水分过度蒸发[12]。
1.3.5 统计分析
2 结果与分析
2.1 粒径分析
一般用d3,2评估新鲜制备的乳液的比表面积,d4,3用于表征乳液储藏过程中液滴尺寸分布的变化[9]。由表1可知,第1天时,与对照组相比,添加XG后,随着XG浓度的增加,乳状液的d3,2和d4,3呈现先增大后减小、再增大的变化趋势,添加0.20%XG的乳状液的d3,2和d4,3最小,可能是由于0.10%~0.15%XG与SPI交互作用产生的排斥絮凝作用大于静电稳定作用,导致粒径显著增加(P<0.05)[13-14];当XG浓度达到0.20%时,水相黏度持续的增加,抑制了SPI-XG间的排斥絮凝作用,减少了液滴的运动和碰撞频率[15];随着XG浓度的进一步增大,液滴间絮凝引起的聚集可能导致了粒径的增加(P<0.05)[16]。储藏至7 d时,所有乳状液的d4,3均显著增大,且随着XG浓度的增加,乳状液的d4,3也随之显著增大(P<0.05)。储藏至14 d时,添加0.10%和0.20%XG的乳状液的d4,3显著降低(P<0.05),而随着XG浓度的增加,液滴间的聚集效应降低,絮凝效应增强,导致乳状液的d4,3增大[16]。
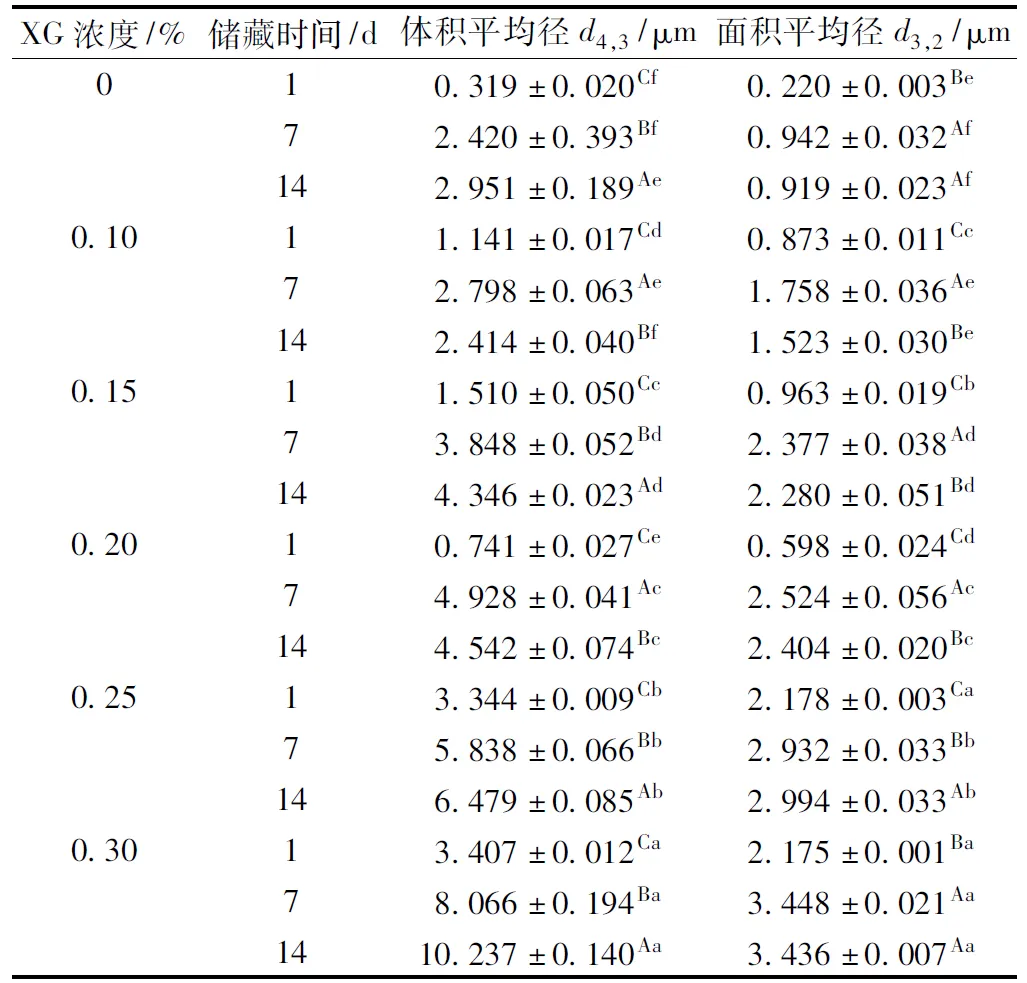
表1 乳状液储藏期间内粒径的变化
注:同列不同小写字母表示同一时间不同样品间的差异显著性,同列不同大写字母表示不同时间下同一样品的差异显著性,P<0.05。余同。

表2 乳状液储藏期间内Zeta-电位的变化
2.2 Zeta-电位分析
Zeta-电位通过反映液滴间的带电性质表征乳状液的稳定性,Zeta-电位绝对值越高,液滴间斥力越大,乳状液的聚集稳定性越高[17]。由表2可知,第1天时,对照组乳状液的Zeta-电位绝对值最小,为17.60 mV;添加XG后,乳状液的Zeta-电位绝对值显著增大(P<0.05),表明XG的添加提高了乳状液的聚集稳定性,可能原因是XG与SPI间的排斥絮凝作用,阻碍了液滴的聚集[13]。其中,添加0.10%XG的乳状液的Zeta-电位绝对值最大,为45.70 mV,表明其所形成的乳状液的稳定性较高;随着XG浓度的增加,乳状液的Zeta-电位绝对值呈先减小后增大的变化趋势,可能是因为过多的XG与SPI间的热力学不相容,随着聚合物浓度的增加,分子间的静电斥力逐渐增大[14]。随着储藏时间的延长,添加0.10%XG的乳状液的Zeta-电位绝对值虽然降低,但均比添加0.15%~0.30%XG的乳状液的Zeta-电位绝对值大,表现出较高的稳定性。
2.3 流变学特性分析
2.3.1 黏度分析
由图1可知,对照组乳状液黏度较低(0.1 Pa·s)。而在低剪切速率下,添加XG的所有乳状液的黏度增加,应力较低;随着剪切速率的增加,克服了液滴间的布朗运动,降低了流动阻力,乳状液的黏度均逐渐减小,应力均逐渐增加。第1天时,与对照组(黏度接近于0)相比,添加XG的乳状液的黏度均明显增大,且随着XG浓度的增加,乳状液的黏度也随之增大,归因于XG处于分散状态时,其可能通过氢键和聚合物形成聚集体,产生高度有序的结构,因此在低剪切速率下表现出较高的黏度;随着剪切速率的增加,聚集体逐渐被破坏,乳状液表现出高度假塑性[18-19]。但第7天时,添加0.10%XG的乳状液在0.01~100 s-1内表现出较高的黏度,可能归因于0.10%XG引发的乳状液液滴间的排斥絮凝,表现出较高的屈服应力,导致其黏度更大,减缓了液滴间的聚集速率,乳状液形成的粒径相对较小[13]。随着储藏期的延长,添加XG乳状液的黏度均有所降低,可能是由于液滴聚集在乳状液储藏前期占主导地位,后期液滴絮凝增强的结果[16]。


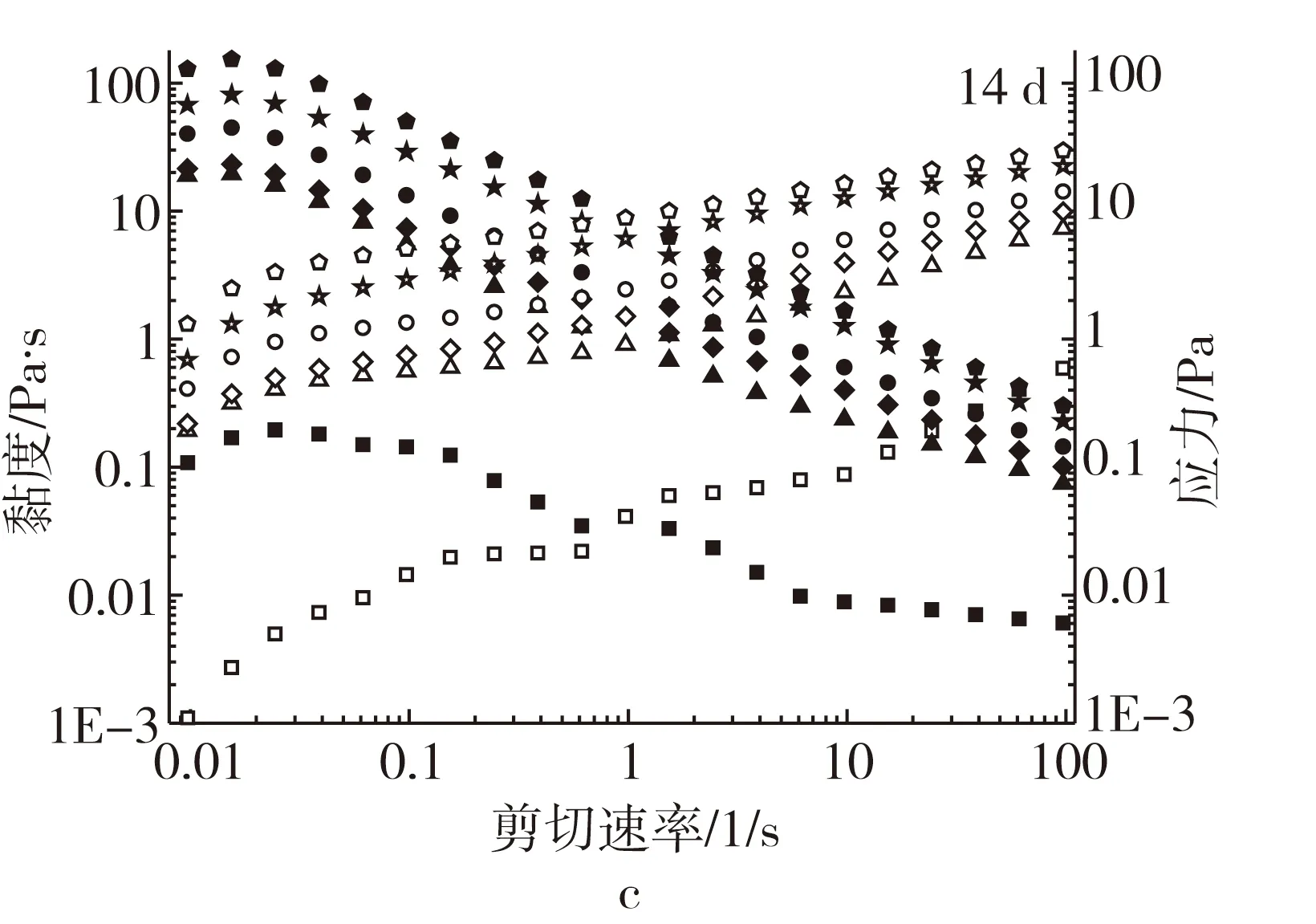
注:正方形、三角形、菱形、圆形、五角星、五边形对应的XG质量分数分别为0%、0.10%、0.15%、0.20%、0.25%、0.30%。实心符号为黏度,空心符号为应力。图1 XG浓度对乳状液黏度和应力的影响
2.3.2 扫描频率分析
不同扫描频率下XG浓度对乳状液G′和G″ 的影响如图2所示。由图2可知,对照组乳状液的G′和G″基本为0;添加XG后,乳状液的G′和G″明显增大,乳状液的G′和G″均呈频率依赖性,且储能模量(G′)大于损耗模量(G″), 显示出黏弹性,表明一种高絮凝的液滴网络结构或XG自身在连续相中凝胶结构的形成[5];随着XG浓度的增加,乳状液的G″稳定增长,但G′增长较快,表明凝胶网络结构的提高[20],这一现象可能是由于多糖网络的形成,也可能是因为蛋白与多糖间的相互作用[16]。其中,第1天时,随着XG浓度的增加,乳状液的G′和G″之间的差距明显增加,表明乳状液的弹性行为逐渐改善,这一结果遵循XG自身分散体显著的黏弹性行为,或在连续相中形成凝胶状结构[21]。随着储藏时间的延长,添加0.10%XG的乳状液的G′呈现先增大后降低的变化趋势,而G″基本保持不变,可能归因于乳状液储存过程中促进了XG弱凝胶网络中的分子重排[21];添加0.15%~0.25%XG的乳状液的G′和G″表现出逐渐降低的趋势,可能归因于乳状液的相分离导致了其凝胶网络结构的破坏;添加0.30%XG的乳状液的G′和G″却不断增加,表明其高度絮凝的液滴网络的形成,每个液滴上的小浮力不足以克服周围弱凝胶网络的有效屈服应力[16]。


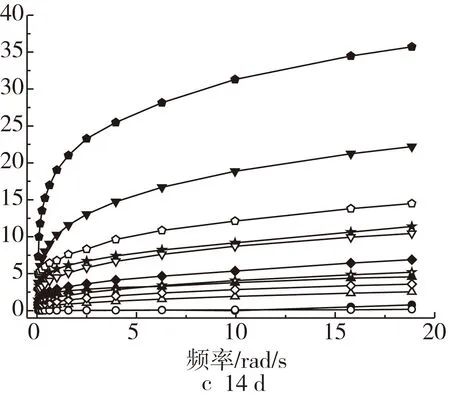
注:圆形、正三角形、菱形、五角星、倒三角形、五边形对应的XG质量分数分别为0%、0.10%、0.15%、0.20%、0.25%、0.30%。实心符号为G′,空心符号为G″,下同。图2 XG浓度对乳状液储能模量和损耗模量的影响
2.3.3 降温过程流变特性分析
由图3可知,在降温过程中,对照组G′和G″接近0,而添加XG的乳状液的G′和G″明显增大,且乳状液的G′明显大于G″,与扫描频率测量结果一致。第1天时,随着温度的降低,添加0.10%~0.20%XG的乳状液的G′逐渐降低,G″基本保持不变;而添加0.25%~0.30%XG的乳状液的G′呈现先降低后升高的趋势,G″缓慢升高,可能是因为在65 ℃以上,初始阶段形成的凝胶网络结构易被破坏,出现“凝胶弱化”现象,当温度降至65 ℃以下时,较高浓度的XG形成相对较强的凝胶网络,表现出较强的黏弹性行为[5]。储藏至7 d时,在降温过程中,添加0.10%~0.15%XG乳状液的G′和G″保持相对稳定;而添加0.20%~0.30%XG的乳状液的G′呈先减小后增大的变化趋势,G″呈缓慢增大的趋势。随着储藏时间的进一步延长,14 d时,添加0.10%~0.15%XG乳状液的G′和G″还是保持相对稳定的变化趋势,但是有所降低,表明凝胶网络强度降低;添加0.20%XG的乳状液的G′呈缓慢降低的趋势,G″呈缓慢上升的趋势;而添加0.25%和0.30%XG的乳状液的G′和G″均呈现缓慢增加的趋势。因此,在降温过程中,添加0.10%和0.15%XG的乳状液在14 d储藏期内表现出相对稳定的黏弹性行为;随着XG浓度的增加,虽然提高了凝胶网络强度,但是在相对较高的温度下,表现出相对降低的黏弹性行为,出现“凝胶弱化”效,可能是因为油滴的可逆絮凝,导致凝胶网络经历重组或局部塌陷[7]。



图3 XG浓度对乳状液降温程序中储能模量的影响
3 结论
本研究通过测定并分析XG浓度对SPI稳定的水包油乳状液在14 d储藏期内流变学特性、粒径和Zeta-电位的变化。结果表明,XG的添加,提高了乳状液的黏度,使乳状液表现出高度假塑性和良好的黏弹性行为,促进了凝胶类乳液的形成。其中,XG浓度为0.10%时,乳状液的Zeta-电位绝对值较高,粒径较小,在14 d储藏期内乳状液的G′和G″表现出较好的频率依赖性和在降温过程中相对稳定的凝胶结构,赋予了乳状液良好的储藏稳定。XG浓度对SPI乳状液流变学特性的具体作用机制及二者之间的关系有待进一步研究。
