新发染色体异常对罗氏易位和相互易位携带者植入前遗传学诊断的影响分析
2019-08-16偶健王玮倪梦霞郑爱燕丁洁蒲艳邹琴燕孟庆霞许咏乐李红
偶健,王玮,倪梦霞,郑爱燕,丁洁,蒲艳,邹琴燕,孟庆霞,许咏乐,李红
(南京医科大学附属苏州医院,苏州市立医院生殖与遗传中心,苏州 215002)
染色体易位是常见的染色体结构异常。人群中相互易位的发生率约为1/1 000~1/500,罗氏易位的发生率约为1/1 000~1/900,而在不育及反复自然流产患者中,易位的发生率达1%~10%[1]。染色体易位携带者在减数分裂过程中,易位的染色体和正常的染色体之间按照不同的分离重组产生高比例的不平衡配子[2-4],罗氏易位携带者异常的胚胎占2/3,而相互易位携带者异常比例高达80%[2],这是导致其反复流产、胚胎停止发育、生育智力低下或畸形胎儿的主要原因。
罗氏易位携带者在形成配子的过程中,除了影响与易位相关的染色体的分离外,还会影响其它非相关的染色体的分离,其形成原因被认为是染色体相互效应(interchromosomal effects,ICE)所导致[3]。进一步的研究发现在相互易位携带者中同样也会发生新发染色体异常[4]。本研究的目的在于分析植入前遗传学诊断(preimplantation genetic diagnosis,PGD)中这种可能源自ICE的新发染色体异常对易位携带者胚胎诊断结果和临床结局的影响。
资料和方法
一、研究对象
选取27对罗氏易位携带者夫妇(共27个周期)(表1)和53对相互易位携带者夫妇(共64个周期)(表2)采用二代测序(next generation sequencing,NGS)行PGD。纳入标准:夫妇一方为染色体相互易位或者罗氏易位的患者。排除标准:同源染色体易位患者;女方BMI>28 kg/m2。所有患者的染色体易位均由外周血染色体常规G显带确认。女方年龄21~43岁,平均年龄29.8岁。所有夫妇均签署了体外受精(IVF)和PGD知情同意书,医院生殖伦理委员会对此研究项目通过伦理审查。所用胚胎均由患者签订知情同意用于科研。

表1 罗氏易位携带者信息
二、研究方法
1.胚胎培养及活检:采用本中心常规方案[5]进行。
2.胚胎活检细胞全基因组扩增(WGA):采用英国BlueGnome公司针对单细胞的SurePlex WGA Kit。包括细胞裂解DNA片段化、扩增前处理和扩增三个步骤。为避免污染,此过程需全部在专用超净台内进行。WGA的DNA质量检测采用Life Qubit 3.0 Fluorometer检测。
3.二代测序(NGS):采用美国Life Tech公司的ION XPRESS LIBRARY试剂盒构建测序文库。取100 ng WGA产物加入buffer和Enzyme MIX Ⅱ 37℃ 35 min进行片段化处理,之后纯化采用美国Beckman公司的Agencourt©AMPure©XP beads,洗脱后加连接头Ion XpressTMBarcode 1,后再纯化,使用E-Gel©SizeSelectTM2% 琼脂糖凝胶电泳后回收200 bp的片段,PCR扩增后再纯化,使用Ion PGMTM Template OT 2 200 Kit试剂盒对文库DNA进行扩增,后开始测序,程序设定中测序Flow数量选择260 Flows,参考基因组选择hg 19,Ion Xpress选择barcode1。
表2 相互易位携带者信息
4.测序数据分析:使用E&S-胚胎染色体异倍性分析系统分析数据。E&S系统以正常样本为标准判定染色体拷贝数,在>4 Mb染色体区域范围内,高于标准1.25倍,则认为该区域重复,低于标准0.75倍,则认为该区域缺失[6]。
三、统计学分析
采用SPSS 19.0统计软件进行卡方检验。P<0.05为差异有统计学意义。
结 果
一、罗氏易位和相互易位携带者PGD结果
本研究共对来自易位携带者91个PGD周期的408个囊胚进行了分析,平均每个囊胚活检了5~6个外滋养层细胞进行全基因组扩增再进行NGS检测。结果显示,34.1%(139/408)的胚胎存在其它染色体的异常,其中既有易位相关又有新发染色体异常囊胚(图1),比例为11.5%(47/408),而完全新发染色体异常的囊胚(图2)比例为22.5%(92/408)。
罗氏易位和相互易位各自的数据显示,罗氏易位携带者相关/新发染色体异常率为2.4%(3/126),而相互易位携带者的相关/新发染色体异常率为15.6%(44/282),两者有显著性差异(P<0.05)。罗氏易位携带者的完全新发染色体异常率为31.7%(40/126),高于相互易位携带者的18.4%(52/282),但两者差异无统计学意义(P>0.05)(表3)。
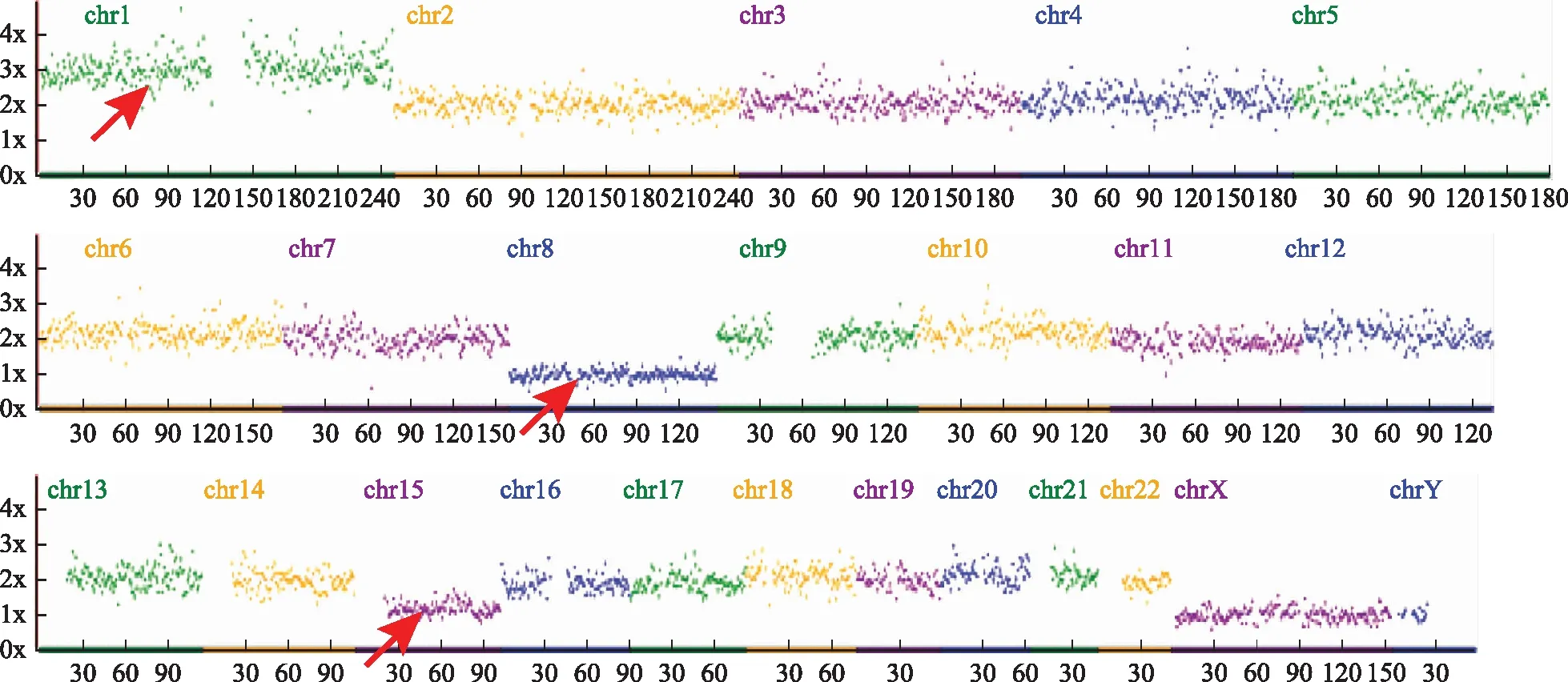
红色箭头分别提示1号染色体三体、8号染色体单体、15号染色体单体图1 相互易位携带者46,XX,t(1;8)(p34.3;q24.3)的既有易位相关又有新发染色体异常囊胚的NGS结果
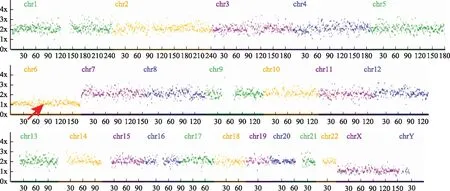
红色箭头提示6号染色体单体图2 相互易位携带者46,XY,t(4;13)(p14;q12)的完全新发染色体异常的囊胚的NGS结果
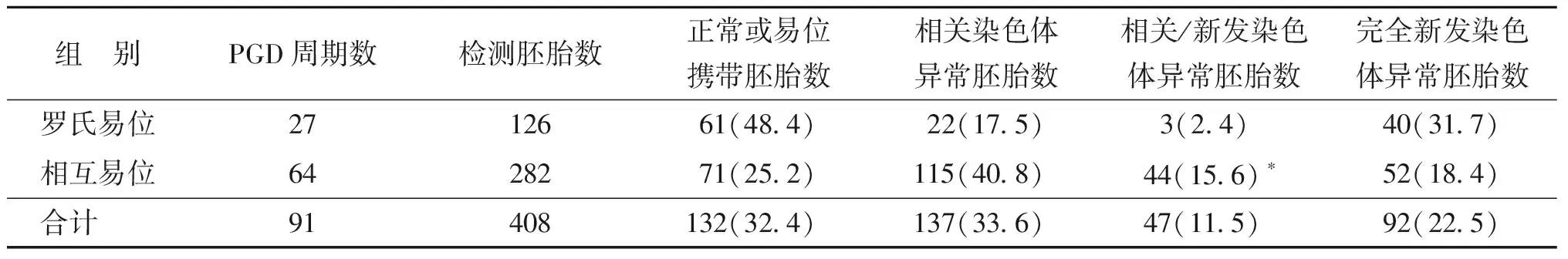
组 别PGD周期数检测胚胎数正常或易位携带胚胎数相关染色体异常胚胎数相关/新发染色体异常胚胎数完全新发染色体异常胚胎数罗氏易位2712661(48.4)22(17.5)3(2.4)40(31.7)相互易位6428271(25.2)115(40.8)44(15.6)∗52(18.4)合计 91408132(32.4)137(33.6)47(11.5)92(22.5)
注:与罗氏易位组比较,*P<0.05
二、易位携带者胚胎新发染色体异常在不同染色体上的表现
罗氏易位携带者胚胎新发染色体异常涉及除13、14、15和21以外的染色体,而相互易位的新发染色体异常涉及除14以外的染色体。罗氏易位携带者新发染色体异常主要集中于16和22号染色体非整倍体和8号染色体的结构异常。相互易位携带者新发染色体异常多见于22、15、21、13、16、18号染色体非整倍体和9、11号染色体结构异常(图3)。
三、新发染色体异常对PGD临床结局的影响
罗氏易位和相互易位携带者分别有70.4%(19/27)和54.7%(35/64)的PGD周期检出完全新发染色体异常的囊胚。临床结局显示分别有7.4%(2/27)的罗氏易位和18.8%(12/64)的相互易位PGD周期由于新发染色体异常导致无正常结果的胚胎可供移植(表4)。

A:罗氏易位和相互易位携带者新发染色体异常在不同染色体上的表现;B:相互易位携带者新发染色体异常之不同染色体数目异常;C:相互易位携带者新发染色体异常之不同染色体结构异常;D:罗氏易位携带者新发染色体异常之不同染色体数目异常;E:罗氏易位携带者新发染色体异常之不同染色体结构异常 图3 易位携带者胚胎新发染色体异常
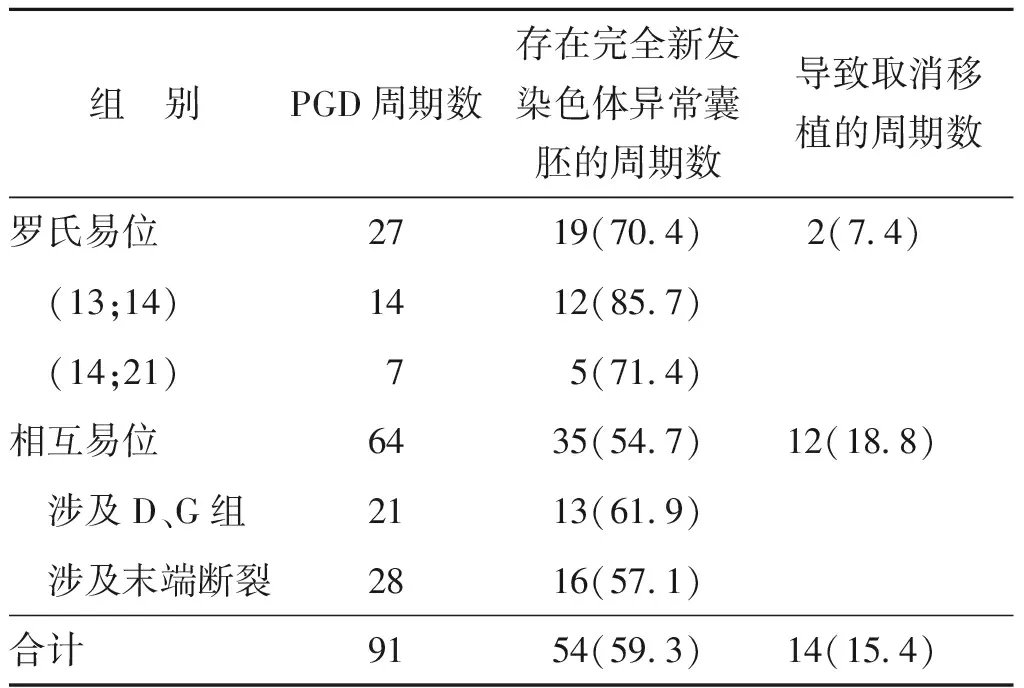
表4 新发染色体异常对PGD临床结局的影响[n(%)]
讨 论
ICE是否存在一直有争议。若干研究显示ICE存在于相互易位携带者[7-8]和罗氏易位携带者[9-10]的精子和卵裂期胚胎中。但另外一些报道则认为ICE是不存在的[11],或者认为即使有其它染色体异常增加也不能说明是ICE导致的[12]。还有报道认为ICE的发生取决于易位的区域以及断裂的位点[13]。我们认为ICE的机理尽管暂时还不明确,但胚胎中新发染色体异常的现象是存在的,可能会一定程度上影响PGD检测结果及临床结局,因此我们对此异常进行了相关的统计。
罗氏易位和相互易位携带者的囊胚分别显示存在34.1%和34.0%的新发染色体异常。其中罗氏易位携带者相关/新发染色体异常率仅为2.4%(3/126),显著低于相互易位携带者的15.6%(44/282);另外罗氏易位携带者的完全新发染色体异常率为31.7%(40/126),数值上高于相互易位携带者的18.4%(52/282),但无显著性差异(P>0.05)。可能由于罗氏易位和相互易位各自易位相关染色体的异常分裂方式不同,相互易位的相关染色体异常率远高于罗氏易位,导致两种不同易位的相关/新发染色体异常率和完全新发染色体异常率存在一定的差别。
本实验室的PGD数据还显示母体高龄相比低龄面临正常胚胎率大幅下降的问题(从31.2%下降至16.7%)。但本研究中的新发染色体异常的发生却不受母体年龄的影响,所有年龄段都保持着相似的水平,与Munné等[11]报道的一致。相互易位携带者PGD中,无新发染色体异常的人群平均年龄为28.73岁(24~43岁),而有新发染色体异常的人群平均年龄为29.57岁(21~40岁),无显著性差异(P>0.05),其中有3例携带者所有胚胎均有新发染色体异常,其年龄分别为25岁、27岁、29岁,均不是母体高龄。由此可见易位携带人群中新发染色体异常可能独立于年龄因素。
遗传不稳定在人类早期胚胎中非常普遍[14],虽然没有明确证据证明ICE是如何干扰分离过程的,但它可能进一步提供了遗传不稳定,容易发生分离错误的环境。一种可能的解释是易位相关的染色体分裂时的重组干扰了其它染色体在纺锤体上的有序排列,进一步影响其它染色体的配对和分离[15]。这种影响是否存在特定染色体的针对性,为此我们统计了罗氏易位和相互易位携带者新发染色体异常在不同染色体上的表现:一方面我们发现绝大多数染色体均存在异常,罗氏易位新发染色体异常涉及除13、14、15和21号以外的染色体,而相互易位新发染色体异常涉及除14号以外的染色体,罗氏易位的13、14、15和21号是由于其作为相关染色体出现概率较高,而相互易位的14号可能存在染色体特异性;另一方面发现罗氏易位携带者新发染色体异常主要集中于16和22号染色体非整倍体和8号染色体的结构异常。相互易位携带者新发染色体异常多见于22、15、21、13、16、18号染色体非整倍体和9、11号染色体结构异常。Wang等[16]对流产组织染色体异常的统计显示不同常染色体异常前六位分别为16、22、21、15、18、13号染色体异常,与相互易位携带者新发染色体异常涉及常染色体基本一致。这些特定的高发的染色体非整倍体其发生概率较高可能与其染色体特异性有关。此外相互易位携带者新发染色体异常中9号染色体的结构异常高发于q21.11(长臂2区1带1亚带1次亚带),为9号臂间倒位的断裂热点区域,此处可能也是容易受到ICE干扰的区域,而8号和11号染色体的结构异常均未发现热点区域。此外,在新发染色体异常中有18例为嵌合结果,无特定染色体针对性,可能代表了一种在不稳定环境下自我修复的过程。
我们对存在完全新发染色体异常囊胚的周期发生率的数据统计显示,最常见的罗氏易位der(13;14)携带者为85.7%(12/14),der(14;21)携带者为71.4%(5/7),而相互易位携带者为54.7%(35/64),其中近端着丝粒染色体易位携带者为61.9%(13/21),染色体末端断裂(易位的片段占染色体臂的比例<0.2)易位携带者为57.1%(16/28)。罗氏易位存在完全新发染色体异常囊胚的周期发生率在数值上要高于相互易位,可能原因是近端着丝粒染色体(D组和G组,罗氏易位相关)的短臂由核糖体RNA串联拷贝组成,在间期定位在核仁,当形成罗氏易位染色体后,短臂消失,导致其间期无法与核仁结合,核仁结构的改变可能会影响其它染色体,因为大多数染色体都有和核仁相互作用的特定序列[17]。
我们进一步分析新发染色体异常对妊娠结局的影响。数据显示罗氏易位和相互易位携带者分别有70.4%(19/27)和54.7%(35/64)的PGD周期检出完全新发染色体异常的囊胚。其临床结局为7.4%(2/27)的罗氏易位PGD周期和18.8%(12/64)的相互易位PGD周期,由于新发染色体异常导致无正常结果的胚胎可供移植。由此可见,罗氏易位和相互易位携带者的囊胚PGD均不同程度的面临新发染色体异常的影响。相比于相互易位,罗氏易位囊胚的完全新发染色体异常的囊胚检出率更高,但由于罗氏易位可用的正常或易位携带胚胎率更高,实际其PGD周期受影响要小于相互易位。
总之,ICE还存在争议,由于实验对象数量有限以及无法设置常规人群对照(即使PGS人群选择的也都是来寻求辅助生殖的患者,可能本身也存在其它导致染色体异常的影响因素),我们的统计结果还无法给这一争议提供明确的答案,但易位携带者胚胎中新发染色体异常还是必须要面对的问题,其可能独立于年龄因素,会一定程度上影响PGD检测结果及临床结局。由于新发染色体异常的存在,针对易位携带者的PGD有必要采用全基因组检测方法(如芯片和二代测序)代替传统的只能检测有限染色体的荧光原位杂交方法。
