近亲婚配后代卵巢早衰姐妹的致病基因研究
2019-08-16贺桑刘佶彭婀娜谭小军何方毛卓许鹏黄向红
贺桑,刘佶,彭婀娜,谭小军,何方,毛卓,许鹏,黄向红
(湖南湘潭市中心医院,湘潭 411000)
卵巢早衰(premature ovarian failure,POF)指女性青春期发育后,于40岁前出现闭经、卵巢体积缩小、体内雌激素水平下降、促性腺激素水平达到绝经后水平的现象。引起该病的病因很多,包括遗传、环境、手术、接触有害物质等[1],在妇产科中属于较为常见的内分泌疾病[2],其中约80%患者病因不明[3-5],称为特发性卵巢早衰。卵巢早衰患者早期可表现为月经不规律或月经稀发,继而发生持续性闭经[6],其发病近年来有年轻化趋势[7]。我们针对一对同时患有卵巢早衰的亲生姐妹的病例资料进行研究分析,旨在探究该家系特发性卵巢早衰的致病原因。
一、资料与方法
1.研究对象:本次调查由湘潭市中心医院生殖与遗传中心于2009~2011年完成。该家系的分子遗传学研究得到湘潭市中心医院伦理委员会的论证认可和全体家系成员的知情同意。患者张丽和张文(均为化名)为非孪生亲生姐妹。其父母为近亲婚配,为姑表亲(张丽、张文的爷爷与外婆为亲兄妹),共生育2女1子,女性后代均诊断卵巢早衰(图1);其子23岁,尚未结婚。
对家系中患者及父母双亲进行病史采集和全身体格检查,并抽取外周静脉血5~10 ml,提取DNA,-20 ℃保存以备后续实验。
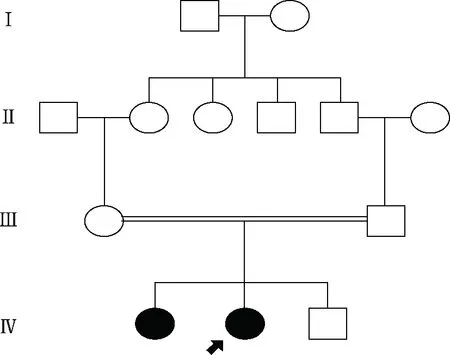
图1 卵巢早衰患者家系图谱
2.全外显子测序分析:全外显子测序由深圳华大基因科技有限公司进行,应用NimbleGen SeqCap EZ Exome(44 M)捕获平台进行外显子捕获测序,获得的DNA片段用Illumina高通量测序技术测序,每个样本的有效平均测序深度达到×50。4份样本测序结果覆盖了几乎所有外显子,测序数据量18 698 Mb,有效评价覆盖深度平均值为61.54,目标区域覆盖大于4×的比例为97.8%。
3.基因分析、Sanger测序验证及致病性分析:后期经过排除内含子突变、非移码突变或缺失以及基因互作分析,并经Sanger测序进一步验证[8];筛选出可能致病位点;根据生物信息软件(SIFT、Polyphen2、Condel)对可能致病位点进行致病性分析。
二、结果
1.卵巢早衰姐妹临床资料:(1)妹妹,31岁,身高167 cm,体重60 kg,因“反复闭经12年”于2009年5月湘潭市中心医院生殖与遗传中心就诊。查性激素:卵泡刺激素 79.2 U/L、黄体生成素 67.3 U/L、雌二醇 44.04 pmol/L;妇科彩超提示:子宫未见异常,双侧卵巢体积小,双侧窦卵泡数(AFC)实性;体查:乳房发育正常,外阴女型,阴毛稀疏,色浅,子宫前位,大小质地活动正常,双侧附件未扪及异常。染色体核型分析:46,XX(图2A)。(2)姐姐,34岁,身高157 cm,体重48 kg,因“婚后11年,月经紊乱10年,闭经8年”于2010年6月湘潭市中心医院生殖与遗传中心就诊。查性激素:卵泡刺激素 102.6 U/L、黄体生成素 121.5 U/L、雌二醇 47.71 pmol/L;妇科彩超提示:子宫未见异常,双侧卵巢体积小,双侧AFC实性;体查:乳房偏小,外阴女型,阴毛稀疏,颜色正常,子宫前位,大小质地活动正常,双侧附件未扪及异常。染色体核型分析:46,XX,16qh+(图2B)。
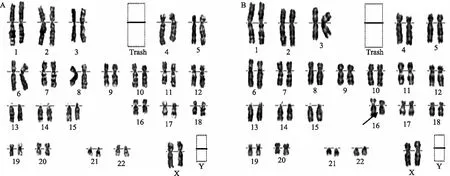
A:妹妹核型;B:姐姐核型(箭头示16qh+)图2 卵巢早衰姐妹染色体核型分析
2.全外显子测序分析:由于家系成员过少,无法预先判断疾病的遗传方式,因此全外显子测序之后,我们采取假设验证的方式分析。由于患者父母并未发病,可排除常染色体显性遗传、X连锁显性遗传和Y染色体遗传的可能。根据孟德尔遗传定律,该家系可能有2种遗传方式:常染色体隐性遗传病和X连锁隐性遗传病。经过生物信息分析,利用在线数据库(千人基因、ESP 数据库)对测序数据进行筛选。在假设X连锁隐性遗传的情况下,没有筛选到符合条件的 SNV 位点,所以最终确定遗传方式为常染色体隐性遗传。经过全外显子测序后,初步筛选得到12个突变基因(16个位点)(表1)。
3.基因分析及sanger测序验证:后期经过排除内含子突变、非移码突变或缺失以及基因互作分析,并经sanger测序进一步验证,最后筛选出2个可能致病位点:分别位于基因 AHDC1和PTPN14上。结合Sanger测序方法对家系内成员进行共分离验证,发现基因 AHDC1 c.C874T和PTPN14 c.G3344A与表型共分离。
4.致病性分析:根据生物信息软件(SIFT、Polyphen2、Condel)对AHDC1和PTPN14基因突变位点进行致病性分析。SIFT软件分析发现ADHC1 c.C874T和PTPN14 c.G3344A的值为0.01和0.02(<0.05说明有害突变)。PolyPhen2和Condel软件分析值越高,表示致病性可能较大,而这两个突变位点分析值都接近1(表2)。
三、讨论
本研究中,两位姐妹因父母为姑表亲近亲结婚,通过外显子测序发现基因AHDC1(AT hook DNA binding containing 1,AT钩DNA结合蛋白1)和PTPN14(tyrosine-protein phosphatase non-receptor type14,蛋白酪氨酸磷酸酶14)可能为两位姐妹发生卵巢早衰的致病基因。由此推测,其父母双亲可能携带其中一个致病基因,由于只携带一个致病基因,所以并没有导致疾病的发生,故父母双亲均无致病的表现。而近亲婚配时,各自携带的单独的致病基因均遗传给子代,使子代致病。
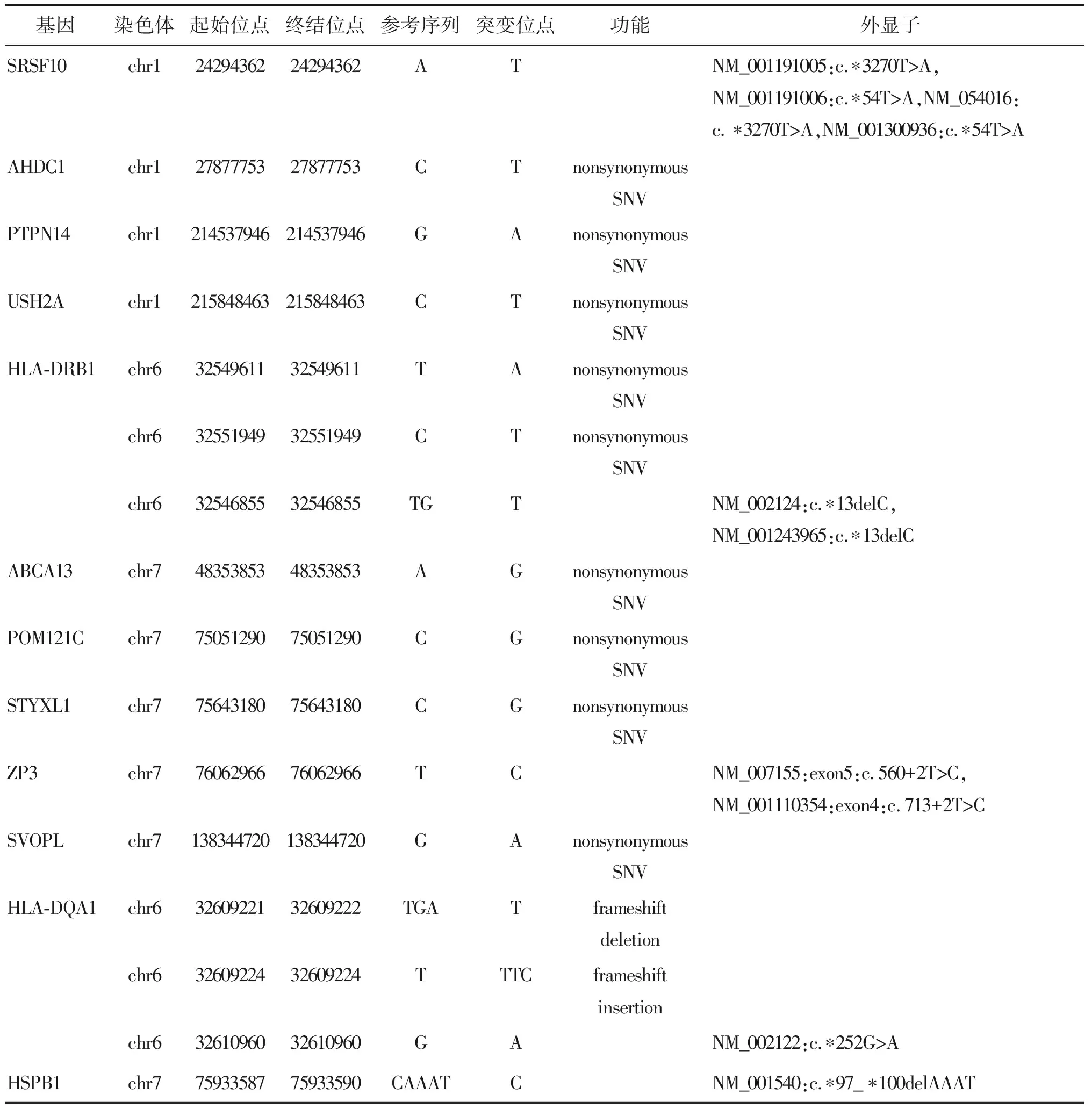
表1 初筛12个突变基因(16个位点)

表2 SIFT、Polyphen2、Condel软件预测致病性结果
既往文献报道,基因AHDC1与食管癌的发生有关,含有AT钩DNA结合结构域的蛋白可以影响染色体的结构并可调控AT富含区基因的转录[9-10]。此外,其他文献报道,AHDC1基因新发剪切突变导致蛋白编码提前终止,致使患者出现精神、运动、语言发育缓慢,肌张力低下,脑发育不良等[11]。PTPN14是蛋白质酪氨酸磷酸酶超家族的成员,与多种细胞过程密切相关,比如细胞生长、分化、肿瘤发生等过程,文献报道与乳腺癌、食管癌、胆管癌的发病有关。这两个基因都是多细胞、多信号通路调控的相关基因,目前虽然尚无研究证实AHDC1和PTPN14与卵巢相关疾病有关,但是由于卵巢早衰本身机制复杂,是否AHDC1和PTPN14在某个信号通路调控过程中发生了改变并最终导致卵巢早衰,还需要进一步的深入研究。同时,也不能排除遗传过程中新发突变导致的疾病。
本研究通过全外显子测序分析该家系成员4名,发现基因AHDC1和PTPN14可能为该家系特发性卵巢早衰的致病基因。目前尚无文献报道基因 AHDC1 和PTPN14是否与卵巢早衰发病相关,并且上述实验仅针对单个家系进行基因测序。我中心将继续通过扩大样本,同时开展动物实验及基因敲除技术来进一步研究卵巢早衰与上述基因的相关性,以期为特发性卵巢早衰提供新的研究靶点。
