利用Time-lapse技术筛选早期胚胎对IVF-ET妊娠结局的影响
2019-08-16丁洁孟庆霞郑爱燕蒲艳廖桂芝许咏乐李红王玮
丁洁,孟庆霞,郑爱燕,蒲艳,廖桂芝,许咏乐,李红,王玮
(南京医科大学附属苏州医院,苏州市立医院生殖与遗传中心,苏州 215002)
胚胎选择技术是体外受精胚胎移植技术的关键步骤。目前,绝大多数中心利用传统胚胎形态学评分方法选择胚胎,即根据特定时间点的胚胎形态对胚胎进行评级、选择。但该技术仅观察特定的胚胎发育时间点,不能获得胚胎发育的全部信息,且需要将胚胎反复取出培养箱,暴露于外界环境中,使得pH值和温度发生改变,进而可能影响胚胎发育潜能。
而近年来兴起的胚胎实时观测技术(time-lapse monitoring,TLM)可以对胚胎进行动态监测,不仅能够保证胚胎观察、评估过程中培养环境的稳定,而且可以获得胚胎连续动态发育图,以及胚胎发育过程中的非正常发育行为,如多核、异常分裂、混乱分裂、逆分裂等,进而为胚胎筛选提供更多参考信息。研究表明,利用TLM观察到的胚胎形态动力学参数和特殊分裂模式可以预测囊胚的形成[1-5]。本中心前期研究也发现利用TLM技术可以预测6细胞以上碎片少的形态学优质D3胚胎的发育潜能[6]。但是,关于利用TLM预测临床妊娠结局,结果不尽相同。一些研究认为细胞分裂时间点和分裂间期可以预测移植后胚胎的临床结局[1,4,7],而另一些研究则认为不能预测[3,8]。因此,本研究欲利用TLM系统对早期发育胚胎进行筛选,分析其对临床结局的影响,探索其在临床应用中的价值。
资料与方法
一、研究对象
回顾性分析本中心2016年7月至2017年12月,第一次新鲜或复苏周期移植,且移植D3胚胎的患者资料。排除标准:受精方式为早补救或补救ICSI;移植胚胎评分为非优质;行植入前遗传学检测(preimplantation genetic testing,PGT)。最后共筛得1 025例患者,根据胚胎筛选方案分为Time-lapse系统组(TLM,n=74)和传统形态学评分组(CMA,n=951)。
二、研究方法
1.取卵受精:患者进行常规促排卵后取卵,待优势卵泡直径达18~20 mm时,注射重组HCG(艾泽,默克雪兰诺,瑞士)250 μg,注射34~36 h后在阴道B超引导下取卵,获得的卵丘卵母细胞复合物洗涤干净后置于G-IVF Plus(Vitrolife,瑞典),4~6 h后行IVF或ICSI。
2.胚胎培养:受精后的2PN胚胎,CMA组放入普通培养箱(COOK,美国),培养箱环境:6.0% CO2,5.0% O2,37 ℃;TLM组放入 Embryoslide培养皿,置于Embryo Scope 时差培养箱(Vitrolife,瑞典),培养箱环境:6.0% CO2,5.0% O2,37 ℃。设置拍摄间隔为10 min,连续拍摄6 d。
3.胚胎选择和移植:CMA组根据传统胚胎评分方法选择优质胚胎,本中心D3优质胚胎的标准为:细胞数6~10个,胚胎碎片≤20%,卵裂球均匀。TLM组根据Embryo Scope D3评分原则[9],选择得分为5或4的胚胎。每组根据移植要求选出1~2枚最优质胚胎,行新鲜周期移植;不适合新鲜移植的患者将选出的优质胚胎冷冻,随后行复苏周期移植。
4.临床结局:移植后14 d测血β-HCG,阳性者于4~6周后B超检查见孕囊者为临床妊娠。
三、统计学分析
采用SPSS 16.0软件进行统计学分析。组间均数比较符合正态分布的采用t检验,不符合正态分布的采用秩和检验;率的比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、患者一般情况比较
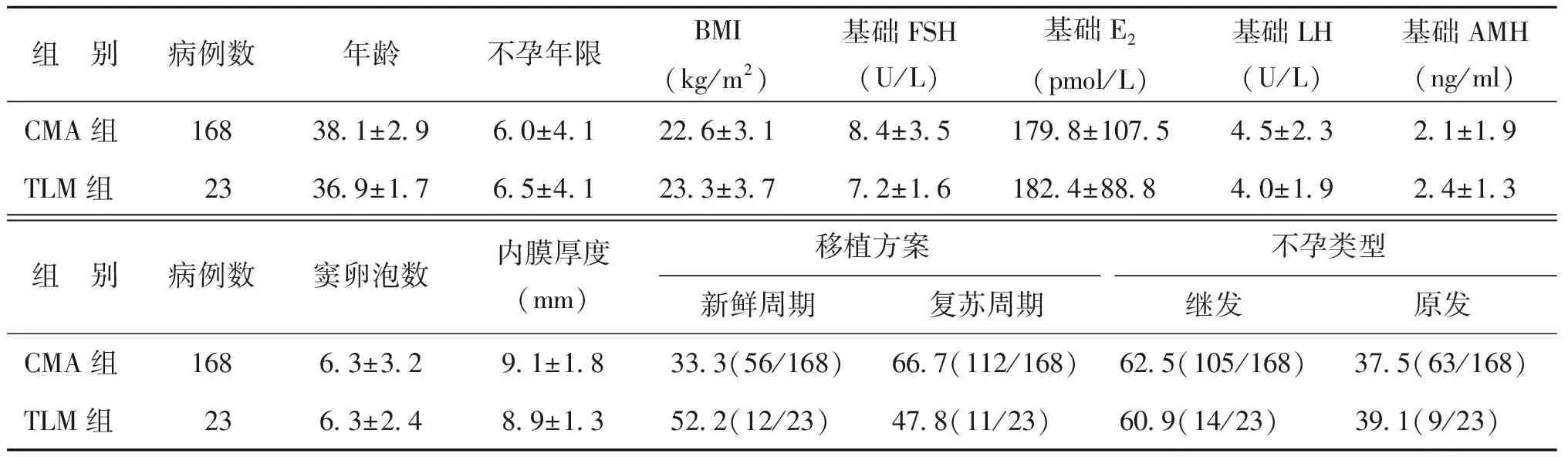
在所有1 025个周期中,患者的不孕年限、体重指数、基础激素(FSH、LH、E2、AMH)水平、窦卵泡数、内膜厚度和周期类型,在两组间均无显著差异(P均>0.05);而TLM组年龄显著大于CMA组(P<0.05)(表1)。
二、胚胎筛选方式对临床结局的影响
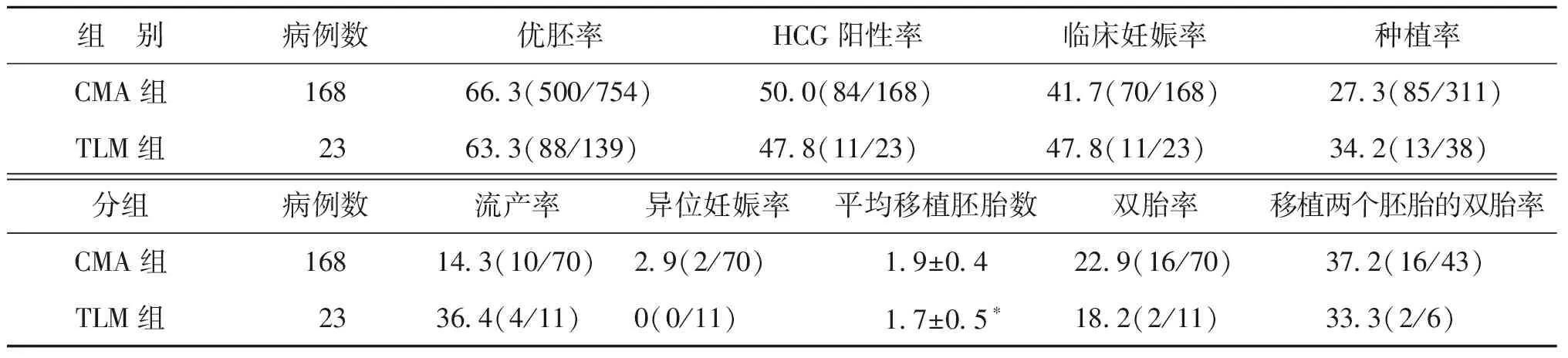
TLM组的平均移植胚胎数显著少于CMA组(P<0.05),但临床妊娠率在两组间无显著差异(P>0.05);TLM组种植率略高于CMA组,但无显著差异(P>0.05);其余各项临床指标在两组间无显著差异(P均>0.05)(表2)。
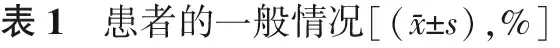
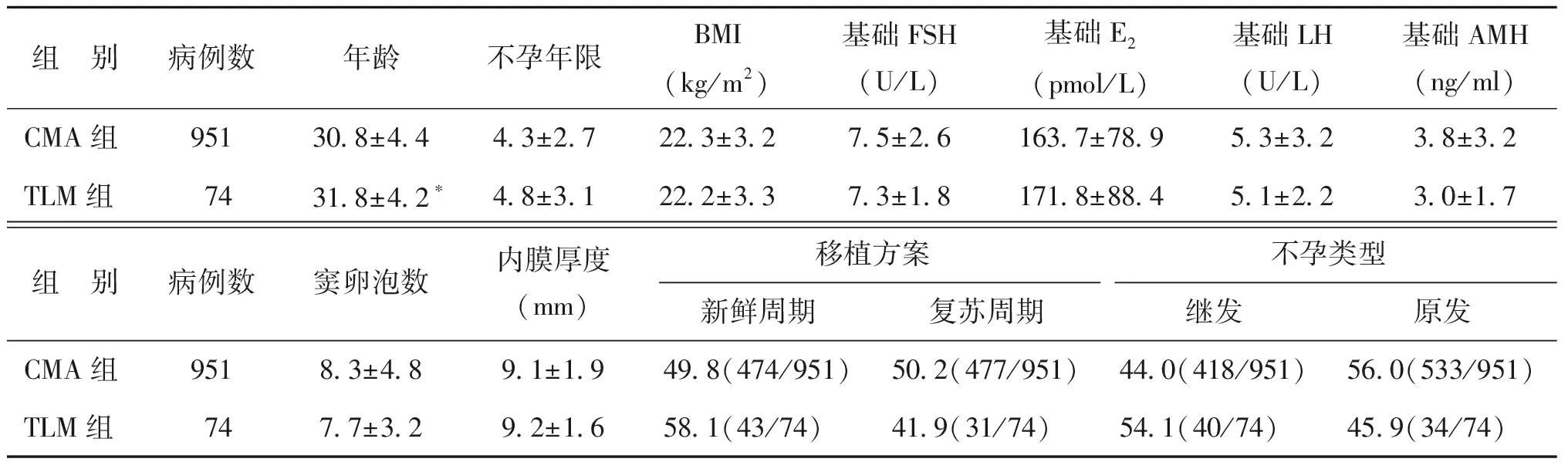
组 别病例数年龄不孕年限BMI(kg/m2)基础FSH(U/L)基础E2(pmol/L)基础LH(U/L)基础AMH(ng/ml)CMA组95130.8±4.44.3±2.722.3±3.27.5±2.6163.7±78.95.3±3.23.8±3.2TLM组7431.8±4.2∗4.8±3.122.2±3.37.3±1.8171.8±88.45.1±2.23.0±1.7组 别病例数窦卵泡数内膜厚度(mm)移植方案不孕类型新鲜周期复苏周期继发原发CMA组9518.3±4.89.1±1.949.8(474/951)50.2(477/951)44.0(418/951)56.0(533/951)TLM组747.7±3.29.2±1.658.1(43/74)41.9(31/74)54.1(40/74)45.9(34/74)
注:与CMA组比较,*P<0.05
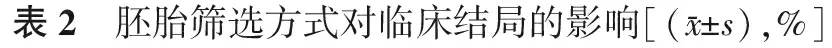
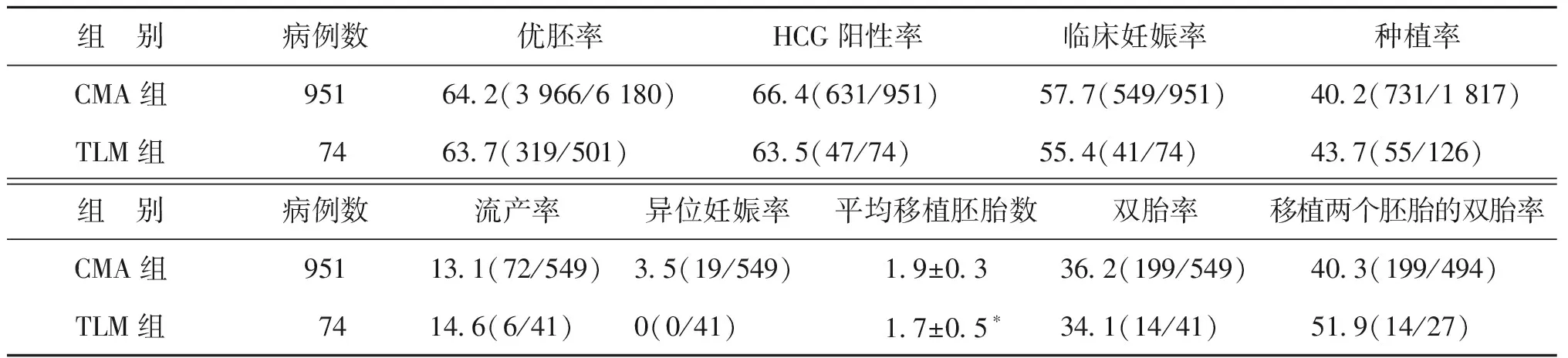
组 别病例数优胚率HCG阳性率临床妊娠率种植率CMA组95164.2(3 966/6 180)66.4(631/951)57.7(549/951)40.2(731/1 817)TLM组7463.7(319/501)63.5(47/74)55.4(41/74)43.7(55/126)组 别病例数流产率异位妊娠率平均移植胚胎数双胎率移植两个胚胎的双胎率CMA组95113.1(72/549)3.5(19/549)1.9±0.336.2(199/549)40.3(199/494)TLM组7414.6(6/41)0(0/41)1.7±0.5∗34.1(14/41)51.9(14/27)
注:与CMA组比较,*P<0.05
三、胚胎筛选方式对不同年龄患者临床结局的影响
1.胚胎筛选方式对<35岁患者临床结局的影响:所有一般情况,包括年龄、不孕年限、体重指数、基础激素(FSH、LH、E2、AMH)水平、窦卵泡数、内膜厚度和周期类型,在两组间均无显著差异(P均>0.05)(表3);TLM组的平均移植胚胎数显著少于CMA组(P<0.05),但临床妊娠率在两组间无显著差异(P>0.05);TLM组种植率略高于CMA组,但无显著差异(P>0.05);其余各项临床指标在两组均无显著差异(P均>0.05)(表4)。
2.胚胎筛选方式对≥35岁患者临床结局的影响:所有一般情况,包括年龄、不孕年限、体重指数、基础FSH、基础LH、E2、AMH、窦卵泡数、内膜厚度和周期类型,在两组间均无显著差异(P均>0.05)(表5);TLM组的平均移植胚胎数显著少于CMA组(P<0.05),但临床妊娠在两组间无显著差异(P>0.05);TLM组种植率略高于CMA组,但无显著差异(P>0.05);其余各项临床指标在两组间无显著差异(P均>0.05)(表6)。
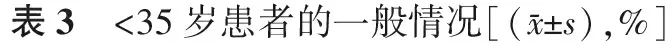
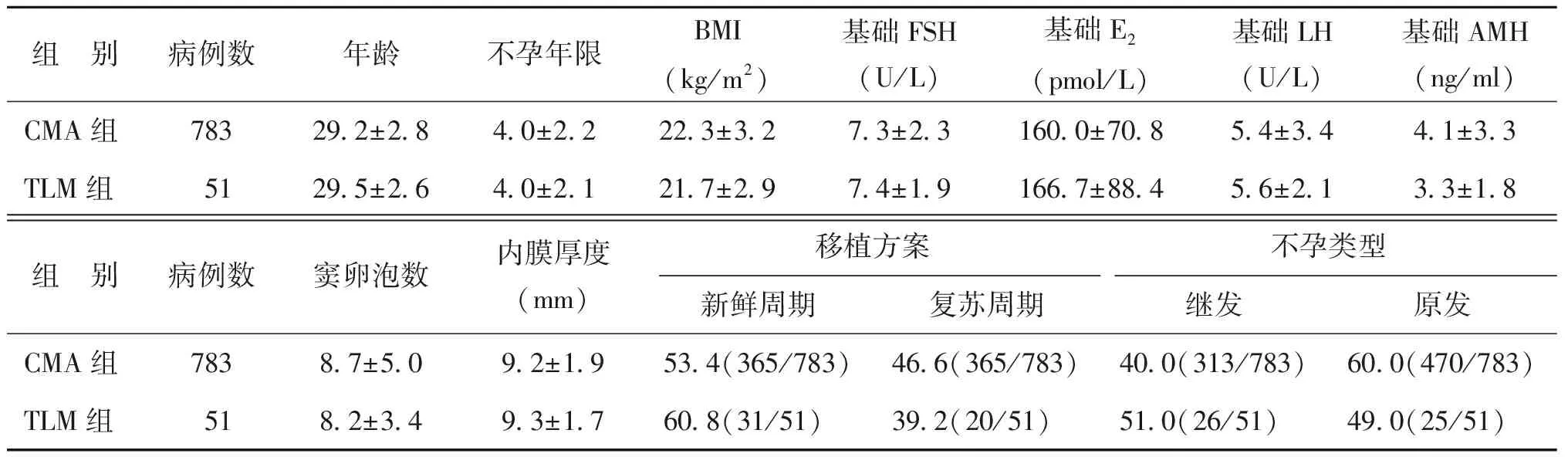
组 别病例数年龄不孕年限BMI(kg/m2)基础FSH(U/L)基础E2(pmol/L)基础LH(U/L)基础AMH(ng/ml)CMA组78329.2±2.84.0±2.222.3±3.27.3±2.3160.0±70.85.4±3.44.1±3.3TLM组5129.5±2.64.0±2.121.7±2.97.4±1.9166.7±88.45.6±2.13.3±1.8组 别病例数窦卵泡数内膜厚度(mm)移植方案不孕类型新鲜周期复苏周期继发原发CMA组7838.7±5.09.2±1.953.4(365/783)46.6(365/783)40.0(313/783)60.0(470/783)TLM组518.2±3.49.3±1.760.8(31/51)39.2(20/51)51.0(26/51)49.0(25/51)

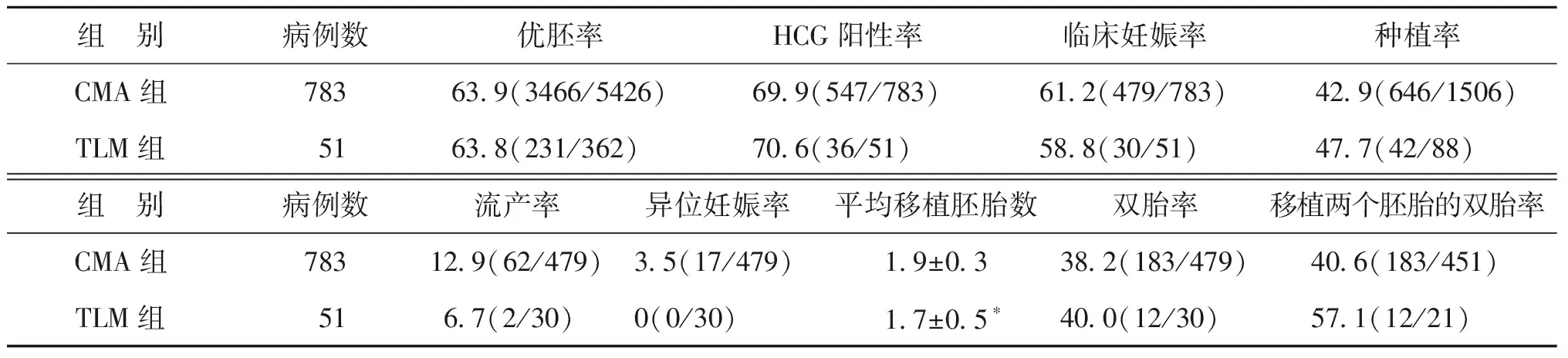
组 别病例数优胚率HCG阳性率临床妊娠率种植率CMA组78363.9(3466/5426)69.9(547/783)61.2(479/783)42.9(646/1506)TLM组5163.8(231/362)70.6(36/51)58.8(30/51)47.7(42/88)组 别病例数流产率异位妊娠率平均移植胚胎数双胎率移植两个胚胎的双胎率CMA组78312.9(62/479)3.5(17/479)1.9±0.338.2(183/479)40.6(183/451)TLM组516.7(2/30)0(0/30)1.7±0.5∗40.0(12/30)57.1(12/21)
注:与CMA组比较,*P<0.05
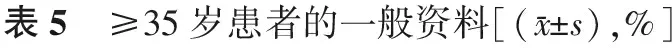
组 别病例数年龄不孕年限BMI(kg/m2)基础FSH(U/L)基础E2(pmol/L)基础LH(U/L)基础AMH(ng/ml)CMA组16838.1±2.96.0±4.122.6±3.18.4±3.5179.8±107.54.5±2.32.1±1.9TLM组2336.9±1.76.5±4.123.3±3.77.2±1.6182.4±88.84.0±1.92.4±1.3组 别病例数窦卵泡数内膜厚度(mm)移植方案不孕类型新鲜周期复苏周期继发原发CMA组1686.3±3.29.1±1.833.3(56/168)66.7(112/168)62.5(105/168)37.5(63/168)TLM组236.3±2.48.9±1.352.2(12/23)47.8(11/23)60.9(14/23)39.1(9/23)

组 别病例数优胚率HCG阳性率临床妊娠率种植率CMA组16866.3(500/754)50.0(84/168)41.7(70/168)27.3(85/311)TLM组2363.3(88/139)47.8(11/23)47.8(11/23)34.2(13/38)分组病例数流产率异位妊娠率平均移植胚胎数双胎率移植两个胚胎的双胎率CMA组16814.3(10/70)2.9(2/70)1.9±0.422.9(16/70)37.2(16/43)TLM组2336.4(4/11)0(0/11)1.7±0.5∗18.2(2/11)33.3(2/6)
注:与CMA组比较,*P<0.05
讨 论
近年,TLM已被部分生殖中心引入并应用于临床,该技术被认为是一项能够监测胚胎发育的安全的胚胎培养体系[10-12]。大部分研究认为TLM记录胚胎形态动力学指标能够预测胚胎发育潜能和囊胚形成效率,但是关于TLM选择胚胎能否改善临床结局,说法不一[13-15]。
本研究中,TLM组的年龄显著高于CMA组,且TLM组的平均移植胚胎数显著少于CMA组,但两者的临床妊娠率之间无显著差异(P>0.05)。表明利用TLM选择胚胎,可以在显著减少移植胚胎数的基础上,维持稳定的临床妊娠率,提示TLM技术可以为早期胚胎单胚胎移植技术的开展提供一定手段。虽然TLM组种植率比CMA组高,但两者无显著差异(P>0.05),该结果与Wu等[16]研究结果一致。另外,就移植两个胚胎的双胎率,TLM组和CMA组分别为51.9%和40.3%,虽然两者无显著差异(P>0.05),但是TLM组移植两个胚胎的双胎率有增高的趋势。这与Insua等[14]的研究结果一致,他们发现TLM组的多胎分娩率高于CMA组。母体子宫环境和胚胎质量是影响胚胎种植的两大因素。基于本研究结果,有理由认为在子宫容受条件好的患者中,TLM选择的胚胎种植效率更高,TLM可能对胚胎的选择起了正效应。但是,需要进一步扩大和平衡样本数来证实此推论。
另外,考虑到不同年龄段患者胚胎生长发育的规律和模式不尽相同。本文进一步将患者按年龄分层,分为<35岁组和≥35岁组。结果,无论是在<35岁患者还是≥35岁患者,女方年龄、临床妊娠率和种植率在两组间均无显著差异(P>0.05),而平均移植胚胎数TLM组均显著少于CMA组(P<0.05)。就移植两个胚胎的双胎率,尽管两个年龄段患者间均无显著差异(P>0.05),但<35岁患者TLM组有上升趋势,≥35岁患者TLM组有下降趋势。但是≥35岁患者仅6例移植2个胚胎,因此该结果有待扩大样本进一步研究。
本研究中,<35岁患者利用TLM选择D3胚胎移植后,其种植率为47.7%,移植两个胚胎后双胎率为57.1%。但是鉴于双胎对母婴健康安全会产生不利影响,导致妊娠高血压和早产等产科和新生儿科问题。因此,在<35岁患者,利用TLM选择胚胎进行早期胚胎单胚胎移植具有一定可行性。但是对于≥35岁患者,TLM组种植率为34.2%,因此利用TLM筛选胚胎行早期胚胎单胚胎移植还需进一步研究。本研究中两个年龄段患者,TLM组和CMA组临床妊娠率和种植率均无显著差异。但是,在降低移植胚胎数的基础上,TLM能维持稳定的临床妊娠率,且TLM组种植率和移植两个胚胎后的双胎率与CMA组比较无显著差异,但均有上升趋势。由于本研究中TLM组和CMA组的样本量差异较大,因此若将两组样本数平衡,也许统计学差异会显现。
综上所述,利用Time-lapse技术选择早期胚胎,可以在显著减少移植胚胎数的基础上,维持稳定的临床妊娠结局。因此,认为Time-lapse技术可以在一定程度上优选出更具发育潜能的胚胎,为早期胚胎单胚胎移植提供新方法。
