髓源性抑制细胞在母胎耐受中的作用
2019-08-16王一鸥郭燕红
王一鸥,郭燕红
(河北医科大学附属第三医院生殖医学科,石家庄 050051)
胎儿一半的基因来源于父亲,故母胎基因的错配会引起母体对胎儿的排斥反应。因此成功妊娠的建立和维持需要母体对胎儿组织有足够的免疫耐受,否则将会导致流产、子痫前期等一系列的并发症[1]。研究证实,母胎界面存在着广泛的母体免疫细胞与胎儿抗原直接接触,故胎儿无法通过传统认为的母胎间物理屏障达到免疫豁免[2]。现代免疫学理论认为,母胎界面中的免疫细胞如蜕膜NK细胞、巨噬细胞、树突状细胞和调节性T细胞(regulatory T cell,Treg)在维持母胎耐受中起着重要的作用[3-4]。近年来很多研究发现髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)在维持母胎耐受中起着重要的作用,故深入研究MDSCs在母胎耐受中的作用,将对母胎耐受机制的理解以及复发性流产等妊娠免疫相关疾病的治疗具有重要意义。
一、MDSCs的基本特征
1.MDSCs来源:MDSCs是在肿瘤、感染、移植、自身免疫性疾病以及肥胖等病理状态下产生的一群异质性的细胞[5]。MDSCs与中性粒细胞和单核细胞等髓系来源的细胞有着共同的分化通路,但却表现出与典型活化的中性粒细胞和单核细胞不同的不成熟细胞的特征[6]。MDSCs首先发现于肿瘤患者中,具有显著的免疫抑制能力,可促进肿瘤的进展和转移。近年来的研究还显示MDSCs在感染性疾病、自身免疫性疾病及移植中起着重要的免疫调节作用[7-9]。
2.MDSCs的表型:MDSCs是一群具有异质性的细胞,故其表面标志有所差异(表1),目前MDSCs仍缺乏特异性的表面标志。小鼠的MDSCs表型通常被定义为CD11b+Gr1+,同时根据其与Gr-1分子中不同表位(Ly6G、Ly6C)的抗体结合特异性不同,又可分为两个亚群,分别为:CD11b+LY6G-LY6Chigh单核细胞样MDSCs(monocytic myeloid-derived suppressor cells,M-MDSCs)和CD11b+LY6G+LY6Clow粒细胞样MDSCs(polymorphonuclear myeloid-derived suppressor cells,PMN-MDSCs)或称granulocytic myeloid-derived suppressor cells(G-MDSCs)。
在人类,MDSCs也同样存在相应的两个亚群。M-MDSCs的表型为CD11b+CD14+CD15-CD33+HLA-DRlow/-。PMN-MDSCs同中性粒细胞有相似的表型:CD11b+CD14-CD15+CD33+,区别在前者在梯度离心中显示为低密度,后者为高密度。近期研究发现,植物凝集素样氧化型低密度脂蛋白受体-1(LOX-1)是PMN-MDSCs表面的特异性标志[10]。
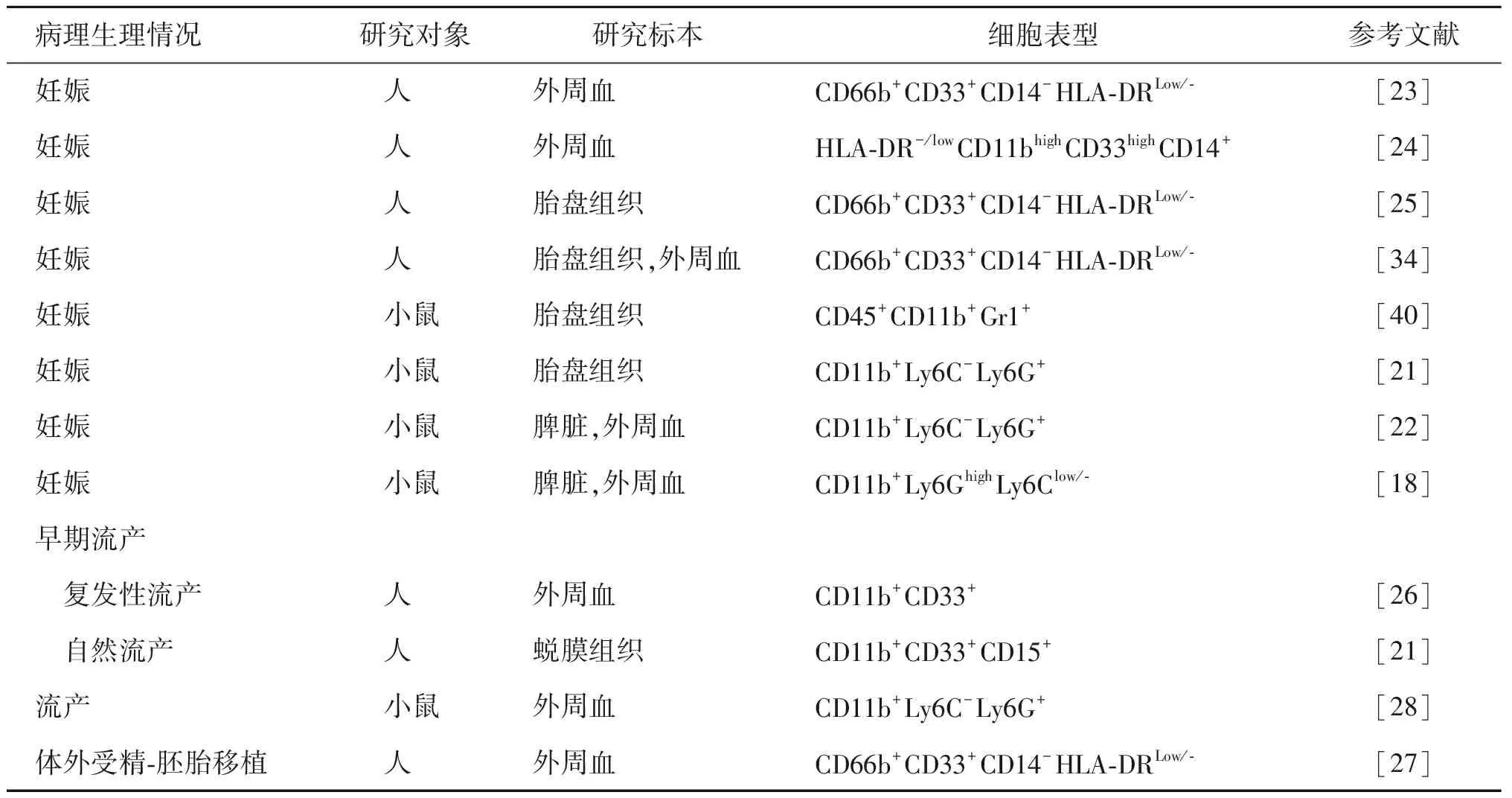
表1 在不同病理生理情况下MDSCs的表型
3.MDSCs诱导和活化:健康人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中MDSCs占不到1%,但在肿瘤和免疫衰老人群,MDSCs显著增多,甚至可高达10 倍[11]。
MDSCs的产生依赖两类相互关联的信号分子。一类是肿瘤和骨髓基质炎症应答时产生的,刺激不成熟髓系细胞的增殖,促进MDSCs聚集。包括粒细胞-巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)、血管内皮生长因子(VEGF)以及不饱和脂肪酸等。转录调节因子STAT3、STAT5、IRF8、C/EBP-β和NOTCH等在信号传递中起着重要的作用。另一类是由炎症细胞因子和损伤相关分子模式组成,参与不成熟髓系细胞的病理性活化,即活化为MDSCs,而消弱其向成熟髓系细胞的转化。这类信号分子包括γ干扰素(IFN-γ)、IL-1β、IL-4、IL-6、IL-13,肿瘤坏死因子(TNF)、高迁移率族蛋白B1(high mobility group box 1,HMGB1)等;主要通过NF-κB、STAT1和STAT6等途径进行信号传导[12]。
4.MDSCs免疫抑制机制:大多数研究认为,MDSCs主要通过细胞表面的受体或产生短暂存在的可溶性分子,依赖细胞间直接接触的方式发挥其免疫抑制功能。Weiss等[13]对荷瘤小鼠的研究显示,MDSCs亦可通过非特异性的体液免疫途径产生相同的免疫抑制能力。MDSCs可能通过以下机制来抑制T细胞的增殖和活化:
● MDSCs分泌精氨酸酶(Arg-1)和高诱导型一氧化氮合酶(iNOS):Arg-1和iNOS均可催化L-精氨酸分解。局部精氨酸的短缺将下调CD3ξ链的表达,从而抑制T细胞的增殖和活化,同时下调周期蛋白D3和周期蛋白依赖激酶4的表达,使T细胞阻滞于G0~G1期。而精氨酸分解产生的一氧化氮(NO)和活性氧簇(ROS)可以通过多种机制抑制T细胞[14]。
● MDSCs产生ROS:MDSCs可通过产生ROS诱导氧化应激。ROS可直接诱导活化T细胞的凋亡,亦可以造成T细胞受体(T cell receptor,TCR)的损伤,从而抑制T细胞的增殖活化[15]。
● MDSCs产生吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO):IDO是色氨酸代谢过程中一种重要的胞内酶,IDO通过降解局部组织微环境中的色氨酸,造成T细胞增殖所必须的色氨酸缺乏,可抑制效应性T细胞增殖[16]。
● MDSCs下调T细胞表面的L-选择素:L-选择素常表达于初始T细胞表面,作为一种重要的归巢受体介导T细胞与血管内皮的黏附,使其穿过高内皮微静脉,进入外周淋巴器官活化[17]。妊娠小鼠体内的MDSCs可以通过下调T细胞表面L-选择素的的水平,阻止初始T细胞进入淋巴结中活化,从而减少迁移到子宫活化的效应T细胞的数量[18]。有研究显示在肿瘤中MDSCs可以通过同样的机制抑制T细胞应答[19]。
● MDSCs诱导T细胞向诱导性调节性T细胞(inducible Treg,iTreg)分化:母胎界面的iTreg在维持母胎耐受,建立成功的妊娠中有重要的作用[20]。妊娠小鼠蜕膜组织中的G-MDSCs通过提高膜结合的TGF-β水平,以细胞间直接接触的方式促进T细胞β-链蛋白的核定位,进而增强下游Foxp3基因的表达,促进CD4+CD25-T细胞向iTreg的转化[21]。
二、MDSCs在维持母胎耐受中的作用
胚胎种植的过程被认为是一种半同种异体移植,需要母体免疫系统对胎儿组织的免疫耐受。若母胎免疫耐受异常,将导致不良妊娠的发生。近期许多研究显示MDSCs参与母胎免疫耐受的实现。
1.MDSCs与正常妊娠和分娩:Pan等[22]研究发现,小鼠妊娠前子宫中仅有很少的MDSCs浸润,妊娠后G-MDSCs在PBMC中的比例显著升高。同时在母胎界面也有显著的G-MDSCs浸润,但M-MDSCs无明显变化。同样,在妊娠超过37周的孕妇PBMC中,G-MDSCs比例是未孕妇女的4倍,M-MDSCs则无明显差异[23]。但也有研究发现妊娠妇女PBMC中G-MDSCs的比例与非妊娠者没有明显差别,而M-MDSCs比例显著高于未怀孕和产后的妇女,原因可能是研究选取人群的遗传背景和细胞因子的种类不同[24]。
另外有学者发现,小鼠子宫中MDSCs的数量在胚胎种植阶段达到高峰。若在胚胎种植前和种植阶段应用Gr1抗体清除MDSCs会导致妊娠的失败和子宫中浸润的T淋巴细胞增加,而在胚胎种植后应用则无相应的效应,提示MDSCs诱导母胎耐受在胚胎种植中起重要的作用[18,21]。其机制主要包括:孕妇外周血G-MDSCs产生高水平的Arg-1和iNOS,抑制T细胞的增殖;但胎盘中的G-MDSCs抑制CD4+和CD8+T细胞增殖的作用主要依赖于Arg-1,而不依赖于iNOS[25]。
G-MDSCs和M-MDSCs在母胎界面的浸润,不同妊娠时期表达不同。妊娠早期比例最高,妊娠晚期比例会显著降低[24-26],但分娩期又有轻度的增加,分娩后7日下降到孕前水平[21]。提示MDSCs在妊娠早中期对维持母胎耐受至关重要。研究发现胎盘中G-MDSCs在单个核细胞中的比例显著高于外周血和脐带血,并主要集中在蜕膜基质和绒毛间隙,而在胎儿面的胎盘绒毛中含量很少。DNA和表型分析均显示,G-MDSCs来源于母体。而胎盘来源的G-MDSCs抑制T细胞增殖能力显著高于外周血来源的G-MDSCs,两者Arg-1和iNOS的表达水平无差别,差别仅在于胎盘来源的MDSCs可以产生更多的ROS[25]。
在一项接受IVF-ET治疗患者的前瞻性研究中,患者取卵日PMBC中G-MDSCs比例,临床妊娠组比未妊娠组显著升高,而M-MDSCs无明显的差异。且外周血高G-MDSCs(在PBMC占比>2.38%)对预测患者IVF治疗结局的特异性高达95.2%[27]。提示,尽管G-MDSCs和M-MDSCs都参与母胎免疫耐受的形成,但G-MDSCs可能是鉴别诊断病理妊娠更敏感的指标,通过检测外周血PMBC中G-MDSCs比例,不但可以作为预测IVF结局的指标,而且还可能通过改善这一比例,提高临床妊娠率。
2.MDSCs与流产:对CBA×DBA/2小鼠自然流产模型和自然流产孕妇蜕膜组织中的G-MDSCs研究发现,其表达显著低于正常妊娠小鼠和择期终止妊娠的孕妇,而M-MDSCs无明显差异[21]。经超声确认早期自然流产的患者,诊断性刮宫前PBMC中MDSCs比例较孕早期正常妊娠的妇女低31.14%,同时蜕膜组织中MDSCs数量也明显减少。在复发性流产患者的黄体中期,PBMC中MDSCs的比例较正常妊娠的妇女明显降低。体外实验发现,早期流产患者和正常妊娠妇女外周血中分离出的MDSCs均可抑制T细胞增殖和IL-2产生,且两者的抑制作用相同。推测妊娠结局的不同主要是由于MDSCs数量的差异[26]。另有研究发现,胚胎植入前,过继转移妊娠小鼠体内的G-MDSCs可以显著改善流产小鼠模型的妊娠结局,减少胚胎吸收率[22,28]。进一步提示MDSCs在母胎免疫耐受中起重要作用。
3.MDSCs与子痫前期:妊娠晚期,健康妊娠和诊断为子痫前期的孕妇相比于同龄未怀孕妇女,PBMC和脐带血中MDSCs的比例均明显升高,但子痫前期的孕妇MDSCs比例显著低于健康孕妇。两者的差异主要表现为G-MDSCs,而M-MDSCs无明显差别。并且G-MDSCs的重要效应分子Arg-1的血清水平,子痫前期患者显著低于正常妊娠妇女。同时正常妊娠的妇女,T细胞中原始T细胞的比例会较孕前增高,而效应T细胞和记忆T细胞的比例降低,但在子痫前期的患者中,该变化不明显[29]。缺乏G-MDSCs的增殖成为子痫前期患者免疫细胞亚群改变的显著特征。对高血压小鼠模型的研究显示,MDSCs通过降低血管周围炎症和血管压力降低血压[30]。因此,将来可能通过改善患者体内G-MDSCs的数量、比例,来治疗子痫前期。
4.MDSCs在母胎界面的增殖活化机制:雌孕激素是胚胎种植以及妊娠维持的必需物质。妊娠过程中,雌孕激素水平会明显的升高。高水平的雌二醇通过与M-MDSCs表面高表达的雌激素受体结合可以诱导STAT3磷酸化,促进M-MDSCs的增殖和活化,同时诱导NADPH氧化酶产生ROS,抑制T细胞的增殖和应答[24]。高水平的孕酮也可通过与G-MDSCs表面高表达的孕酮受体结合,活化产生ROS抑制T细胞的增殖和应答,激活STAT3信号通路,促进G-MDSCs的增殖和活化[22],促进母-胎界面免疫耐受的形成。
有研究显示,月经周期中雌、孕激素水平的变化不会影响MDSCs 的增殖与活化,只在妊娠过程中MDSCs才出现明显的变化[26]。在肿瘤、自身免疫疾病中,雌孕激素同样会诱导MDSCs的增殖和活化[31,32]。故推测雌孕激素对MDSCs的诱导作用可能与某些特殊的病理生理情况下局部免疫微环境改变有关。
研究显示,人类白细胞抗原G(HLA-G)能够诱导MDSCs在母胎界面的聚集活化。HLA-G主要分布在母胎界面绒毛外滋养层细胞,且妊娠时血清中游离的HLA-G(sHLA-G)明显增高[33]。孕妇外周血和胎盘组织中的G-MDSCs细胞表面几乎均有HLA-G的受体免疫球蛋白样转录物4(immunoglobulin-like transcript,ILT4)的表达,且ILT4在胎盘组织中的G-MDSCs表达水平更高。ILT4的表达在妊娠各期没有差别,但分娩后显著下降。HLA-G可以通过ILT4依赖的方式诱导PBMC向表面低表达CD33的MDSCs转化,并且上调IDO的表达发挥免疫抑制功能[34]。sHLA-G亦可通过其他方式来调节MDSCs的聚集分化,增强CD4+和CD8+T细胞的抑制功能,参与母胎耐受的形成,具体机制仍需进一步研究。
G-CSF具有募集MDSCs并使其维持未成熟状态的作用,同时可以活化其增殖和抗凋亡的能力[35]。有研究发现,小鼠静脉注射G-CSF可诱导体内产生MDSCs,改善妊娠结局[18]。临床研究也显示,不明原因复发性流产患者静脉注射G-CSF治疗后,无论是自然受孕还是通过辅助生殖技术助孕,其活产率均有明显提高[36],且大剂量治疗组效果更显著[37]。也有研究显示,在需要IVF-ET治疗的患者中,宫腔灌注G-CSF后,虽然子宫内膜厚度会快速而显著的增加[38],但胚胎种植率和临床妊娠率均无明显提高。也可能是由于该研究纳入的人群年龄偏大导致[39]。故G-CSF治疗在维持母胎耐受,改善妊娠结局中的效果仍存在争议,同时作用机制仍不明确。因此,需要进一步的临床研究以证实其作用。
胎盘中的G-MDSCs表面趋化因子受体CXCR1和CXCR2的表达量明显高于外周血,且抑制T细胞的能力更强[25]。研究显示,CXCR2+MDSCs占MDSCs的比例在流产小鼠子宫、胎盘组织中明显降低,并且血清和蜕膜组织中CXCR2的配体CXCL1也减少。CXCL1与CXCR2结合,介导G-MDSCs向蜕膜组织趋化,并产生Arg-1,抑制母-胎免疫排斥反应[28]。
另外,除了母胎免疫耐受,MDSCs还通过影响母体子宫螺旋动脉的重塑、促进胎盘和新生血管的形成促进成功妊娠的维持[40-41]。肿瘤的发生和妊娠的建立存在很大的相似性。肿瘤的在体和体外研究显示,MDSCs通过激活STAT3,诱导新生血管的生成,促进上皮间叶细胞的迁移和肿瘤细胞的迁徙浸润[42]。由此推测MDSCs在母胎免疫中,除了免疫抑制作用,还可能通过促进新生血管生成、血管重塑、滋养细胞的浸润来维持正常妊娠。
三、展望
多项研究证实,MDSCs大量增殖活化,向母胎界面迁移、聚集,对维持母胎耐受至关重要。相反,MDSCs数量的减少则预示着不良的妊娠结局,故诱导体内MDSCs的产生将可能成为改善不良妊娠结局,实现成功妊娠的可能治疗措施。随着对MDSCs的不断研究,将有助于我们更深入了解妊娠生理和病理,找到有效免疫治疗的靶点,未来可能通过调节MDSCs来治疗免疫相关的异常妊娠及并发症。
由于MDSCs的异质性,其在人体中治疗作用的研究仍很少,因此作为治疗靶点的MDSCs的特征及免疫抑制功能有待于进一步的阐明。
