非小细胞肺癌患者病理组织中MTH1的表达及临床意义研究*
2019-08-15杜凤华闵旭红孔维博孔祥舟梅晓冬
杜凤华,闵旭红,孔维博,孔祥舟,梅晓冬
(1.安徽医科大学附属省立医院呼吸内科,合肥 233001;2.安徽省胸科医院放射介入科,合肥 233003)
肺癌是全球癌症相关死亡的主要原因,发病率高且严重危及人类的健康[1]。随着现代分子肿瘤学的进步,各种分子靶向治疗取得了较大进步,但肺癌的预后仍然很差[2],亟须寻找新的肺癌预后分子标志物和治疗靶点。有学者认为癌症的发生是细胞在各种内外环境刺激下导致原癌基因和抑癌基因平衡失调、细胞增殖失控的过程[3]。氧化应激、缺氧和表观遗传障碍在癌症的发生、发展中起到重要的作用。呼吸、正常代谢和炎性反应过程均产生活性氧(ROS)[4],ROS可氧化核苷酸和蛋白质,诱导基因突变和导致细胞衰老[5]。ROS可氧化核苷酸库中的dGTP或直接氧化DNA中的鸟嘌呤碱基而产生8-氧代-鸟嘌呤(8-氧-G)。在DNA复制过程中,DNA聚合酶通常在模板DNA中插入8-氧代-dGTP,从而导致A到C或G到T的颠换突变[6]。
MutT同系物1(MutT homolog 1,MTH1)是一种氧化型嘌呤核苷三磷酸酶,将8-氧代-dGTP水解成其单磷酸形式,从而阻止DNA聚合酶将8-氧代-dGTP插入基因组[8],对细胞基因组的稳态起到保护作用。暴露于烟草烟雾或电离辐射,会增加正常细胞中的ROS水平[7],这可能导致核苷酸库中的8-氧-G积累。DNA中8-氧-G的过度积累可诱导细胞凋亡,因此癌细胞可能获得防止DNA中8-氧-G积累机制。事实上,MTH1在脑癌、乳腺癌和胃癌中表现丰富[8-9]。动物实验提示:MTH1是癌细胞增殖必需的酶,靶向MTH1可抑制由肿瘤细胞系发展而来的肿瘤的增殖[10-11]。这些发现提示MTH1在癌症发展中起重要作用。尽管如此,MTH1在非小细胞肺癌(NSCLC)中的表达情况和临床意义尚不清楚。本研究通过免疫组织化学方法检测197例NSCLC患者中MTH1蛋白的表达,探讨MTH1表达与患者临床病理因素和生存期之间的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2011年3月至2013年3月安徽医科大学附属省立医院收治的可手术切除的NSCLC患者205例,均接受外科手术治疗。纳入标准:(1)年龄大于18岁,病理诊断为NSCLC;(2)术前未接受放化疗。排除标准:(1)患者缺乏足够的肿瘤组织;(2)术后诊断为小细胞肺癌;(3)术后的随访资料不完整。最终纳入研究197例,对全部病理标准重新评估,TNM分类第8版用于病理分期[12]。
1.2方法
1.2.1临床资料收集 从患者的病历资料中提取年龄、性别、吸烟史、BMI、辅助治疗、病理诊断、间质性肺炎和表皮生长因子受体(EGFR)突变等临床病理信息。
1.2.2随访 患者手术后即开始随访,术后的前3年每隔6个月行1次胸部CT和血液肿瘤标志物检查,以后每年进行1次胸部CT检查,对怀疑复发的患者,采用PET检查或病理活检确诊。
1.2.3病理组织MTH1的免疫组织化学 病理组织切片脱蜡后,用过氧化物酶封闭剂(080-01186 Wako,日本)和蛋白封闭剂(19-2410-3 Sigma-Aldrich,美国)处理标本。将组织切片与抗MTH1抗体(1∶100的稀释度,兔抗人MTH1抗体,Sigma-Aldrich,美国)温育。然后与DAKO ENVISION+聚合物/辣根过氧化物酶(HRP,抗兔;K4003 Dako,Tokyo,日本)温育。液体DAB+发色团(049-22831,Wako,Osaka,日本)用于显现抗原。用苏木素对组织标本进行复染以区分细胞核和细胞质。
1.2.4MTH1免疫组织化学评分和患者分组 两位独立的病理学家评估免疫组织化学的结果,根据MTH1染色细胞占总癌细胞比例确定评分[18]:1分,0~<20%;2分,20%~<40%;3分,40%~<60%;4分,60%~<80%;5分,80%~100%。同时,本研究根据MTH1染色评分进行受试者工作曲线分析其预测患者总生存率和无瘤生存率,ROC曲线提示最佳截断值为3.234和3.443,将MTH1表达截止值设定为3分。<60%的肿瘤细胞染色评定为MTH1高表达组;≥60%的肿瘤细胞染色评定为MTH1低表达组。
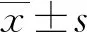
2 结 果
2.1全部患者的临床特征和MTH1表达情况 全组患者197例,其中男120例(60.9%),女77例(39.1%),中位年龄54(38,83)岁。104例(52.8%)患者吸烟史大于20包/年。腺癌140例(71.1%),鳞癌42例(21.3%),其他类型15例(7.6%)。在74例肿瘤中评估EGFR突变状态,24例(32.4%)患者存在EGFR突变,见表1。MTH1主要在肺癌细胞的细胞核中表达,细胞质中无表达,正常的肺组织细胞存在少许表达,见图1。其中MTH1高表达组111例(56.3%),低表达组86例(43.7%)。
2.2MTH1表达与临床病理参数之间的关系 MTH1高表达和男性、吸烟大于20包/年、鳞癌、病理分期大于Ⅰ期、肿瘤直径大于3 cm、淋巴结转移、胸膜浸润阳性、淋巴管浸润和血管浸润显著性相关(P<0.05)。在评估EGFR突变状态的74例患者中,野生型EGFR倾向于与MTH1高表达相关(P<0.05),见表1。
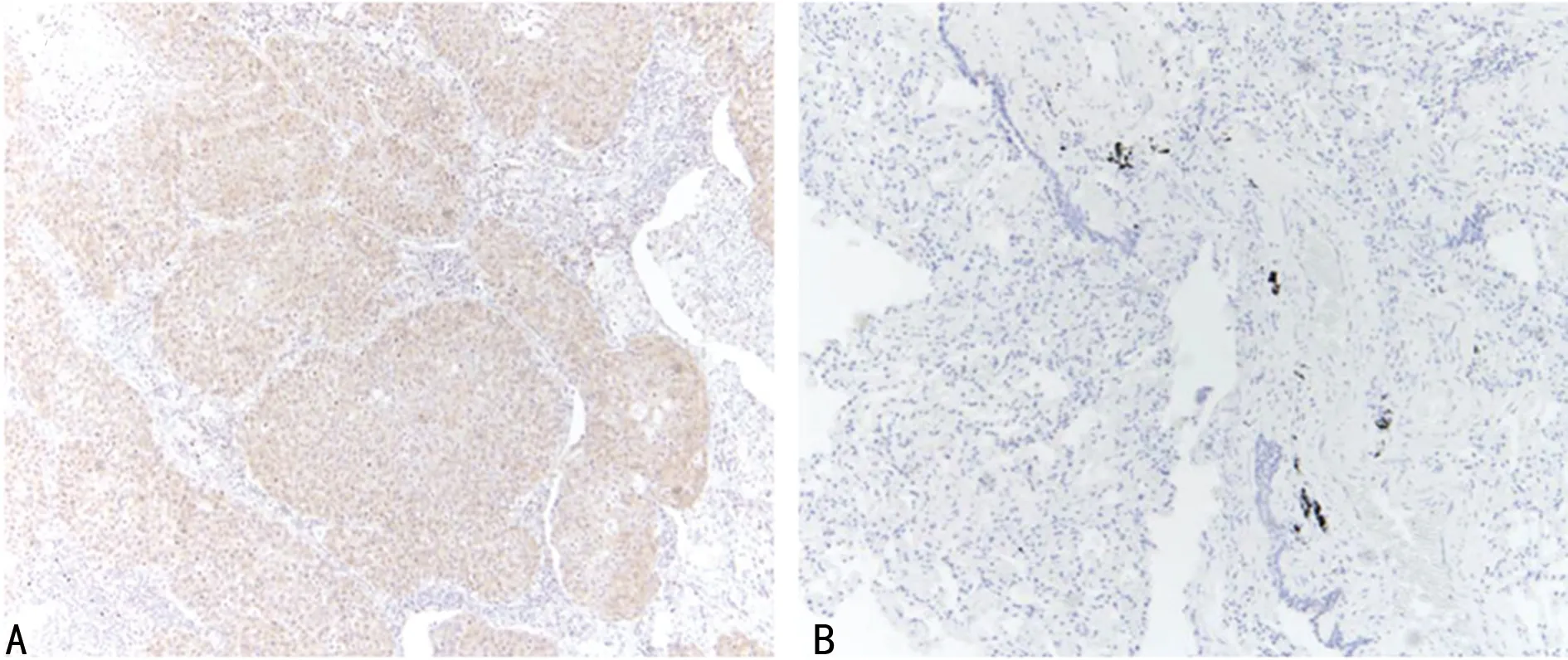
A:MTH1高表达组;B:MTH1低表达组
图1NSCLC癌组织免疫组织化学染色(100×)

表1 MTH1高表达和低表达组与临床病理参数之间的关系[n(%)]
a:n=74
2.3MTH1高、低表达组总生存率及无瘤生存率之间关系 Kaplan-Meier曲线的生存分析显示,MTH1高表达组预后显著性低于MTH1低表达组。MTH1高表达组和MTH1低表达组5年总生存率分别为81.6%和92.3%(P=0.001 1),5年无瘤生存率分别为55.0%和83.7%(P=0.000 2),见图2。
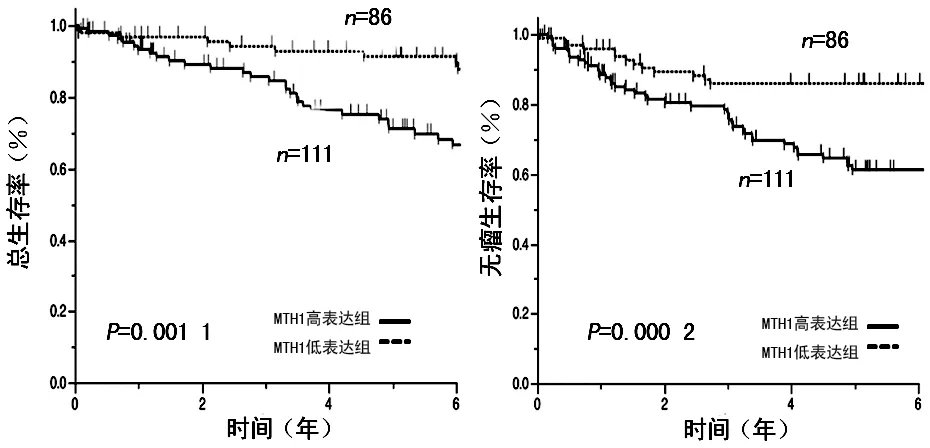
图2 MTH1高低表达患者的总生存率和无瘤生存率的比较

图3 肺腺癌MTH1高、低表达组的总生存率和无瘤生存率比较
2.4肺腺癌和肺鳞癌MTH1表达与总生存率及无瘤生存率的关系 肺腺癌患者MTH1高、低表达组5年总生存率分别为76.5%和95.4%(P=0.003 1),无瘤生存率分别为55.3%和85.3%(P=0.000 7)。MTH1表达对肺鳞癌患者的总生存率及无瘤生存率无显著影响,见图3、4。

图4 肺鳞癌MTH1高、低表达组的总生存率和无瘤生存率比较
2.5患者总存率的单因素和多因素分析 单因素分析显示:MTH1与病理分期、肿瘤直径、淋巴结转移、胸膜浸润、淋巴管浸润和血管浸润一起构成总生存率的显著性危险因素;而多因素分析提示:MTH1表达(HR=1.713,95%CI:1.865~4.118,P=0.047 0)和淋巴结转移(HR=9.190,95%CI:2.824~39.457,P<0.01)是患者总生存率的独立危险因素,见表2。
2.6患者无瘤生存率的单因素和多因素分析 单因素分析显示:MTH1与性别、吸烟程度、病理分期、肿瘤直径、淋巴结转移、胸膜浸润、淋巴管浸润和血管浸润一起构成总生存率的显著性危险因素;而多因素分析提示:MTH1表达(HR=1.605,95%CI:1.627~3.248,P=0.039 0)和淋巴结转移(HR=4.502,95%CI:1.942~11.546,P=0.000 3)是患者无瘤生存率的独立危险因素,见表3。

表2 总体生存率的单因素和多因素分析(n=197)

续表2 总体生存率的单因素和多因素分析(n=197)

表3 无瘤生存率的单因素和多因素分析(n=197)

续表3 无瘤生存率的单因素和多因素分析(n=197)
3 讨 论
肺癌是病死率最高的癌症,对人类的健康和生命具有极大的威胁。在现代肿瘤分子生物学研究的证实下,发生癌症的原因是多种因素共同作用、多种基因共同参与、多阶段的经历最终发展而成的十分复杂的生物学的行为。究其根本,肺癌的发生和癌症基因被激活及抑制癌症的基因失去活性有重要的联系,以上两种因素会直接造成肿瘤细胞失去凋亡功能,进而通过多种调控机制和血管生成因子的互相作用,进一步促使癌症的发生。而血管内皮细胞生长因子是目前所知的作用最强的促血管生长因子,能够增强血管通透性,刺激血管内皮细胞的产生,对内皮细胞具有特意分裂能力。
NSCLC发病的机制为癌基因和抑癌基因失衡导致的细胞增殖失控,DNA精准复制过程是基因表达的基础。内外各种原因所致的DNA或DNA组成成分的损伤均可导致基因表达失控或细胞凋亡。
MTH1是一种氧化型嘌呤核苷三磷酸酶,将8-氧代-dGTP水解成其单磷酸形式,通过清除核苷酸库中的氧化核苷酸来维持体细胞中遗传信息完整性,防止细胞在复制过程中将8-氧-G掺入DNA和8-氧-G在细胞核中过度累积而导致细胞坏死。癌细胞常暴露于比周围正常细胞更高的氧化应激水平,并且MTH1在癌细胞中高表达,通过阻止氧化的dNTPs掺入DNA[10],表明MTH1有助于癌细胞增殖[8]。MTH1活性对癌细胞完整性是必需的[10]。在NSCLC中,MTH1 mRNA过度表达,并与细胞8-氧-G水平呈负相关。有研究报道NSCLC组织中MTH1活性高于正常肺组织。然而,NSCLC中MTH1蛋白升高的临床意义尚不清楚。
本研究发现MTH1蛋白高表达与NSCLC患者的肿瘤恶性潜能(淋巴结转移和肿瘤分期晚期)有关。这些发现与先前评估肾细胞癌中MTH1 mRNA表达的临床报道一致。本研究还发现MTH1高表达患者的无瘤生存率和总生存率均低于MTH1低表达的患者。此为首次发现MTH1高表达和NSCLC生存期相关。多因素分析显示MTH1高表达是患者无瘤生存率和总生存率的独立的预后因子。这个研究结果提示肿瘤细胞增殖可能与需要MTH1的表达来对抗ROS所致的细胞DNA损伤有关。
MTH1如何影响NSCLC的生物学行为的精确机制尚不清楚。综合文献报道和本研究结果发现,MTH1表达增加NSCLC患者癌细胞的恶性潜能。在NSCLC的癌细胞中,具有高侵袭性的肿瘤细胞可能较多地暴露在ROS刺激下,诱导MTH1高表达,修复DNA,行快速增殖,使得肿瘤细胞更具有向淋巴管、血管浸润和胸膜浸润的潜能。癌细胞代谢研究提示:高侵袭性和进行性增殖癌细胞依赖于有氧糖酵解,实现DNA快速复制,分裂成子细胞并传播到身体其他部位。这表明癌细胞中产生更多的氧化应激[7]和ROS,导致更多的8-氧-G累积,导致癌细胞的坏死。事实上,癌细胞可能通过MTH1表达的增加逃避ROS所致的DNA损伤,从而表现出更高的恶性潜能。从而导致患者的预后更差。本研究显示MTH1高表达与重度吸烟(>20包/年)显著性相关,吸烟则是氧化应激的触发因素,吸烟量显著性增加肺组织中ROS的水平。结合本研究的发现,提示吸烟患者肺癌的癌细胞恶性潜能更高,能应对过度的氧化应激。高氧化应激环境中的癌细胞可能通过提高MTH1的表达而防止DNA中8-氧-G的累积。因此,MTH1可能是癌细胞氧化应激的标志物,也是肺癌患者生存期较差的指标。
在肺癌的治疗中,手术、放疗和化疗被认为是标准治疗,但是对部分患者预后仍不理想,需要新的治疗策略来延长NSCLC患者的预后。有研究显示,阻断MTH1有助于抑制细胞增殖[11,24]和上皮-间质转化[15],从而支持MTH1可作为NSCLC患者治疗靶点。在本研究中,41%患者MTH1高表达,提示一些NSCLC患者可能会在未来的抑制MTH1的靶向治疗中收益,其作为治疗靶点的潜力尚需要进一步研究。
本研究有几个局限性:(1)这是在单一机构中进行的回顾性研究,尚需要多中心、大样本量的研究验证。(2)免疫组织化学结果的评估标准问题,尽管本研究通过ROC曲线寻找最佳的免疫组织化学评分的截断值,尚需要建立统一的标准来评估MTH1的表达状态来区分临床上亚组。(3)肿瘤细胞中MTH1高表达的精确机制尚需进一步研究。
综上所述,在NSCLC中,MTH1高表达患者表现出更高的恶性特征。MTH1高表达患者的无瘤生存率和总生存率低于MTH1低表达患者,同时MTH1表达是NSCLC预后的独立危险因素。NSCLC患者术后病理MTH1表达状态有助于区分预后较差的患者,其也可能成为NSCLC新的潜在治疗靶点。
