SOX1过表达通过β-catenin通路抑制胃癌细胞增殖和侵袭①
2019-08-15胡爱萍吴贵恺吴艳杰郑荣娟
胡爱萍 吴贵恺 吴艳杰 郑荣娟 周 蕾
(唐山市工人医院消化内科,唐山063000)
胃癌是临床常见恶性肿瘤之一,具有较高的并发率与死亡率且患者预后较差,研究显示影响胃癌治疗效果的主要原因为胃癌细胞增殖及迁移[1]。目前关于胃癌细胞增殖及迁移的机制研究较多,但临床胃癌患者治疗效果仍高居不下,因而进一步分析胃癌发生、发展机制对临床治疗具有重要指导意义。以往研究表明信号通路紊乱、癌基因及抑癌基因表达水平的变化均可导致胃癌的发生及发展[2]。Wnt/β-catenin信号通路可诱导上皮细胞发生上皮-间质转化(Epithelial-mesenchymal transition,EMT),细胞核中β-catenin表达升高可促进肿瘤细胞发生EMT及转移,研究表明Wnt/β-catenin信号通路可促进胃癌细胞增殖及迁移[3]。相关研究表明性别决定区Y框蛋白1(Sex determining region Y-box 1,SOX1)是高迁移率族蛋白(HMG)DNA结构域转录因子家族成员,其可在胚胎发育等过程中发挥重要作用,同时还可参与肿瘤发生及发展过程[4]。研究显示SOX1可直接抑制β-catenin表达并抑制Wnt/β-catenin信号通路进而抑制肿瘤发生,但其具体作用机制有待深究[5]。关于SOX1与胃癌的相关研究相对较少,因此本研究通过上调SOX1表达,观察其对胃癌细胞增殖、迁移及侵袭的影响以及对β-catenin信号通路的调控作用,以期为胃癌的治疗提供参考。
1 材料与方法
1.1材料
1.1.1细胞 人正常胃黏膜上皮细胞GES-1与胃癌细胞系SGC-7901细胞均购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2主要试剂与仪器 RPMI1640培养基、胎牛血清、CCK-8检测试剂盒均购自美国ThermoFisher公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;MTT、RIPA裂解液、PVDF膜、Matrigel基质胶均购自北京索莱宝科技有限公司;Wnt/β-catenin通路激活剂SKL2001购自美国Sigma公司;β-catenin抗体购自美国Santa Cruz公司;上皮性钙黏附蛋白(E-cadherin)、神经性钙黏附蛋白(N-cadherin)、基质金属蛋白酶(MMP-9)抗体均购自上海酶联生物科技有限公司;辣根过氧化物酶标记羊抗兔、兔抗羊IgG购自美国Santa Cruz公司;蛋白提取试剂盒、BCA蛋白检测试剂盒购自北京天根生化科技有限公司;miRNA提取试剂盒、RT-PCR检测试剂盒购自南京vazyme生物公司;Transwell小室购自美国Corning公司;CFX96PCR仪、蛋白凝胶成像仪购自Bio-Rad公司。
1.2方法
1.2.1细胞培养 取出保存GES-1细胞、SGC-7901细胞,常温条件下复苏,加入含10%胎牛血清的RPMI1640进行培养,加入链霉素(100 μg/ml)、青霉素(100 U/ml),置于培养箱中培养(温度37℃、5%CO2),待细胞生长至90%时进行传代培养,稳定2~3代后,收集对数生长期细胞用于实验。
1.2.2细胞转染与分组 取对数期SGC-7901细胞,胰蛋白酶消化,制备单细胞悬液,接种于6孔培养板(1×105个/孔),培养至细胞融合达80%左右,更换为不含胎牛血清的新鲜RPMI1640培养基,严格按照Lipofectamine 2000转染试剂盒说明书操作,将SOX1阴性对照质粒、SOX1 mimis质粒分别转染至SGC-7901细胞,分别命名为阴性转染组、SOX1过表达组,未经处理的细胞命名为空白对照组。β-catenin激活剂组:SOX1 mimis转染SGC-7901细胞前30 min,向培养基加入Wnt/β-catenin通路激活剂SKL2001(终浓度为10 μmol/L)进行预处理。联合组:SOX1 mimis转染SGC-7901细胞后,加入Wnt/β-catenin通路激活剂SKL2001。转染后将其置于培养箱中(37℃、5%CO2)培养6 h,更换含有10%胎牛血清的RPMI1640培养基继续培养48 h,收集细胞上清待测。
1.2.3实时定量PCR(qRT-PCR)检测SOX1及β-catenin mRNA表达 Trizol法提取细胞总RNA,按照反转录试剂盒说明书进行反转录,将RNA反转录为cDNA。参照qRT-PCR试剂盒进行RT-PCR反应。反应体系为20 μl:SYBR Premix 10 μl,cDNA 1 μl,H2O 8 μl,上下游引物各0.5 μl。反应程序:95℃ 5 min,95℃ 305 s,57℃ 30 s,72℃ 1 min,共循环35次。均以磷酸甘油醛脱氢酶(Glyceraldehyde-phosphate dehydrogenase,GADPH)为内参基因,采用2-ΔΔCt法计算SOX1、β-catenin mRNA相对表达水平。
1.2.4CCK-8法检测SGC-7901细胞增殖 收集各组SGC-7901细胞并接种96孔,5 000个/孔,分别培养0、12、24、36、48、60、72 h,参照CCK-8检测试剂盒说明书进行实验,分别检测450 nm波长时各孔细胞光密度(OD),并计算细胞增殖抑制率,细胞增殖抑制率(%)=(空白组吸光度-实验组吸光度)/空白组吸光度×100%。
1.2.5平板细胞克隆实验检测SGC-7901细胞增殖 收集各组SGC-7901细胞,胰蛋白酶消化并制备单细胞悬液,接种于RPMI1640(6 ml)培养皿,1 000 个/皿,混匀,放置在CO2培养箱中培养,观察细胞生长情况(间隔12 h/次)。肉眼观察细胞克隆形成时,取出培养皿,统计克隆形成细胞数量,克隆形成率=(克隆形成细胞数量/1 000)×100%。
1.2.6Transwell法检测SGC-7901细胞迁移和侵袭 细胞迁移实验:收集各组SGC-7901细胞制备单细胞悬液,Transwell小室置于24孔板,将单细胞悬浮液接种于小室上层(10 000个/孔),小室下层加入含10%胎牛血清RPMI1640培养基(700 μl),CO2培养箱孵育24 h,清洗风干后采用95%乙醇固定,0.5%结晶紫染色15 min,去除小室滤膜上层未迁移细胞,统计迁移至滤膜下层细胞数量。细胞侵袭实验:将Matrigel胶(50 μl 2.0 mg/ml)加入小室上层底部,后续步骤同细胞迁移实验。
1.2.7蛋白免疫印迹法(Western blot,WB)检测β-catenin、E-cadherin、N-cadherin、MMP-9蛋白表达情况 收集转染后各组SGC-7901细胞,蛋白裂解液反应30 min,采用蛋白提取试剂盒提取细胞总蛋白,BCA法测定蛋白浓度,采用8%~10% SDS-聚丙烯(PAGE)胶分离不同分子量的蛋白质。蛋白样品与Loading buffer 1∶4 混匀后上样,电泳结束后,蛋白凝胶移至PVDF膜,转膜反应(4℃),转膜时间为90 min,结束后采用TBST溶液清洗,5%脱脂牛奶封闭90 min,加入一抗,4℃过夜,次日加入二抗,室温下孵育90 min,加入ECL显色,将其置于凝胶成像仪中观察蛋白表达情况,以目的蛋白条带灰度值/内参GAPDH条带灰度值表示目的蛋白相对表达量。
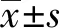
2 结果
2.1GES-1、SGC-7901细胞中SOX1表达水平比较 胃癌细胞SGC-7901中SOX1表达水平显著低于正常细胞GES-1(P<0.01),详见表1。
2.2各组转染效果检测 转染后,SOX1过表达组SOX1表达水平显著高于空白对照组、阴性转染组(P<0.01),而β-catenin表达水平显著降低(P<0.01);与联合组相比,SOX1过表达组SOX1表达水平显著升高(P<0.01),而β-catenin表达水平显著降低(P<0.01);β-catenin激活剂组SOX1表达水平显著低于联合组(P<0.01),而β-catenin表达水平显著升高(P<0.01),详见图1、2。

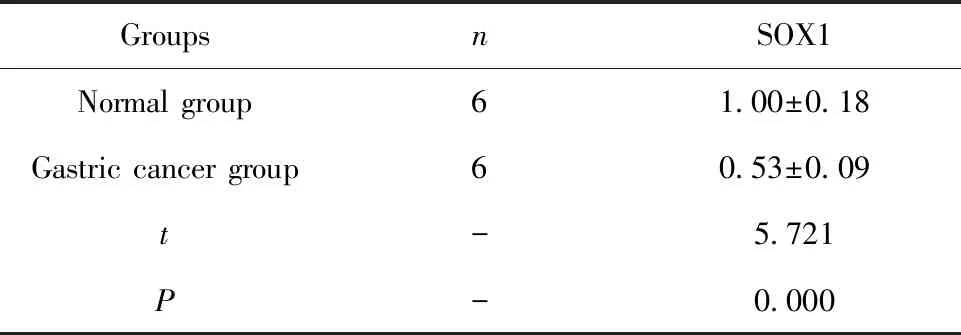
GroupsnSOX1Normal group61.00±0.18Gastric cancer group60.53±0.09t-5.721P-0.000
2.3SOX1过表达抑制SGC-7901细胞增殖 随着培养时间的延长,SOX1过表达组SGC-7901细胞增殖抑制率显著升高(P<0.01),且不同时间点细胞增殖抑制率均显著高于空白对照组、阴性转染组(P<0.01);与联合组相比,SOX1过表达组SGC-7901细胞增殖抑制率显著增加(P<0.01),而β-catenin激活剂组SGC-7901细胞增殖抑制率显著降低(P<0.01),详见图3。

图1 转染后各组SOX1 mRNA表达水平Fig.1 SOX1 mRNA expression levels in each group after transfectionNote: *.P<0.01 compared with the blank control group and the negative transfection group;#.P<0.01 compared with the Joint group.

图2 转染后各组β-catenin mRNA表达水平Fig.2 Expression levels of β-catenin mRNA in each group after transfectionNote: *.P<0.01 compared with the blank control group and the negative transfection group;#.P<0.01 compared with the Joint group.
2.4平板克隆形成情况 SOX1过表达组SGC-7901细胞平板克隆形成率显著低于空白对照组、阴性转染组(P<0.01);与联合组比较,SOX1过表达组SGC-7901细胞平板克隆形成率显著降低(P<0.01),而β-catenin激活剂组SGC-7901细胞平板克隆形成率升高(P<0.01),详见表2。
2.5细胞迁移及侵袭情况 SOX1过表达组SGC-7901细胞迁移及侵袭数量均显著低于空白对照组、阴性转染组、联合组(P<0.01);β-catenin激活剂组SGC-7901细胞迁移及侵袭数量均显著高于联合组(P<0.01),详见图4、表3。
2.6细胞中β-catenin、E-cadherin、N-cadherin、MMP-9蛋白表达情况 SOX1过表达组SGC-7901细胞中β-catenin、N-cadherin、MMP-9蛋白表达量均显著低于空白对照组、阴性转染组、联合组(P<0.01),而E-cadherin蛋白表达量显著升高(P<0.01);β-catenin激活剂组SGC-7901细胞β-catenin、N-cadherin、MMP-9蛋白表达量均显著高于联合组(P<0.01),而E-cadherin蛋白表达量显著降低(P<0.01),详见图5、表4。

图3 SOX1过表达对SGC-7901细胞增殖的影响Fig.3 Effect of SOX1 overexpression on proliferation of SGC-7901 cellsNote: *.P<0.01 compared with the blank control group and the negative transfection group;#.P<0.01 compared with the Joint group.
表2 SOX1过表达对SGC-7901细胞平板克隆形成率的影响
Tab.2 Effect of SOX1 overexpression on formation rate of SGC-7901 cell plate clone

GroupsnClonal formation rate(%)Blank control group655.32±9.22Negative transfection group656.47±9.41SOX1 overexpression group6 35.19±5.871)2)β-catenin activator group6 77.38±12.892)Joint group652.18±8.70F-15.056P-0.000
Note:1)P<0.01 compared with the blank control group and the negative transfection group;2)P<0.01 compared with the Joint group.
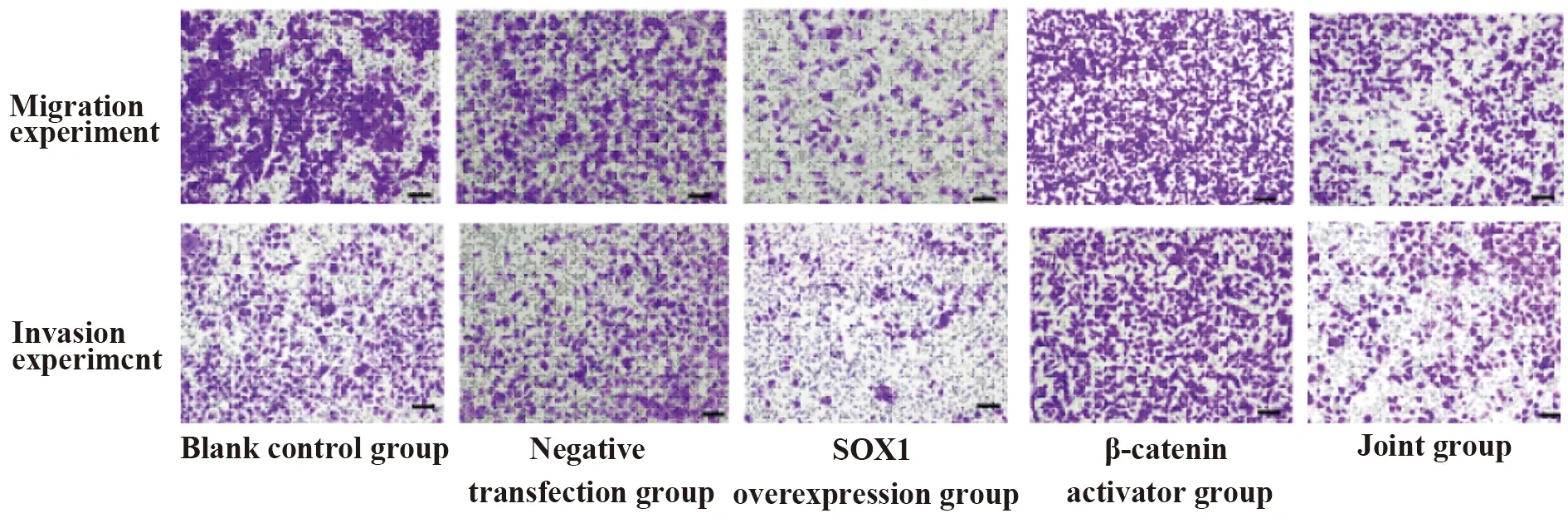
图4 SOX1过表达对SGC-7901细胞迁移及侵袭能力的影响(×100)Fig.4 Effect of SOX1 overexpression on migration and invasion of SGC-7901 cells (×100)
表3 细胞迁移及侵袭数量比较
Tab.3 Comparison of cell migration and invasion

GroupsnNumber ofmigrated cellsNumber ofinvading cellsBlank control group6132.15±22.03112.47±18.75Negative transfection group6128.46±21.41120.36±20.06SOX1 overexpression group685.19±14.201)2)83.65±13.941)2)β-catenin activator group6213.15±35.532)215.16±35.862)Joint group6136.49±22.75145.37±24.23F-21.94126.294P-0.0000.000
Note:1)P<0.01 compared with the blank control group and the negative transfection group;2)P<0.01 compared with the Joint group.

图5 细胞中β-catenin、E-cadherin、N-cadherin、MMP-9蛋白表达Fig.5 Expression of β-catenin,E-cadherin,N-cadherin and MMP-9 proteins in cellsNote: 1.Blank control group;2.Negative transfection group;3.SOX1 overexpression group;4.β-catenin activator group;5.Joint group.
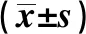


Groupsnβ-cateninE-cadherinN-cadherinMMP-9Blank control group61.23±0.210.68±0.111.34±0.221.51±0.25Negative transfection group61.26±0.220.67±0.121.41±0.241.49±0.25SOX1 overexpression group60.52±0.091)2)2.56±0.431)2)0.58±0.121)2)0.55±0.151)2)β-catenin activator group62.35±0.392)0.63±0.112)2.47±0.422)2.69±0.522)Joint group61.38±0.231.58±0.271.64±0.271.58±0.26F-42.02372.55437.32535.603P-0.0000.0000.0000.000
Note:1)P< 0.01 compared with the blank control group and the negative transfection group; 2)P<0.01 compared with the Joint group.
3 讨论
胃癌患者术后生存时间较短,其主要原因为癌细胞增殖、迁移及侵袭[6]。因此,鉴定胃癌细胞转移相关的生物学分子,并探究其分子作用机制对胃癌靶向治疗具有重要意义SOX家族成员可参与肿瘤发生及发展,其中SOX1可发挥抑癌作用[7]。相关研究表明微小RNA-155-5p可通过抑制SOX1表达进而促进乳腺癌细胞迁移及侵袭[8]。肺癌细胞中SOX1表达降低并上调ECT2表达,同时SOX1还可通过影响相关通路表达进而抑制癌细胞增殖及迁移[9,10]。本研究结果显示胃癌细胞中SOX1表达水平显著低于胃黏膜上皮细胞,说明SOX1可能参与胃癌发生过程。正常生理条件下细胞核中β-catenin表达较低,Wnt信号通路激活后导致大量β-catenin进入细胞核并激活下游靶基因转录进而促进肿瘤细胞增殖、迁移及侵袭[11]。相关研究表明胃癌组织中β-catenin蛋白表达显著升高并可促进该病发生、发展,但具体作用机制尚未完全阐明[12]。杨肖军等[13]研究表明成纤维细胞激活蛋白可激活Wnt/β-catenin信号通路进而促进胃癌细胞增殖及迁移。近来相关研究显示SOX1表达水平上调可抑制β-catenin作用进而抑制肿瘤细胞侵袭转移[14]。为了探究SOX1抑癌作用与Wnt/β-catenin信号通路的相关性,本研究在SOX1过表达胃癌细胞中加入Wnt/β-catenin信号通路激活剂SKL2001,结果显示SOX1过表达组SOX1表达水平显著升高,而β-catenin表达水平显著降低,β-catenin激活剂组SOX1表达水平显著降低,而β-catenin表达水平显著升高,说明胃癌细胞中SOX1过表达后其表达水平升高进而抑制β-catenin表达。同时本研究进一步分析各组细胞增殖情况,结果显示SOX1过表达组SGC-7901细胞增殖抑制率显著升高,而β-catenin激活剂组SGC-7901细胞增殖抑制率显著降低,说明SOX1过表达后可抑制β-catenin促进胃癌细胞增殖的作用。提示SOX1可通过Wnt/β-catenin信号通路进而抑制胃癌细胞增殖。
乳腺癌组织中SOX1呈低表达,上调其表达可显著抑制肿瘤细胞迁移及侵袭能力[15]。Rad等[16]研究表明SOX1过表达后可显著抑制食管鳞癌细胞侵袭能力。SOX家族中SOX2在胃癌细胞中呈低表达,过表达后可下调细胞周期素D1及多聚ADP核糖聚合酶表达进而促进癌细胞凋亡[17]。本研究结果显示SOX1过表达组SGC-7901细胞迁移及侵袭数量均显著降低,β-catenin激活剂组SGC-7901细胞迁移及侵袭数量均显著升高,说明SOX1过表达后可抑制β-catenin对胃癌细胞迁移及侵袭的促进作用。为探讨其具体作用机制,本研究分析Wnt通路中β-catenin等相关蛋白表达,结果显示SOX1过表达组β-catenin、MMP-9蛋白表达均显著降低,而加入β-catenin激活剂后其蛋白表达均显著升高,其中MMP-9还可降解细胞外基质进而促进肿瘤细胞转移、侵袭[18,19]。提示SOX1可通过抑制β-catenin、MMP-9蛋白表达进而抑制胃癌细胞迁移及侵袭。相关研究表明EMT过程中E-cadherin可抑制肿瘤细胞迁移及侵袭,而N-cadherin作用相反[20]。本研究SOX1过表达E-cadherin表达升高而N-cadherin表达降低,提示SOX1可通过调控β-catenin、MMP-9、E-cadherin及N-cadherin蛋白表达进而抑制胃癌细胞迁移及侵袭。
综上所述,SOX1可通过抑制β-catenin通路进而抑制胃癌细胞增殖、迁移及侵袭,有助于为临床治疗胃癌提供新的理论依据。本研究存在不足之处,关于SOX1与β-catenin通路在胃癌发生及发展过程中的具体作用机制有待深入研究。
