臭牡丹提取物体外抑菌及免疫毒理学研究①
2019-08-15张蜀艳蒲建萍张良玺
张蜀艳 蒲建萍 李 政 张良玺
(成都工业职业技术学院,成都610051)
臭牡丹(Clerodendrum bungei steud,CBS)为双子叶马鞭草科大青属植物,以根及叶入药。夏季采叶,秋季采根,鲜用或晒干备用。性平,味甘、苦。归经入肝、脾经。具有解痉、镇痛、镇静、抗惊厥、抗炎、抗溃疡、抗菌及解热的作用,著名的云南蛇药中即含有很大比例的“臭牡丹”。
CBS始载于《神农本草经》,在民间具有广泛的使用记载,在《本经》《别录》《药性论》《日华子本草》《开宝本草》《滇南本草》中记载了具有行瘀、止痛、凉血、消肿的作用;在《植物名实图考》《草木便方》《分类草药性》《天宝本草》《贵州民间方药集》《四川中药志》《陕西中草药》载有行气健脾、祛风平肝、消肿解毒的功效;在《滇南本草》《中药形性经验鉴别法》《云南中草药选》记载了具有祛风、截疟、行气、利水的作用;在《新疆中草药手册》《陕西中草药》《陕甘宁青中草药选》具有宣肺气、祛风湿、消肿毒的作用;在《别录》《日华子本草》《长沙药解》《分类草药性》《贵州民间方药集》《四川中药志》《上海常用中草药》载有祛风除湿、活血散瘀的作用;在《千金方》《梅师集验方》《四川中药志》《云南中草药选》《泉州本草》《江西民间草药》《浙江民间草药》《岭南采药录》《南宁市药物志》《广东中药》《广西中草药》载有消肿解毒、祛风止痒、治疗黄疸的作用。
民间用法中发现CBS具有一定的抗菌性和提高人体免疫功能的功效,为了科学证明此结论,分别对CBS提取物做了体外抑菌实验和免疫毒理学实验,实验如下。
1 材料与方法
1.1材料 致病大肠杆菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、酵母菌[CMCC(B)98007]、伤寒杆菌[CMCC(B)50071]、副伤寒甲杆菌[CMCC(B)50093]、金黄色葡萄球菌[CMCC(B)26003]均由四川省药品检验所提供。真菌培养基、营养肉汤固体培养基、琼脂培养基均由四川省药品检验所提供。高速组织匀浆机、烧杯、培养皿、培养箱、吸量管等为成都工业职业技术学院生化实训室提供。地塞米松(Dexamethasone,DXMS)(江苏恒瑞医药),5%鸡红细胞(Chicken erythrocyte,CRBC)、迈格染料、甲醇、吉氏染粉、甘油、磷酸缓冲液(厦门海标科技有限公司),生理盐水(江西省创欣药业集团有限公司),丙酮-甲醇液、EDTA-Na2、CD3+-FITC Hamster anti-mouse、CD4+-PErat anti-mouse、CD8+-PerCP Rat anti-mouse(美国BD公司)。健康小白鼠90只,体重(20±2)g,清洁级雌雄各半(成都通德药业有限公司实验动物中心提供)。云芝多糖(Coriolus versicolor polysaccharide,CVP,西安艾诺医药科技有限责任公司)。二氧化碳培养箱(上海三腾仪器有限公司);流式细胞仪(美国贝克曼库尔特);高速离心机(广州吉迪仪器有限公司);倒置高倍显微镜(赛默飞世尔科技有限公司);超静无菌工作台(山东博科科学仪器有限公司)。
1.2方法
1.2.1CBS提取物制备 样品1:新鲜CBS全株(叶、茎、根)洗净,绞碎取汁,混匀后超真空蒸馏,灭菌处理。样品2:新鲜CBS全株(叶、茎、根)洗净绞碎,用95%乙醇浸提,回收乙醇后真空蒸馏,灭菌处理。样品3:新鲜CBS全株(叶、茎、根)洗净,用100℃水、分3次煎煮后,乙醇沉淀,超真空蒸馏得冻干品,灭菌处理。CBS提取物:样品3经过Sevage法除蛋白和透析得到分子量在8 kD以上的物质(本实验室自制)。
1.2.2制备细菌液[1-3]本实验在超净工作台中进行。分别从致病大肠杆菌、酵母菌、伤寒杆菌、副伤寒甲杆菌、金黄色葡萄球菌的菌种斜面沾取少量菌苔接种到营养肉汤中,(36±1)℃培养箱中培养24 h后,作为原菌液;白色念珠菌真菌琼脂斜面培养物挑取少量菌苔接种到真菌培养基中于20~25℃培养24 h后作为原菌液。分别用灭菌生理盐水进行10倍系列稀释,使每1 ml中活菌数约1 000个,作为实验菌液。
1.2.3制备供试液及实验过程[4-6]CBS提取物用营养肉汤(白色念珠菌用真菌培养基)以对倍稀释法对致病大肠杆菌、酵母菌、伤寒杆菌、副伤寒甲杆菌、金黄色葡萄球菌、白色念珠菌供试液进行打碎搅匀逐管稀释,使供试液浓度在每管中呈对倍递减。制成每组浓度依次为500、250、125、62.5、31.2、15.6 mg/ml的供试液若干组。于每组供试液的抑菌实验管中,分别加入相应已稀释好的实验菌液0.1 ml。以无菌水作空白对照,同时将阴性标准菌株加入样品中,和样品一起培养,作为阴性对照。然后置(36±1)℃培养24 h取出后,对各实验管样本划线于营养琼脂平板上,再置37℃培养24 h(白色念球菌置20~25℃后划线于真菌琼脂培养基上,再置20~25℃培养24 h),观察有无菌落生长。阴性对照不长菌,空白对照长菌则实验方法成立。
1.2.4小鼠分组及处理[7-9]小鼠按表1进行分组,按表1剂量腹腔注射生理盐水(或CVP阳性组或CBS)连续7 d后,注射DXMS连续7 d。
1.2.5巨噬细胞功能和免疫器官指数检测 小鼠称重,腹注CRBC,8 h后处死,腹注PBS,轻揉腹部,取腹腔液体0.5 ml,载玻片(37℃孵育30 min),固定 5 min(丙酮∶甲醇=1∶1),吉姆萨染色。每张涂片计数200 个巨噬细胞,按公式计算吞噬率和吞噬指数:吞噬率%=(吞噬鸡红细胞的巨噬细胞数/200个巨噬细胞数)×100%;吞噬指数=(被吞噬鸡红细胞总数/200个巨噬细胞数)/2;另取各组小鼠脾和胸腺称重,按以下公式计算:脾脏指数=脾脏重量(mg)/体重(g),胸腺指数=胸腺重量(mg)/体重(g)。
1.2.6外周血淋巴细胞亚群检测 小鼠腹腔注射生理盐水(或CVP或CBS)连续7 d,腹腔注射DXMS连续7 d,取眼球血0.5 ml,加入4%EDTA-Na2,取100 μl分别加CD3+、CD4+、CD8+抗体各5 μl,4℃避光30 min,各管加溶血素1 ml,避光10 min,PBS 1 ml,离心5 min(1 000 r/min),将沉淀用 2 ml PBS洗涤,弃上清液,将沉淀用500 μl PBS重悬后上流式细胞仪分析。
1.3统计学分析 数据统计分析采用SPSS Statistics软件,方差分析组间差异,变量在各组的均值与总均值之偏差平方和的总和,记作SSb,组间自由度dfb,再进行组间比较,P<0.05表示差异有统计学意义。
2 结果
2.1CBS提取物外用抑菌情况 表2表明,CBS的水和乙醇提取物对酵母菌、伤寒杆菌、副伤寒甲杆菌和金黄色葡萄球菌抑制性强,对致病大肠杆菌和白色念球菌抑制性也较强,并且浓度越大抑制性越强,其中水提物的抑菌性优于乙醇提取物,再次证实了传统用药方法的合理性。当CBS水提物在125 g/L时,对所有实验用细菌均有理想的抑制作用,其中在外观上样品3具有明显的优势,所以在CBS免疫毒理学实验中均采用样品3作为供试品。
表1 实验用小鼠分组及腹腔注射剂量
Tab.1 Grouping and intraperitoneal injection dose of experimental mice
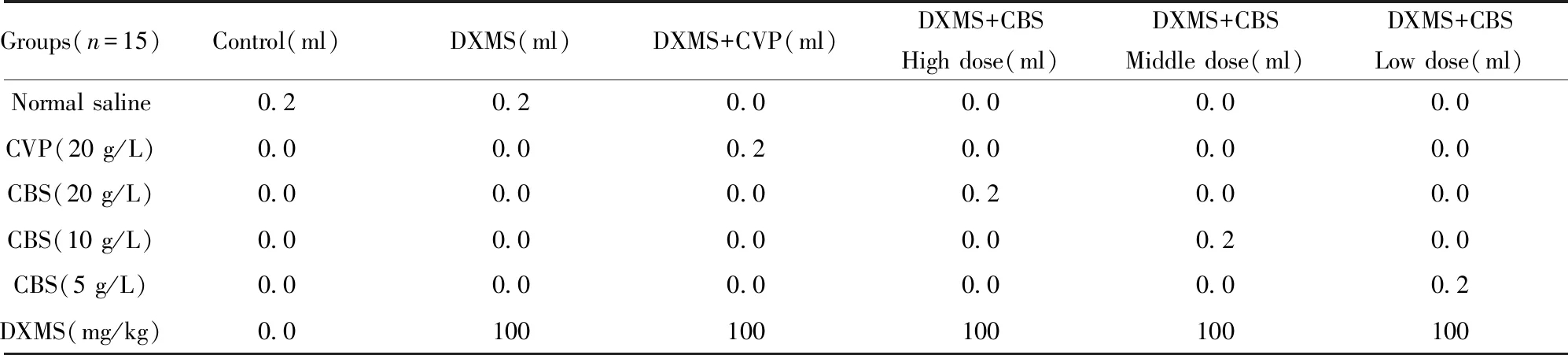
Groups(n=15)Control(ml)DXMS(ml)DXMS+CVP(ml)DXMS+CBSHigh dose(ml)DXMS+CBSMiddle dose(ml)DXMS+CBSLow dose(ml)Normal saline0.20.20.00.00.00.0CVP(20 g/L)0.00.00.20.00.00.0CBS(20 g/L)0.00.00.00.20.00.0CBS(10 g/L)0.00.00.00.00.20.0CBS(5 g/L)0.00.00.00.00.00.2DXMS(mg/kg)0.0100100100100100
表2 臭牡丹提取物外用抑菌实验结果
Tab.2 Experimental results of external application of extract from CBS

ConcentrationPathogenic Escherichia coliYeastSalmonella typhiParatyphoid BacillusStaphylococcus aureusCandida abicans500(mg/ml)Sample 1------Sample 2- -----Sample 3- -----250(mg/ml)Sample 1- -----Sample 2- -----Sample 3- -----125(mg/ml)Sample 1- -----Sample 2- ----+Sample 3- -----62.5(mg/ml)Sample 1- ---- +Sample 2 + ---- +Sample 3- ---- +31.2(mg/ml)Sample 1 + ---- +Sample 2 + + + ++ +Sample 3 + ---- +15.6(mg/ml)Sample 1 + + + ++ +Sample 2 + + + ++ +Sample 3 + + + ++ +
Note:+.Growth of bacteria;-.No growth of bacteria.



GroupsPhagocytosis rate(%)Phagocytosis indexSpleen indexThymus indexControl36.5±3.71 0.265±0.025.65±0.643.67±0.54DXMS19.90±3.341)0.157±0.021)2.08±0.241)0.92±0.281)DXMS+CVP23.98±2.602)0.179±0.032)3.74±0.363)1.47±0.323)DXMS+CBS(20 g/L)28.78±4.304)0.245±0.025)4.35±0.655)1.84±0.435)DXMS+CBS(10 g/L)23.77±4.560.199±0.04 3.92±0.521.53±0.202)DXMS+CBS(5 g/L)21.17±4.67 0.185±0.023.33±0.531.44±0.28
Note:1)P<0.01 vs control;2)P< 0.05,3)P<0.01 vs DXMS;4)P<0.05,5)P<0.01 vs DXMS+CVP.



GroupsCD3+T(%)CD4+T(%)CD8+T(%)CD4+CD8+Control76.05±4.91 39.51±3.8135.65±3.541.11±0.19DXMS93.19±4.741)77.03±6.211)19.78±1.431)3.89±0.791)DXMS+CVP96.10±4.2376.65±6.16 20.24±1.953.79±0.67DXMS+CBS(20 g/L)99.74±2.273)72.99±5.2331.81±4.943)5)2.29±0.593)5)DXMS+CBS(10 g/L)98.70±1.963)78.59±6.2722.25±1.384)3.53±0.532)DXMS+CBS(5 g/L)96.08±4.1679.43±3.5321.50±2.193.69±0.82
Note:1)P<0.01 vs control;2)P< 0.05,3)P<0.01 vs DXMS;4)P<0.05,5)P<0.01 vs DXMS+CVP.
2.2CBS对免疫抑制模型腹腔巨噬细胞功能和免疫器官指数的影响 相比于阳性组,高剂量CBS能使免疫抑制小鼠的吞噬率、吞噬指数明显提高(P<0.05或P<0.01)。相比于模型组,阳性组的CVP与中、高剂量的CBS提取物均能明显提高吞噬率和吞噬指数(P<0.05或P<0.01)。与空白组比较,模型组的各项指标均明显降低(P<0.01),其中巨噬细胞吞噬率下降45.5%,吞噬指数下降40.8%,脾脏和胸腺指数则分别下降63.2% 和74.9%。模型组脾脏及胸腺指数均小于空白组(P<0.01)。CVP与各剂量CBS均能提高免疫抑制小鼠的胸腺指数和脾脏指数 (P<0.01或P<0.05);阳性组与高剂量CBS 组相比差异有显著性统计学意义(P<0.01),见表3。
2.3CBS对免疫抑制小鼠T淋巴细胞亚群的影响 与空白组比较,DXMS、CVP、CBS均能明显升高CD3+T(P<0.01)、CD4+T(P<0.01)淋巴细胞的阳性率和CD4+/CD8+T细胞数量比值,降低CD8+T淋巴细胞的百分率(P<0.01),并随着CBS浓度增大,CD3+T、CD8+T淋巴细胞数量均有增大的趋势,而CD4+T淋巴细胞数量则减少。
与阳性组比较,高浓度CBS能较明显提高CD3+CD8+T淋巴细胞数量的阳性率,降低CD4+T淋巴细胞数量阳性率和CD4+/CD8+的比值,中、低浓度对CD3+、CD4+、CD8+T淋巴细胞数量阳性率和CD4+/CD8+的比值改变不大,见表4。
3 讨论
CBS水提物对酵母菌、伤寒杆菌、副伤寒甲杆菌、金黄色葡萄球菌、致病大肠杆菌、白色念球菌6种细菌抑制性优于乙醇提取物,且外观性较好,CBS水提物浓度大于等于125 g/L时,对实验用细菌均有理想抑制作用。溶剂便宜易得,有较高的开发和利用价值,在以后的研究中对实验条件可深入研究,增加提取率。
小鼠免疫抑制模型用地塞米松来制作。本研究通过连续7 d对小鼠腹腔注射100 mg/kg地塞米松造模,出现食少纳呆、疲乏无力等表现,免疫器官萎缩明显,腹腔吞噬指数和巨噬细胞吞噬率降低明显,表明小鼠免疫功能明显下降[10]。
巨噬细胞属免疫细胞,主要是以固定细胞或游离细胞的形式对细胞残片及病原体进行吞噬作用,激活淋巴球或其他免疫细胞,令其对病原体作出反应。研究表明,CBS与CVP相比能明显提高免疫抑制小鼠对CRBC的吞噬率与吞噬指数,对非特异免疫功能有明显促进作用[11]。
脾脏是机体最大的免疫器官,是机体细胞免疫和体液免疫的中心,有大量的巨噬细胞和淋巴细胞;胸腺为机体的重要免疫器官,是T淋巴细胞成熟分化的重要场所,与免疫紧密相关。DXMS使小鼠的免疫器官重量降低、脾淋巴细胞总数显著增加,CBS 能明显拮抗DXMS的细胞毒作用,促进淋巴细胞增殖,提高免疫抑制小鼠的免疫器官指数及重量,有明显的保护作用[12,13]。
T淋巴细胞亚群的测定是检测机体细胞免疫功能的重要指标,T淋巴细胞(CD3+)主要由辅助性T细胞(CD4+)和细胞毒性T细胞(CD8+)组成,CD4+T细胞具有协助体液免疫和细胞免疫的功能,去除受感染细胞,CD8+T细胞分布在抑制性T淋巴细胞和杀伤性T淋巴细胞表面,在免疫系统中发挥重要作用。注射DXMS的小鼠淋巴细胞总数降低、CD3+T细胞数量升高,提示DXMS可能对淋巴细胞及单核细胞具有更明显的细胞毒作用;注射CBS和CVP的小鼠淋巴细胞总数升高的同时CD3+和CD8+T细胞数量明显升高,提示CBS在促进T细胞增殖的同时对B淋巴细胞及单核细胞具有增殖作用;此外,评价机体免疫平衡的重要指标CD4+/CD8+T细胞数量比值一般在1~2之间,高剂量CBS能通过升高CD8+T细胞数量的同时降低CD4+T细胞数量,使免疫抑制小鼠CD4+/CD8+T细胞数量明显降低并接近正常值,表明了CBS可改善DXMS引起的机体细胞免疫功能紊乱,且效果优于CVP。
以上结果提示,CBS 能对DXMS引起的免疫低下小鼠细胞免疫功能有促进作用,通过重建和维系免疫功能,有望开发成新的恢复和改善免疫功能的有效调节剂,针对艾滋病、红斑狼疮等免疫系统破坏的疑难疾病,本药品可以通过重建和维持免疫功能,开发出有针对性获得恢复或改善免疫功能的有效药物,其作用机理有待进一步研究[14-16]。
CBS具有抑菌性和免疫调节功能,这两大功能与免疫性疾病产生机理对比分析,我们推测CBS可以用来对抗免疫性病毒,一方面它能够杀灭因病毒入侵人体而感染的各种病菌,同时它又能够重建和维持人体的免疫功能。进一步的研究如能大量获取CBS的有效成分,开发出有针对性获得恢复或改善免疫功能的有效药物,在人类对抗免疫性病毒的进程中将会提供有益的补充。
