外源硅对盐胁迫下棉花幼苗光合、荧光及抗氧化酶活性的影响
2019-08-15李笑佳张淑英
李笑佳,张 倩,张淑英
(石河子大学农学院,新疆石河子 832003)
0 引 言
【研究意义】棉花(GossypiumhirsutumL)是世界范围内重要的经济作物。我国是世界最大的棉花生产国,亦是最大的棉花消费国,而新疆是我国最大的产棉区,新疆主产棉区中棉花种植面积甚至占耕地面积的70%~80%。可见,棉花生产在新疆经济中占据非常重要的地位[1]。随着经济的快速发展,全球约有 1.0×109hm2的土地存在不同程度的盐渍化,且世界盐渍土地面积超过9×108hm2,占陆地面积的 7%[2-3],其中中国总面积超过3 600×104hm2,占现有耕地的1/4[4],而盐胁迫环境对作物生长发育会产生一系列不利影响,最终影响作物产量和品质的提高。【前人研究进展】近年来研究表明,盐胁迫会引起植物光合作用下降,气孔关闭,胞间CO2浓度(Ci)下降,叶绿素含量降低,严重影响植株的生长[5-6]。盐胁迫降低了棉花幼苗第一片真叶净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs),使Ci上升[7]。邢庆振等[8]对葡萄幼苗进行不同盐浓度处理发现,随胁迫时间的延长,葡萄幼苗Pn、Tr、Gs均降低,最大光化学效率(Fv/Fm)、潜在光化学效率(Fv/Fo)、最大量子产额(Yield)、光合电子传递速率(ETR)、光化学猝灭系数(qP)也同时下降,Ci先降后升,而非光化学猝灭系数(qN)则逐步上升。硅(Si)是地壳中第二大丰富元素,可提高多种植物对生物胁迫(病、虫害等)和非生物胁迫(干旱、重金属、冷害等)的抗性[9]。外源硅可提高盐胁迫下小麦幼苗叶绿素总量(Chla+b)、叶绿素a(Chla)和叶绿素b(Chlb)含量、Pn及Gs,而使Ci下降、气孔限制值(Ls)先升后降[10]。外源硅能提高盐胁迫下加工番茄的Pn和耐盐能力[11],缓解盐胁迫对柳枝稷叶片的伤害,改善叶绿素的构成,提高光合气体交换的能力[12]。郑世英等[13]研究表明,硅显著提高了黄瓜叶片抗氧化酶活性,与不施硅盐胁迫处理相比,超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性以及过氧化氢酶(CAT)活性均有所增加。另外,外源硅处理还可缓解盐胁迫对黄瓜幼苗光合器官结构和功能的伤害,促进黄瓜幼苗生长,有助于增强黄瓜对盐胁迫的抗性[14]。【本研究切入点】硅对盐胁迫下作物生长发育的影响已进行了研究(主要集中在硅积累量高的单子叶植物),但针对双子叶植物,尤其对硅能否提高棉花抗盐能力报道较少。研究外源硅对盐胁迫下棉花幼苗光合、叶绿素荧光参数及抗氧化酶活性的影响。【拟解决的关键问题】分析外源硅是否能提高棉花对盐胁迫的抗性。为外源硅提高棉花幼苗的抗盐机制提供理论依据,为新疆盐渍土壤地区棉花高产栽培提供可借鉴的苗期调控技术。
1 材料与方法
1.1 材 料
试验于2017年4月在石河子大学试验站温室内进行。供试棉花材料为新陆早45号,由石河子大学农学院提供;化学试剂:外源硅(K2SiO3分析纯),营养液预先配制母液,使用时稀释为所需浓度。
1.2 方 法
1.2.1 试验设计
供试棉花品种为新陆早45号。种子经消毒后在(25±1)℃的培养箱内催芽,将发芽一致的种子播种于装有蛭石的营养钵中育苗,每钵留苗2株。试验在温室内采用盆栽试验的方法,从棉花播种至出苗60 d左右(以棉花苗期为主要研究阶段)。试验设2个因素,分别为硅(K2SiO3分析纯,0、262.3 mg/L)、盐分(0、100、200 mmol/L),共6个处理,用总氮水平为5 mmol/L的营养液进行培养,各处理设置3次重复,每重复24个营养钵于一培养箱中。营养液于每日18:00以叶面喷施的方式喷施一次,每处理约1 000 mL,对应硅和盐分在使用时直接溶于营养液中,出苗12 d后进行盐分处理,18 d后进行抗盐硅处理。营养液中大量元素配方采用略加修改的Hoagland营养液,微量元素参照Hammer et al.(Hammer P Aetal., 1989)的方法配制。出苗60 d左右取棉苗倒三、倒四叶样品测定各指标。表1
表1 试验处理和编号
Table 1 Treatment and serial number of experiment
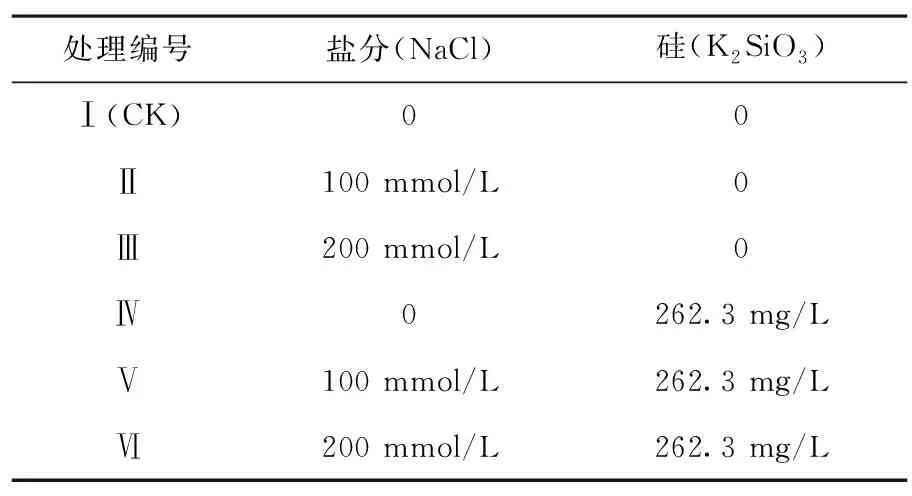
处理编号盐分(NaCl)硅(K2SiO3)Ⅰ(CK)00Ⅱ100 mmol/L0Ⅲ200 mmol/L0Ⅳ0262.3 mg/LⅤ100 mmol/L262.3 mg/LⅥ200 mmol/L262.3 mg/L
1.2.2 测定项目
叶绿素含量采用丙酮-乙醇混合法[15]测定;运用CIRAS-3便携式植物光合作用测定仪(美国)测定各处理棉花幼苗叶片的Pn、Tr、Gs、Ci;使用Imagine-PAM调制荧光仪(德国Walz公司)测定叶绿素荧光参数光化学猝灭系数(qP)、非光化学猝灭系数[NPQ(qN)]、PSⅡ调节性能量耗散的量子产额[Y(NPQ)]、PSⅡ非调节性能量耗散的量子产额[Y(NO)];SOD活性采用氮蓝四唑法[16]测定,POD活性采用愈创木酚比色法[17]测定,CAT活性采用分光光度计法[18]测定,每次测定均重复4次。
1.3 数据处理
数据分析用Microsoft Excel 2010软件,采用SPSS19.0软件进行方差分析和差异显著性检验(Duncan法),使用Sigmaplot 1软件绘图。
2 结果与分析
2.1 外源硅对盐胁迫下棉花幼苗光合色素含量的影响
研究表明,无外源硅处理(处理Ⅰ、Ⅱ、Ⅲ)条件下,棉花幼苗Chla含量随着盐浓度增大逐渐减少,处理Ⅱ、Ⅲ分别比CK(处理Ⅰ)降低了32.64%、40.02%。棉苗Chlb、Chla+b及类胡萝卜素含量与Chla含量变化保持一致。与CK相比,处理Ⅲ棉花幼苗Chlb、Chla+b及类胡萝卜素含量分别减少了45.31%、41.58%和63.61%。相同盐浓度条件下,加硅处理(处理Ⅳ、Ⅴ、Ⅵ)比对应盐浓度不加硅处理(处理Ⅰ、Ⅱ、Ⅲ)棉花幼苗光合色素(Chla、Chlb、Chla+b及类胡萝卜素)含量均呈上升趋势,如处理Ⅴ棉苗Chla、Chlb、Chla+b及类胡萝卜素含量分别比处理Ⅱ升高了35.32%、24.93%、32.18%和6.66%;处理Ⅵ棉苗Chla、Chlb、Chla+b及类胡萝卜素含量分别比处理Ⅲ升高了19.23%、26.31%、21.17%和55.96%。方差分析表明,盐胁迫下棉花幼苗光合色素(Chla、Chlb、Chla+b及类胡萝卜素)含量均随着盐浓度增加显著减少(P<0.01);而硅和盐胁迫交互作用下,光合色素含量各处理间差异显著(P<0.01)。硅可延缓盐胁迫对棉花幼苗光合色素生物合成的抑制作用。图1
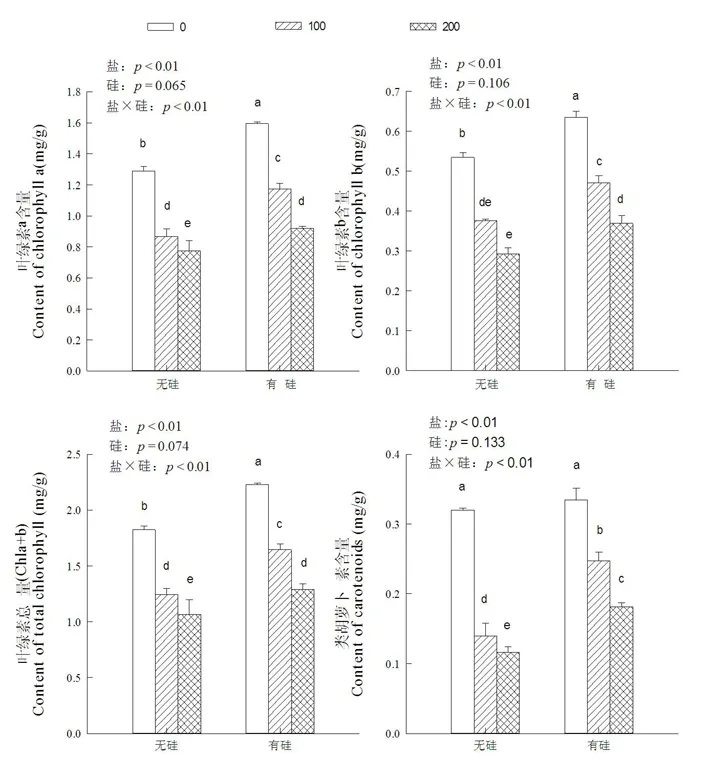
注:不同小写字母表示盐硅互作处理间差异达5%显著水平(P<0.05),下同
Note:Different lowercase letters means significant difference among different salt-silicon interaction treatments at 0.05 level , the same as below
图1 外源硅对盐胁迫下棉花幼苗光合色素含量变化
Fig. 1 Effects of exogenous silicon on the content of photosynthetic pigments in cotton seedlings under salt stress
2.2 外源硅对盐胁迫下棉花幼苗光合气体交换参数的影响
研究表明,仅有盐胁迫处理(处理Ⅰ、Ⅱ、Ⅲ)条件下,棉花幼苗Pn随盐浓度增大显著减少(P<0.01),处理Ⅱ、Ⅲ棉苗Pn分别比CK降低了37.86%、62.14%。同样,棉苗Tr、Gs、Ci与CK相比,处理Ⅱ棉花幼苗Tr、Gs、Ci分别减少了24.83%、38.43%、21.68%,盐分处理棉苗Tr、Gs、Ci与CK间差异显著(P<0.01)。但相同盐浓度条件下,添加外源硅(处理Ⅳ、Ⅴ、Ⅵ)比相应盐浓度无硅(处理Ⅰ、Ⅱ、Ⅲ)棉苗Pn、Tr、Gs和Ci均呈上升趋势,如处理Ⅴ棉苗Pn、Tr、Gs、Ci分别比处理Ⅱ升高了62.50%、113.50%、29.70%和56.53%。硅和盐分胁迫交互作用方差分析表明,棉花幼苗Pn、Tr、Gs和Ci各处理间差异显著(P<0.01)。图2
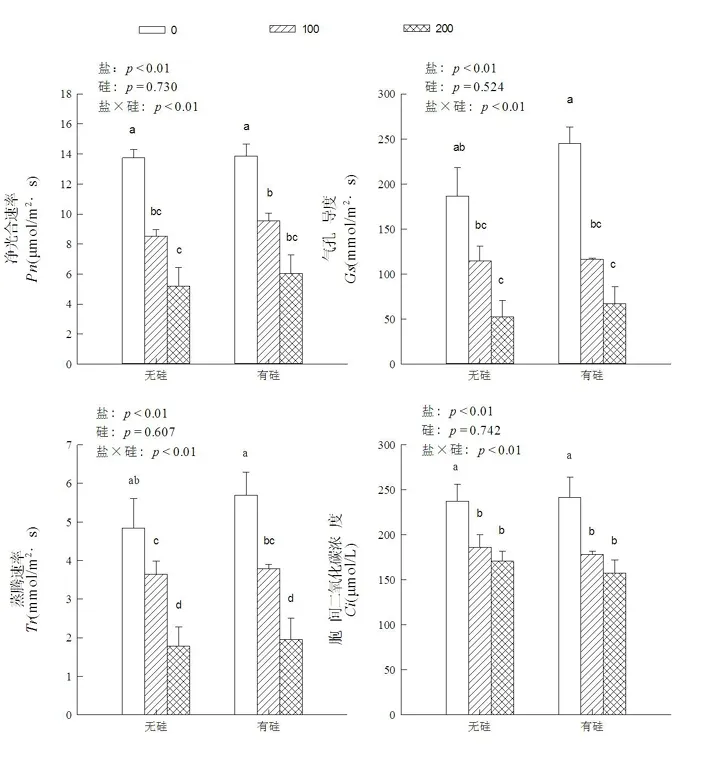
图2 外源硅对盐胁迫下棉花幼苗光合气体交换参数变化
Fig. 2 Effects of exogenous silicon on the photosynthetic parameters of cotton seedlings under salt stress
2.3 外源硅对盐胁迫下棉花幼苗叶绿素荧光参数的影响
研究表明,盐胁迫处理(处理Ⅱ、Ⅲ)降低了棉花幼苗叶绿素荧光参数[qP、qN、Y(NPQ)和Y(NO) ]值,且盐浓度越大,其值越低,如处理Ⅱ棉苗qP、qN、Y(NPQ)和Y(NO) 与CK相比分别减少了4.85%、36.68%、14.29%和35.62%。而相同盐胁迫条件下,外源硅(处理Ⅳ、Ⅴ、Ⅵ)比对应盐浓度无硅处理(处理Ⅰ、Ⅱ、Ⅲ)棉苗qP、qN、Y(NPQ)和Y(NO)均明显增加,如处理Ⅴ棉苗qP、qN、Y(NPQ)和Y(NO)分别比处理Ⅱ升高了9.25%、61.15%、58.02%和41.88%。方差分析表明,盐胁迫导致棉苗qP、Y(NO) 显著降低(P<0.05);但盐分与硅交互作用,各处理与CK间并未达到显著水平,说明盐胁迫对棉花幼苗叶绿素荧光有负效应,但外源硅对缓解盐胁迫抑制效应并不显著。表2
表2 外源硅对盐胁迫下棉花幼苗叶绿素荧光参数变化
Table 2 Effects of exogenous silicon on the chlorophyll fluorescence parameters of cotton seedlings under salt stress
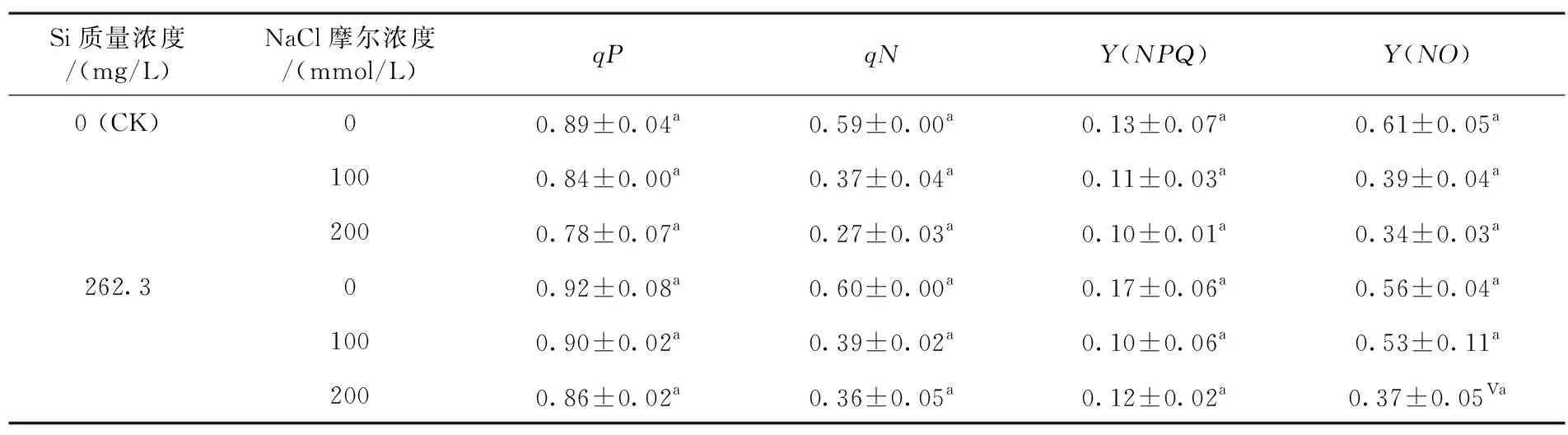
Si质量浓度/(mg/L)NaCl摩尔浓度/(mmol/L)qPqNY(NPQ)Y(NO)0 (CK)00.89±0.04a0.59±0.00a0.13±0.07a0.61±0.05a1000.84±0.00a0.37±0.04a0.11±0.03a0.39±0.04a2000.78±0.07a0.27±0.03a0.10±0.01a0.34±0.03a262.300.92±0.08a0.60±0.00a0.17±0.06a0.56±0.04a1000.90±0.02a0.39±0.02a0.10±0.06a0.53±0.11a2000.86±0.02a0.36±0.05a0.12±0.02a0.37±0.05Va
注:不同小写字母表示处理间差异达5%显著水平(P<0.05),下同
Note: Different lowercase letters means significant difference among different treatments at the 5% level,the same as below
2.4 外源硅对盐胁迫下棉花幼苗抗氧化酶活性的影响
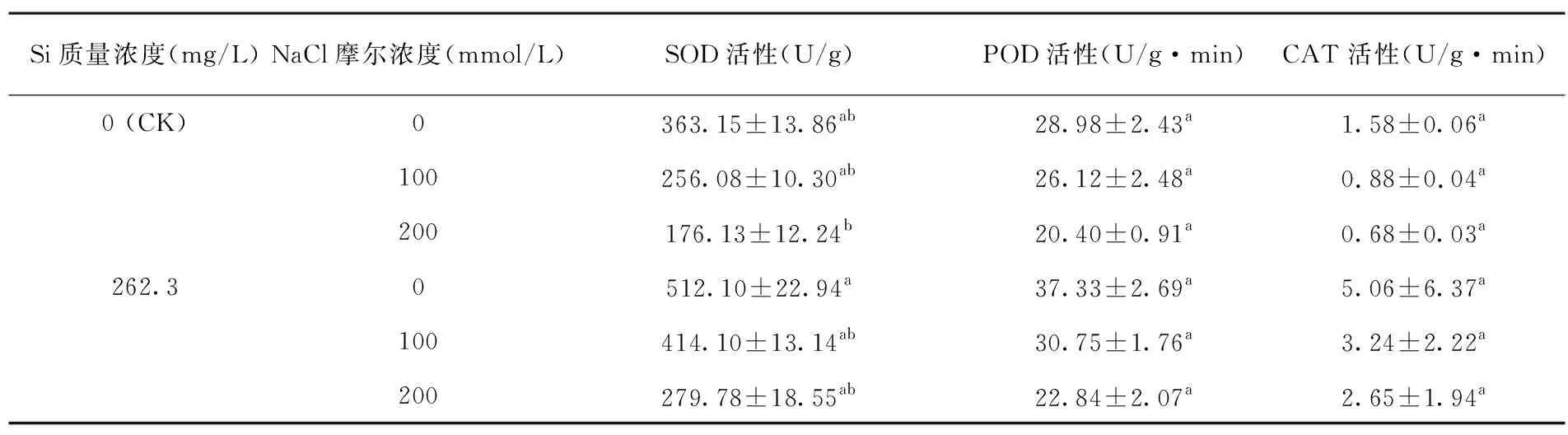
研究表明,无外源硅处理(处理Ⅰ、Ⅱ、Ⅲ)间比较,随盐浓度增大,棉花幼苗SOD、POD、CAT活性逐渐减弱,如处理Ⅱ、Ⅲ棉苗SOD活性分别比CK降低了29.4%和51.5%;POD活性分别降低了9.9%和29.6%;CAT活性分别降低了44.3%和60.0%。与无外源硅处理相比,外源硅处理(处理Ⅳ、Ⅴ、Ⅵ)棉苗SOD活性比对应盐浓度无硅处理(处理Ⅰ、Ⅱ、Ⅲ)增强,如处理Ⅴ棉苗SOD活性比处理Ⅱ增强了61.7%;处理Ⅵ棉苗SOD活性比处理Ⅲ增强了37.0%。同样,盐胁迫下施用外源硅处理也增强了POD、CAT的活性。方差分析表明,盐胁迫导致棉花幼苗SOD活性显著下降(P<0.05);硅与盐互作条件下,相应盐浓度施硅比不施硅棉花幼苗叶片SOD活性均显著增加(P<0.05),POD与CAT活性也均有所增加,但差异不显著(P>0.05)。说明外源施硅在一定程度上能缓解盐分胁迫对棉花幼苗抗氧化酶活性的抑制作用,并促进其活性的增长。表3
表3 盐胁迫下外源硅对棉花幼苗抗氧酶活性变化
Table 3 Effects of exogenous silicon on activities of antioxidant enzymes in cotton seedlings under salt stress
Si质量浓度(mg/L)NaCl摩尔浓度(mmol/L)SOD活性(U/g)POD活性(U/g·min)CAT活性(U/g·min)0 (CK)0363.15±13.86ab28.98±2.43a1.58±0.06a100256.08±10.30ab26.12±2.48a0.88±0.04a200176.13±12.24b20.40±0.91a0.68±0.03a262.30512.10±22.94a37.33±2.69a5.06±6.37a100414.10±13.14ab30.75±1.76a3.24±2.22a200279.78±18.55ab22.84±2.07a2.65±1.94a
3 讨 论
3.1 外源硅对盐胁迫下棉花幼苗光合色素含量的影响
盐胁迫对植物光合作用影响最显著,而叶片光合色素含量的高低是影响光合作用能力的最重要因素之一[12]。王立红等[19]研究表明,盐胁迫降低了棉花幼苗Chla、Chlb和Chla+b含量。陈罡等[14]对黄瓜研究发现,外源硅处理明显抑制盐胁迫下黄瓜幼苗Chla、Chlb和Chla+b含量降低。试验在单一盐分处理下棉花幼苗Chla、Chlb、Chla+b和类胡萝卜素含量均随盐浓度的升高而降低,可能因为盐胁迫增强了植株体内叶绿素氧化酶活性,加速了光合色素降解[20-21]。相同盐浓度条件下,外源硅处理棉苗光合色素含量比对应盐浓度不加硅处理明显升高,这与陈罡等[14]的研究结果一致,表明外源硅确实提高了盐胁迫下棉花幼苗光合色素含量。
3.2 外源硅对盐胁迫下棉花幼苗光合气体交换参数的影响
盐胁迫对植物光合作用的抑制,常表现在盐胁迫下植物叶片失水,继而引起气孔关闭,导致光合反应降低,从而影响CO2同化[22]。王立红等[23]对盐胁迫下棉花光合作用研究显示,盐胁迫降低了棉花幼苗Pn、Gs和Ci的含量;李菁等[12]研究发现,外源硅可缓解盐胁迫下小麦幼苗Pn、Gs和Ci的降低。研究结果表明,单一盐处理条件下,棉花幼苗Pn、Tr、Gs和Ci均随盐浓度升高而逐渐下降,说明盐胁迫造成Pn下降,其主要原因可能是气孔因素[22],这与Farquhar等[24]的说法一致,而与陈罡等[14]的研究结果不同,其可能原因是不同种类植物对盐胁迫应激反应不同而导致的差异。试验施加外源硅比相应盐浓度未施硅处理棉花幼苗Pn、Tr、Gs和Ci均明显升高,这与李菁等[12]研究结果相一致,说明外源硅提高盐胁迫下棉花幼苗光合速率主要涉及气孔因素调节。
3.3 外源硅对盐胁迫下棉花幼苗叶绿素荧光参数的影响
qP反映PSII吸收光能用于光化学电子传递的份额。qP愈大,即PSII电子传递活性愈大[25]。吴雪霞等[26]研究表明,盐胁迫降低了茄子幼苗qP、qN值且随盐浓度升高而逐渐降低。试验结果表明,棉花幼苗qP、qN、Y(NPQ)、Y(NO)随盐浓度升高而降低,盐胁迫降低了棉花幼苗叶片的光能利用效率,这与吴雪霞等[26]研究结果一致,但郑州元等[27]研究结果显示,随盐胁迫时间延长,NPQ显著增加,NO无明显变化,其原因可能是供试材料不同导致的差异。试验外源硅处理提高了棉花幼苗qN、qN、NPQ、NO值,说明外源硅能有效缓解盐胁迫诱导的生长抑制,增强了棉苗光能利用率,并及时耗散掉过剩光能,改善PSII光化学活性,有利于光合作用顺利进行。
3.4 外源硅对盐胁迫下棉花幼苗抗氧化酶活性的影响
在植物系统进化过程中,植物细胞为保护自身免受活性氧伤害形成了清除活性氧的抗氧化保护酶系统,如SOD、POD、CAT等。抗氧化酶通过清除活性氧自由基,防止其过度积累,减轻或避免活性氧对膜脂的伤害[28],维持活性氧自由基产生与清除系统的平衡[29]。李付广等[30]的研究结果显示,盐胁迫下棉花幼苗子叶部位的SOD、POD活性均下降,研究结果显示,在盐胁迫下,SOD、POD活性随盐浓度的升高明显降低,对植物的保护机能受到抑制,这与李付广等[31]的研究结果一致。棉苗CAT活性同样随盐浓度的升高而下降,这与孙小芳等[32]的研究相一致,可能是由于盐胁迫降低了储藏物质分解和转化速率,也造成活性氧产生和清除系统动态平衡的破坏,启动膜脂过氧化或脱脂作用,损伤膜脂和膜蛋白,从而破坏膜结构[33]。在施加外源硅条件下,与对应盐浓度无硅处理相比,外源硅的加入均使棉苗SOD、POD、CAT活性增加,说明施用外源硅增强了抗氧化酶活性,进一步增强植株清除活性氧能力,维持活性氧产生与消除动态平衡,缓解盐胁迫造成的储藏物质分解和转化速率的降低,同时抑制盐胁迫对膜脂和膜蛋白造成的损伤与对膜结构的破坏,从而起到保护光合作用机构的作用,为提高棉花幼苗的耐盐性奠定了生理基础。不同棉花品种抗盐性不同,同一品种不同生育期抗盐性也不相同,外源施硅对不同品种及棉花不同生育期的影响还有待于进一步的探究。
4 讨 论
外源硅可缓解盐胁迫下棉花幼苗光合色素含量、光合气体交换参数、叶绿素荧光参数及抗氧化酶(SOD、POD、CAT)活性的降低。植物耐盐性的产生是一个相当复杂的过程[29],棉花虽然是耐盐性较强作物,但在幼苗期对盐分还是相当敏感的,因此,对棉花苗期盐害的管理和治理尤为重要。基于研究结果推测,外源硅可提高盐胁迫下棉花幼苗的光合色素含量、光合速率以及光能利用率,增强植株清除活性氧能力,维持活性氧产生与消除动态平衡,保护光合机构,进而提高棉苗抗盐性,促进棉苗生长发育。
