巨细胞病毒肝损伤患儿外周血IL-17、IL-35与Th17/Treg的检测及其临床意义
2019-08-14郁晶晶卜妙然孟令建叶黎离王军
郁晶晶,卜妙然,孟令建,叶黎离,王军
(徐州医科大学附属医院儿科,江苏徐州221002)
人巨细胞病毒(human cytomegalovirus,HCMV)是先天性病毒感染最常见的病原体之一,新生儿及小婴儿属于免疫功能低下的群体,故容易感染HCMV。HCMV常引起多系统播散性疾病或单一组织、器官损害。HCMV肝损伤多见于婴幼儿期原发感染者,是由遗传、免疫和环境等多种原因所致,临床上通常表现为黄疸、肝脾肿大、肝功能异常[1]。
目前,HCMV发病机制尚不十分清楚,可能与机体免疫应答有关。既往研究显示,HCMV感染是多种细胞因子及细胞参与的慢性感染,病毒与机体间相互作用导致机体免疫功能紊乱,而CD4+T细胞在此复杂的免疫应答过程中发挥着重要的效应。产生IL-17A的CD4+T细胞(helper T cells 17,Th17)和CD4+CD25+调节性T细胞(CD4+CD25+regulatory T cells,Treg)的发现打破传统的Th1/Th2细胞效应模式[2]。IL-35是一种新发现的抗炎因子,是Treg细胞发挥免疫抑制作用的重要成分。IL-35与Treg细胞、Th17细胞及IL-17等免疫调节功能密切相关,通过多种途径参与HCMV的发病与调节过程。
关于HCMV肝损后机体IL-17、IL-35和Th17/Treg水平变化及其临床作用国内报道较少。本实验通过检测HCMV肝损伤组、非肝损组与健康对照婴儿外周血Th17细胞和Treg细胞比例及相关细胞因子,探讨其在疾病发生、发展中的作用,为HCMV肝损伤的临床治疗探索新的方向。
1 资料与方法
1.1 研究对象
选取2018年1月至10月在本院儿科诊断为HCMV感染伴肝损伤的20例患儿为肝损伤组,诊断标准参照2012年中华医学会儿科学分会感染消化学组制定的《巨细胞病毒感染诊断方案》[1],经PCR-DNA定量检测尿液确诊为HCMV病毒感染,均为初发未经抗病毒及免疫抑制剂治疗病例,临床主要以黄疸、肝功能异常就诊。患儿年龄52~337 d,平均(179±64)d,男 12例、女 8例;其中,5例表现为单纯肝功能损害,9例为单纯黄疸,2例为黄疸合并肝功能损害,4例肝功能损害合并肝大。
另外选取同期在年龄、性别分布无统计学差异的38例门诊体检婴儿,其中存在HCMV感染但无肝损者18例作为非肝损组,20例体检正常婴儿且排除HCMV感染者为对照组。3组的年龄、性别构成间的差异无统计学意义(P>0.05,表1)。所有入选者均排除胆道闭锁、消化道畸形、其他类型病毒性肝炎(如甲、乙、丙肝炎病毒、EB病毒、风疹病毒、单纯疱疹病毒等感染所致的肝炎)、遗传代谢性疾病、药物性肝炎等。
受试婴儿家长均签署知情同意书,本研究通过医院学术伦理委员会批准。
1.2 主要试剂与仪器
CD4-BB515抗体、APC-CD25抗体、PE-Foxp3抗体、IL-17A-PE抗体、白细胞激活剂组合、Transcription Factor Buffer Set购自上海优宁维生物科技股份有限公司;人IL-17、IL-35 ELISA试剂盒购自徐州康美生物科技有限公司;全自动生化仪与免疫分析仪由我院检验科提供;BD FACSCantoTMⅡ流式细胞仪(美国BD公司)。
1.3 ELISA法检测各组血清IL-17、IL-35浓度
采用EDTA抗凝管抽取实验对象外周血2 mL,3 000 r/min离心10 min,留取血清标本分装于EP管中,部分置-80℃冰箱冻存。按ELISA试剂盒说明书检测IL-17和IL-35浓度。
1.4 血浆转氨酶、尿HCMV-DNA载量检测
上述EP管中部分血清采用全自动生化仪测定丙氨酸转氨酶(ALT)水平;留取测试者3次混合尿液,由我院中心实验室采用荧光免疫PCR法检测尿HCMV-DNA载量。
1.5 流式细胞术检测Treg细胞和Th17细胞比例
将上述剩余血标本用等量PBS液稀释后,加入淋巴细胞分离液1 500 r/min离心20 min,弃上清液,取外周血单核细胞(PBMC)与2μL白细胞刺激剂至24孔板,培养基吹匀细胞后,置于培养箱孵育4 h(37℃、5%CO2),取出离心,弃上清液,将管内剩余物标记,加入50μL PBS,用微量加样仪混匀吹打管内细胞,分别取2μL荧光标记抗体(CD4-BB515抗体、APC-CD25)加入标记为Treg管及Treg对照管,震荡混匀后室温避光孵育30 min;取1 mL PBS加入标记为Th17管及Th17对照管内,1 500 r/min离心5 min,弃上清液,加200μL甲醛于Th17对照管内重悬,置4℃冰箱避光保存;Th17管中加1 mL细胞固定液重悬,室温避光孵育40 min后,用Wash破膜剂固定,1 500 r/min离心5 min,弃上清液,用1 mL缓冲液洗涤细胞2次;上述4组试管分别加入50μLWash破膜剂,将2μL PE标记的IL-17 A抗体及2μL PE-Foxp3抗体置于相应实验试管,同型对照管加入同型对照抗体进行染色,避光孵育50 min;各试管内加1 mL缓冲液洗涤后1 500 r/min离心5 min,弃上清液,采用流式细胞仪检测Treg细胞、Th17细胞比例,设同型对照用于校正补偿。
1.6 统计学分析
采用SPSS 16.0统计学软件分析数据,符合正态分布的计量资料用均数±标准差(±s)表示,非正态分布资料采用中位数表示,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验,采用Pearson法对各项参数进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 ALT和尿HCMV-DNA定量
肝损伤组患儿外周血ALT明显高于非肝损组和对照组(P均<0.05),非肝损组和对照组间无明显差别(P>0.05)。荧光免疫PCR法检测结果显示,肝损组与非肝损组间HCMV-DNA含量的差异无统计学意义(P>0.05)。

表1 3组婴儿丙氨酸转氨酶和尿HCMV-DNA定量比较
2.2 外周血Th17细胞比例、Treg细胞比例及相关细胞因子浓度
与对照组比较,肝损伤组、非肝损组血清Th17细胞比例、IL-17浓度均明显增高,肝损伤组这两项指标又显著高于非肝损组(P均<0.01);肝损伤组、非肝损组外周血Treg细胞比例和IL-35浓度均明显低于对照组,且肝损伤组又显著低于非肝损组(P均<0.01)。肝损伤组Th17/Treg明显高于非肝损组和正常对照组,差异有统计学意义(P均<0.01)。见表2和图1。
表2 各组婴儿外周血Th17、Treg细胞比例及相关细胞因子浓度比较±s
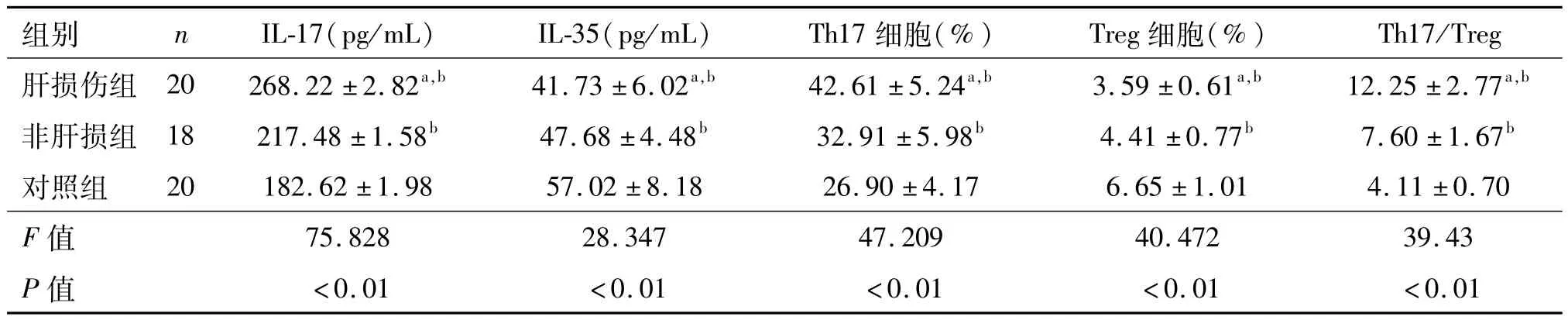
表2 各组婴儿外周血Th17、Treg细胞比例及相关细胞因子浓度比较±s
a:P<0.05,与非肝损伤组比较;b:P<0.05,与对照组比较
组别 n IL-17(pg/mL) IL-35(pg/mL) Th17细胞(%) Treg细胞(%)Th17/Treg肝损伤组 20 268.22±2.82a,b 41.73±6.02a,b 42.61±5.24a,b 3.59±0.61a,b 12.25±2.77a,b 75.828 28.347 47.209 40.472 39.43 P值非肝损组 18 217.48±1.58b 47.68±4.48b 32.91±5.98b 4.41±0.77b 7.60±1.67b对照组 20 182.62±1.98 57.02±8.18 26.90±4.17 6.65±1.01 4.11±0.70 F值<0.01 <0.01 <0.01 <0.01 <0.01
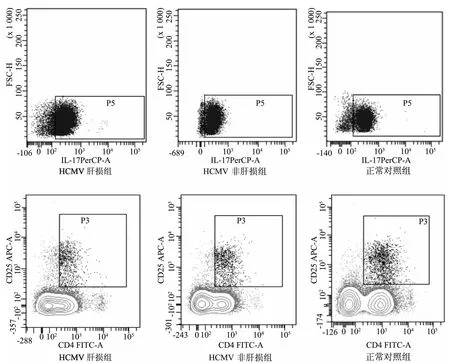
图1 流式细胞术检测外周血Th17细胞和CD4+CD25+T细胞比例
2.3 相关性分析
外周血Treg细胞比例与IL-35浓度呈显著正相关(r=0.620,P<0.05);外周血 Th17细胞比例与血清 IL-17浓度呈显著正相关(r=0.830,P<0.05)。
3 讨论
肝脏是人体的重要靶器官,容易受外界环境、机体内部免疫紊乱的影响而发生病变。HCMV侵犯肝胆管上皮细胞、内皮细胞后,经抗原提呈和白细胞黏附作用,促使多种细胞参与机体免疫炎症反应,进而加重肝脏损害[3-4]。
Th17细胞是近年来新发现的一种辅助细胞,维甲酸相关孤儿受体 ROR-γt是其主要转录因子。Th17细胞主要由胸腺合成,部分为TGF-β和IL-6诱导T细胞前体分化而成。Th17细胞通过分泌IL-17、IL-22及IL-23等效应因子参与炎症反应、防御胞外病原菌感染[5]。IL-17主要启动T细胞诱导的早期炎症反应,参与免疫调节并发挥较强的炎症介导功能[6]。研究表明,IL-17R是同源信号I型跨膜蛋白质受体,与IL-17结合后可促使产生IL-8和GRO-α,激活MAP激酶磷酸化等多种下游途径[7],同时招募大量的炎症细胞,促进T细胞的激活。HCMV可激发相关细胞产生细胞因子,募集、活化中性粒细胞,同时刺激Th17细胞分泌IL-17,参与肝脏炎症反应[8-9]。Yasumi等[10]曾提出 IL-17可作为肝脏急性损伤的标志。本实验中,ELISA检测结果显示HCMV肝损患儿外周血中IL-17浓度显著高于另外两组,与孙晓红等[3]的研究结果一致。因此我们认为IL-17可作为衡量HCMV肝损患儿的重要指标。
Treg细胞是机体负向免疫调节应答的重要细胞亚群,在病毒感染过程中通过产生高浓度IL-10和TCF-β等细胞因子,抑制T淋巴细胞及NK等细胞的增殖分化。IL-35是一种新型的抗炎细胞因子,2007年 Niedbala等[11]以及 Collison等[12]的小鼠体内实验初步显示,IL-35主要由Treg细胞分泌。IL-35一方面刺激Treg细胞增殖,另一方面诱导T细胞转化为具有更强抑制活性的调节性T细胞[13],构成机体强大的免疫调控网络。
既往研究显示IL-35在骨髓增生异常综合征、乳腺癌、心血管等疾病中发挥重要作用。万雪媛等[14]在小鼠模型实验中提出,在MCMV感染急性期IL-35可抑制炎症反应,而在急性感染所致的持续病理损伤过程中发挥着重要保护作用。本实验结果显示,HCMV感染肝损伤患儿Treg细胞比例与IL-35浓度明显下降。因此,我们猜测Treg细胞、IL-35可能在HCMV感染中发挥重要免疫保护作用。
本研究显示,HCMV肝损患儿Treg细胞比例较对照组下降,Th17/Treg平衡被打破,IL-17促进炎症的发生发展,并在肝脏代谢中产生重要反应,从而形成恶性循环,最终导致机体免疫系统紊乱。Th17细胞与Treg细胞都来源于CD4+T细胞,既往研究证实Treg细胞在高浓度IL-6的刺激下可转化成Th17细胞;另外,Treg细胞的特异性转录因子Foxp3与ROR-γt结合,可抑制IL-17 RNA的转录,从而影响Th17细胞的功能[15]。所以,Treg细胞与Th17细胞在分化及免疫应答方面存在相互拮抗作用。Th17细胞主要参与肝脏炎症反应,而Treg细胞主要在慢性病毒感染中表达。有人提出,当出现重型肝炎时,机体Th17细胞及其分泌的IL-17浓度可显著增加,参与炎症反应致肝脏损伤;相应地Treg细胞分化增强,下调免疫反应从而避免肝脏过度损伤[16];所以,Th17、Treg细胞在维持免疫内环境稳定中发挥重要作用。IL-35能促进IFN-γ合成,并抑制Th17细胞增殖分化,减少IL-17的分泌,从而抑制机体过度的免疫损伤[17]。
综上所述,在巨细胞病毒肝损伤的发生发展过程中,存在多种细胞及细胞因子的参与。以IL-17为主的促炎因子和IL-35为主的抗炎介质引发一系列免疫反应,Th17/Treg的平衡在维持机体免疫内环境稳定中起着重要作用。IL-35是一种具有潜在治疗前景的新型调节因子,能否通过提高IL-35浓度来抑制炎症反应有待探讨;相信随着对IL-35与HCMV关系的深入了解,IL-35在慢性病毒感染中将展现临床应用前景。
