荷瘤小鼠MDSCs中TRIM25和PTEN的表达
2019-08-14宋格赵耀陆薇王胜军
宋格,赵耀,陆薇,王胜军
(江苏大学医学院检验医学研究所,江苏镇江212013)
髓源抑制性细胞(myeloid-derived suppressor cells,MDSCs)是一群骨髓来源的、未成熟的异质性细胞。在正常生理条件下,骨髓中的未成熟髓样细胞(immaturemyeloid cells,IMC)分化为成熟的粒细胞、树突状细胞或巨噬细胞。然而,在炎症、创伤、肿瘤等病理条件下,IMC分化为成熟髓系细胞受到阻碍,停留于不同分化阶段的IMC在体内大量聚集。随后,在肿瘤细胞或炎性细胞分泌的细胞因子的诱导下,IMC分化为具有免疫抑制活性的MDSCs[1]。MDSCs在肿瘤免疫应答中起负向调控作用,有利于肿瘤的发生和发展[2]。已有研究表明,荷瘤小鼠肿瘤来源MDSCs比脾脏来源MDSCs分化成熟度更低、免疫抑制功能更强[3]。
三基序蛋白 25(tripartite motif containing 25,TRIM25)是TRIM家族的成员,具有E3泛素连接酶的功能。作为E3泛素连接酶,TRIM25可催化多种靶蛋白PTEN、p53、RIG-I等发生多聚泛素化修饰,激活一系列信号通路进而调控生物功能[4-6]。它通过泛素化或类泛素化调控细胞活动,在多种癌症中发挥癌基因的作用[7-9]。研究报道TRIM25异常高表达于肺癌、结肠癌、胃癌和乳腺癌等多种癌症[10-13]。TRIM25对免疫系统及免疫细胞都有着重要的调控作用[14],但 TRIM25是否参与调控 MDSCs,目前尚未有相关文献报道。
PTEN基因编码的蛋白具有蛋白磷酸酶和脂质磷酸酶双特异磷酸酶活性,是第一个具有磷酸酶活性的抑癌基因[15]。PTEN基因缺陷在人类多种肿瘤中广泛存在。PTEN通过抑制PI3K/AKT和STAT3信号通路调控MDSCs的免疫抑制功能[16-18]。鉴于E3泛素连接酶TRIM25能够催化PTEN的泛素化修饰,且PTEN在调节MDSCs的扩增、活化和功能中发挥重要作用,本研究中我们联合检测TRIM25和PTEN在肿瘤来源MDSCs中的表达情况,有助于探讨MDSCs的调节机制,寻找肿瘤免疫治疗的新靶点。
1 材料与方法
1.1 主要材料
实验动物和细胞株:小鼠CT26结肠癌细胞株购自上海生命科学研究院细胞库。雌性、6~8周龄、体重(20±2)g的SPF级BALB/C小鼠购自江苏大学实验动物中心(合格证编号:NO.201803506)。
主要试剂:DMEM培养基、RPMI 1640培养基和胎牛血清(美国 Gibco公司);胰酶、Ⅰ型胶原酶、DNA酶、透明质酸酶(Sigma公司);小鼠MDSCs分离试剂盒(Miltenyi Biotec公司);生物素标记的抗小鼠/人CD11b抗体(Biolegend公司);PE/Cy5标记的大鼠抗小鼠/人CD11b单克隆抗体(BioLegend公司);PE标记的大鼠抗小鼠Gr1单克隆抗体(BD Pharmingen公司);Trizol试剂(Invitrogen公司);反转录试剂盒、荧光定量试剂盒(Takara公司);DL500 DNA分子量标准(Takara公司)。
1.2 构建小鼠CT26结肠癌移植瘤模型
用含10%小牛血清的DMEM培养基培养小鼠CT26肿瘤细胞,放置于37℃、5%CO2细胞培养箱中,细胞呈贴壁生长。待肿瘤细胞生长至对数期,用胰酶消化计数后备用。接种时,将小鼠置于超净台中,用酒精棉球消毒小鼠背部右侧皮肤,每只小鼠皮下注射约1×106个肿瘤细胞/200μL PBS。待小鼠注射部位触摸到质地较硬、可移动的黄豆大小的皮下结节时,即为移植瘤模型构建成功。
1.3 小鼠脾细胞悬液、肿瘤组织细胞悬液的制备
脾细胞悬液的制备:脱颈处死野生型小鼠,无菌取出小鼠脾脏,置筛网研磨,将细胞悬液移至离心管;4℃、500×g离心5 min后弃上清,加5 mL ACK裂解红细胞,5 min后加5 mL PBE缓冲液终止裂解,再次4℃、500×g离心5 min,弃去上清,留沉淀加PBE缓冲液重悬即可获得脾细胞悬液。
肿瘤组织细胞悬液的制备:接种肿瘤细胞后第28天处死荷瘤小鼠,眼球放血,脱颈处死。无菌剥离荷瘤小鼠的肿瘤组织,将肿瘤组织剪碎后放入50 mL Corning管,用适量的胶原酶消化(每0.25 g肿瘤组织加10 ml胶原酶),37℃水浴箱中消化1.5~2 h,每隔5 min颠倒混匀Corning管;消化结束用筛网过滤,收集滤液;4℃、500×g离心5 min后弃上清液,PBE缓冲液重悬细胞沉淀即获得肿瘤组织细胞悬液。
1.4 小鼠脾脏来源MDSCs的分离纯化
磁珠分选脾脏MDSCs:用300μL PBE缓冲液重悬脾细胞沉淀,加30μL FcR Blocking封闭液,冰上孵育 10 min;加入抗 CD11b Biotion(10μL/108细胞),冰上孵育30 min,10 min混匀一次;加入10mL PBE洗涤,4℃、500×g离心5 min后弃上清液,用300μL PBE重悬细胞沉淀,加 anti-Biotion Microbeads(15μL/108细胞),弹匀后冰上孵育30 min,每隔10 min弹匀一次;加10 mL PBE洗涤,再次离心弃上清,用500μL PBE重悬细胞沉淀。在磁性分离架上安装好LS分离柱,用3 mL PBE润柱后,再向LS分离柱中加入500μL细胞悬液,然后每次用3 mL PBE洗涤分离柱,共洗3次。待悬液滴尽后,取下LS分离柱置于无菌的10 mL离心管上,向柱中加入5 mL PBE,快速推动柱推使细胞流入离心管中,重复操作1次,即可获得10 mL MDSCs细胞悬液。
1.5 流式细胞术分选肿瘤组织来源MDSCs
取制备好的小鼠肿瘤组织细胞悬液,计数,在EP管中用PBS重悬,按照0.25μg/106细胞分别加入 anti-Gr1-PE和anti-CD11b-PE/Cy5,置于4℃冰箱避光孵育30min;加1mL PBS终止染色,4℃、500×g离心5 min后弃上清,用含1%FBS的RPMI1640培养基重悬细胞,流式细胞仪分选获得CD11b+Gr1+MDSCs。
1.6 RNA提取及反转录
将保存于-80℃冰箱中Trizol裂解的样本取出,放置冰上融化;加入200μL三氯甲烷/1 mL Trizol,剧烈震荡20 s,室温静置10 min;4℃、12 000×g离心15 min;从离心机平稳地取出样本,轻柔地吸取300~400μL上层水相于新的EP管中;加入500μL异丙醇,混匀,室温静置15 min;4℃、12 000×g离心10 min;管底可见白色沉淀,小心弃去上清,加入1 mL用DEPC水配成的75%乙醇洗涤;4℃、7 800×g离心5 min;弃上清液,置室温,待RNA沉淀吹至半透明状,加入10μL DEPC水溶解。核酸检测仪测定RNA纯度和浓度,用反转录试剂盒将RNA反转录为cDNA,-20℃保存备用。
1.7 实时荧光定量PCR检测TRIM25和PTEN的相对表达量
小鼠TRIM25、PTEN及β-肌动蛋白引物由上海生工公司合成。TRIM25上游引物:5′-GAGGATGGAGTGCCATTGTT-3′,下游引物:5′-GGCTGACCTCAACCCTGTAA-3′,预计扩增片段为127 bp。PTEN上游引物:5′-AGGCACAAGAGGCCCTAGAT-3′,下游引物:5′-CTGACTGGGAATTGTGACTCC-3′,预计扩增片段为74 bp。
β-肌动蛋白上游引物:5′-TGGAATCCTGTGGCATCCATGAAAC-3′,下游引物:5′-TAAAACGCAGCTCAGTAACAGTCCG-3′,预计扩增片段为349 bp。
实时荧光定量PCR扩增体系为:2×SYBR Premix ExTaq5μL;ddH2O 3.4μL;正向引物、反向引物各0.3μL;cDNA 1μL,总体系为10μL。实时荧光定量PCR反应条件:预变性95℃10 min;变性95℃ 15s;退火60℃ 30 s;延伸72℃ 30 s;进行35个循环扩增,72℃ 7 min充分延伸。TRIM25和PTEN的相对表达量采用2-△△Ct法计算。
1.8 琼脂糖凝胶电泳
用3%琼脂糖凝胶电泳鉴定PCR扩增产物,将4.5μL样本与0.5μL 10×上样缓冲液的混合液加至加样孔中,另一加样孔中加入5μL DL500 DNA标准参照物。电压110V电泳40 min左右,将凝胶放入EB染液染色10 min,清水冲洗10 min,曝光成像拍照。
1.9 统计学分析
采用GraphPad Prism 5.0软件进行制图,SPSS 19.0软件进行统计学分析,数据采用均数±标准差表示,运用独立样本t检验进行两组之间的比较,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠来源MDSCs纯度的鉴定
磁珠分选野生型小鼠脾脏来源MDSCs,流式细胞术分选荷瘤小鼠肿瘤组织来源MDSCs,采用流式细胞仪鉴定MDSCs的纯度。野生型小鼠脾脏来源MDSCs和荷瘤小鼠肿瘤组织来源MDSCs的纯度均达90%以上。见图1。
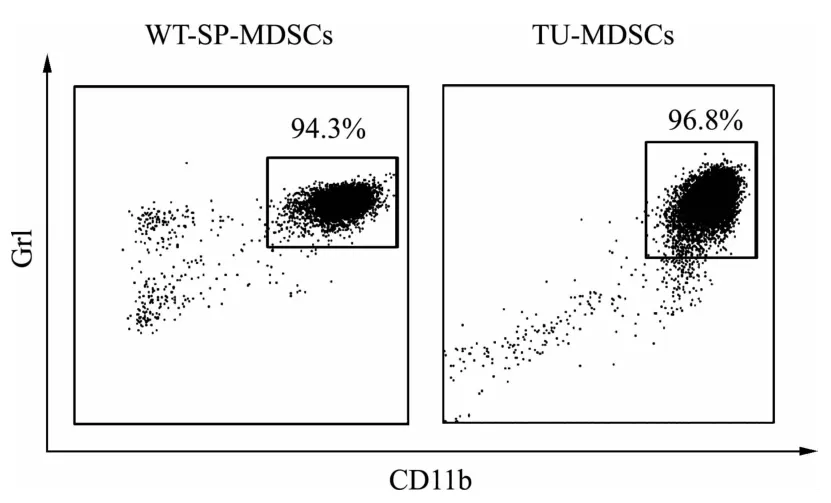
图1 流式细胞术鉴定MDSCs纯度
2.2 TRIM25、PTEN基因定量PCR扩增产物的鉴定
TRIM25、PTEN的实时荧光定量PCR扩增曲线呈典型 S型,CT值(cycle threshold,CT)在18~28之间,说明模板cDNA浓度合适;实时荧光定量PCR熔解曲线呈单峰,表明两基因的引物特异性好;同时,琼脂糖凝胶电泳显示TRIM25、PTEN扩增产物的片段均为单一的特异性条带,且扩增片段大小符合预期。说明MDSCs中存在 TRIM25、PTEN的表达。见图2。
2.3 TRIM25在荷瘤小鼠肿瘤组织来源MDSCs中高表达
qRT-PCR检测结果显示,与野生型小鼠脾脏MDSCs相比,TRIM25在荷瘤小鼠肿瘤来源MDSCs中的表达水平显著升高(t=4.566,P<0.001),表明TRIM25在荷瘤小鼠肿瘤组织来源MDSCs中高表达。见图3。
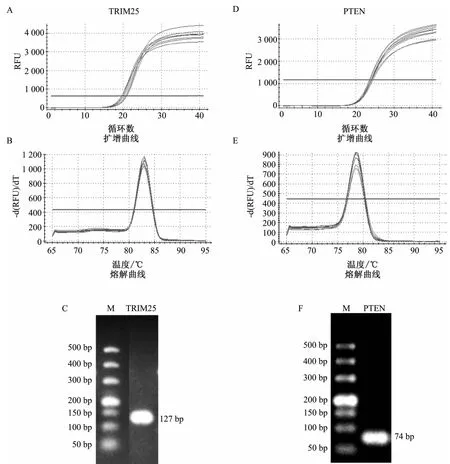
图2 TRIM 25、PTEN基因PCR扩增产物的鉴定分析
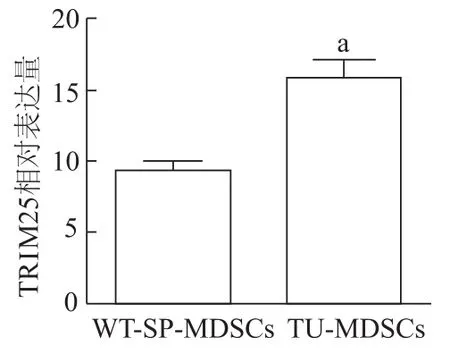
图3 TRIM 25在荷瘤小鼠肿瘤组织来源MDSCs中高表达
2.4 PTEN在荷瘤小鼠肿瘤组织来源MDSCs中表达水平下降
qRT-PCR检测PTEN的表达水平。结果表明,与野生型小鼠脾脏来源MDSCs相比,荷瘤小鼠肿瘤组织来源MDSCs中PTEN的表达水平明显下降(t=8.881,P<0.001),表明PTEN在荷瘤小鼠肿瘤组织来源MDSCs中表达水平下调。见图4。
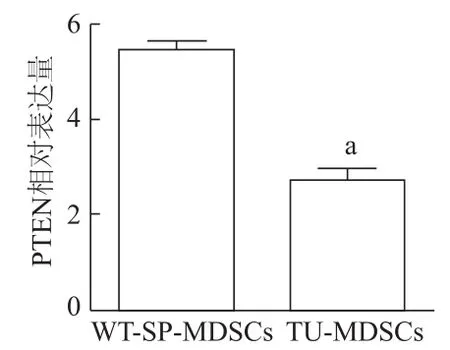
图4 PTEN在荷瘤小鼠肿瘤组织来源MDSCs中表达下调
3 讨论
近年来,MDSCs已成为肿瘤微环境中抑制免疫应答的主要细胞。MDSCs是一种由大量未成熟的骨髓前体细胞组成的异质性群体,在病理状态下被激活,并显示出强大的免疫抑制活性[19]。MDSCs能够抑制效应性T细胞和NK细胞的抗肿瘤免疫应答,在肿瘤的发生、发展及肿瘤免疫逃逸中发挥重要作用。正常小鼠的脾脏中仅有2%~4%CD11b+Gr1+细胞,而荷瘤小鼠脾脏中MDSCs的比例可达20%~40%,并在肿瘤局部检测到MDSCs的大量聚集[20]。有文献报道,与小鼠脾脏来源MDSCs相比,肿瘤局部来源MDSCs发挥更强的免疫抑制功能[21]。肿瘤局部MDSCs的产生和功能的调节是一个复杂的过程,目前已发现多种信号通路参与MDSCs的调控,如 STAT家族、C/EBP、NF-κB和PTEN/PI3K/AKT等通路,但具体的分子机制尚不十分清楚[22]。因此,我们想探究MDSCs的调控机制,为靶向MDSCs的肿瘤免疫治疗提供理论基础。
PTEN是继p53之后发现的一个极其重要的抑癌基因。PTEN的突变或缺失与肺癌、结直肠癌、乳腺癌和前列腺癌等多种肿瘤的发生密切相关。MDSCs是肿瘤微环境中的主要抑制性细胞,PTEN参与调控MDSCs的扩增、活化和功能。大量的研究表明,肿瘤微环境中多种miRNA通过靶向抑制PTEN,活化 PI3K/AKT/mTOR或STAT3信号通路,促进MDSCs的扩增和免疫抑制功能[16-18]。Garcia等[23]发现前列腺上皮细胞PTEN的缺失会诱导肿瘤微环境中MDSCs的扩增和活化,从而促进前列腺癌的进展。我们的实验结果显示PTEN在肿瘤MDSCs中表达下调,这与以上的研究报道相一致。但PTEN对MDSCs调控的具体机制仍需继续探讨。
最近的研究发现E3泛素连接酶参与调控MDSCs的扩增、活化或功能。Tarcic等[24]指出E3泛素连接酶RNF20缺陷小鼠体内的MDSCs招募和激活增强,且这群MDSCs有很强的免疫抑制活性,抑制RNF20可能会促进慢性炎症的发生和随后肿瘤的进展。TRIM25作为一个重要的E3泛素连接酶,与肿瘤关系密切,在多种肿瘤组织中高表达。TRIM25对免疫细胞也有调控作用。我们的研究发现肿瘤组织来源MDSCs中TRIM25高表达,提示TRIM25可能正向调控 MDSCs的扩增、活化或功能。由于TRIM25、PTEN主要在蛋白水平发挥作用,接下来我们会进一步检测两者在MDSCs中的蛋白表达情况。此外,有研究证实TRIM25通过促进PTEN的K63位多聚泛素化,抑制其磷酸酶活性,促进了非小细胞肺癌的发生和发展[25]。那在肿瘤局部 MDSCs中,TRIM25是否通过介导PTEN泛素化,从而调控MDSCs的扩增、活化或功能,最终影响抗肿瘤免疫应答?这一问题我们将在之后的工作中继续研究和探讨。
