腹腔镜与开腹经腹会阴直肠切除术治疗低位直肠癌的疗效对比:基于倾向性匹配分析
2019-08-14徐逸昕奚诚叶年源王一波
徐逸昕,奚诚,叶年源,王一波
(江苏大学附属武进医院普外科,江苏常州213002)
随着全直肠系膜切除和放化疗技术的发展,直肠癌患者的复发情况以及长期生存得以明显改善[1]。Jacob等[2]在 1991年报道了首例腹腔镜下结肠切除术。随着器械设备和手术技术的发展,腹腔镜结直肠切除手术得以迅猛发展,并且有着与开腹手术相同的远期效果以及更好的近期疗效[3]。目前,研究微创(腹腔镜、机器人)与开腹治疗结直肠癌疗效对比的随机对照试验很多,但是微创手术治疗低位直肠癌能否表现出同样的优势仍未明确。故本研究拟对比腹腔镜与开腹手术治疗低位直肠癌患者的疗效。
1 对象与方法
1.1 研究对象
通过检索电子病历,收集2012年1月至2016年1月于江苏大学附属武进医院普外科连续就诊的低位直肠癌患者的临床病理资料,共158例。其中,男90例,女68例,年龄38~90(65.0±11.5)岁。
1.2 入组标准和排除标准
入组标准:初发低位直肠癌;接受手术治疗,术式为腹腔镜或者开腹经腹会阴直肠切除术(abdominoperineal resection,APR);术前有完整的检验、检查资料。排除标准:术前行新辅助放疗、化疗;术前行内镜治疗;同期行其他手术;腹腔镜手术术中中转开腹;资料缺失。
1.3 手术方法
所有患者在术前均行常规术前检查,排除手术禁忌。肠镜以及病理明确诊断低位直肠癌者,必须行APR。手术均按照全直肠系膜切除原则[4]进行:①近端游离至肠系膜下动静脉根部,于根部离断肠系膜下动脉并钳夹离断下静脉,清扫该处淋巴脂肪组织;远端切开腹膜返折,切断并结扎左右侧韧带,游离直肠癌至膀胱精囊腺后方至肛提肌表面;于乙状结肠中段切断肠管,于肠旁血管弓下方切除肠系膜。②左下腹壁切除直径3 cm的圆形皮肤、皮下组织,十字切开腹外斜肌腱膜,分离腹内斜肌、腹横肌于腹膜外分离隧道到达侧腹壁,将近端结肠钳出,并固定于腹壁形成人工肛门。③环形荷包缝合闭锁肛门,距离肛缘3 cm做梭形切口,切开皮肤、皮下组织,注意保护尿道(阴道),切除肛管及坐骨肛管间隙内淋巴脂肪组织、肛提肌及直肠,取出标本。④冲洗、检查腹腔,放置腹腔引流管,依次关闭腹部以及会阴部切口。
1.4 观察指标
患者临床病理特征、手术相关情况:年龄,性别,体质量指数,合并症指数,腹部手术史,其他肿瘤病史,各项检验指标(血红蛋白、中性粒细胞、淋巴细胞、白蛋白以及球蛋白),肿瘤相关特征(位置、直径、TNM分期、分化程度以及神经脉管侵犯情况),手术时间,出血量,术前术后检验结果差值、术后并发症情况及严重程度,术后输血情况,经口进食恢复时间,术后住院时间以及住院总费用。
1.5 判定标准
肿瘤分期:使用 AJCC/UICC第七版直肠癌TNM分期系统[5]。术后并发症严重程度按照Clavien-Dindo分级标准[6]进行划分:Ⅰ级为仅需要简单药物或者物理治疗;Ⅱ级为需要特殊药物(特殊抗菌药物、营养支持制剂和其他),输血和完全肠外营养;Ⅲ级为产生并发症需要有创治疗介入(手术、介入栓塞和内镜等);Ⅳ级为病情危重、需要进入ICU监护;Ⅴ级为并发症导致患者死亡;≥Ⅲ级定义为严重并发症。
1.6 随访
随访频率:术后第1年每3个月复查1次,第2年每4个月复查1次,此后每半年复查1次。随访内容:癌胚抗原、糖类抗原19-9、肠镜、腹部B超以及全腹部增强CT。随访截止时间为2017年1月。中位随访时间29个月(12~60个月)。
1.7 倾向性匹配分析
使用Logistic回归分析和以下协变量进行倾向性匹配分析:年龄、性别、体质量指数、术后化疗情况、术前合并症情况、各项血液检验结果和肿瘤病理情况。
1.8 统计学方法
采用SPSS 22.0统计软件进行倾向性匹配和数据分析。计量数据符合正态分布以均数±标准差(±s)表示,两组间比较采用独立样本t检验;计数资料组间比较采用χ2检验或者Fisher精确检验;等级资料组间比较采用Mann-WhitneyU检验;Kaplan-Meier法绘制生存曲线并采用Log-rank检验比较预后差异。
2 结果
2.1 基线资料
共有158例患者符合入组条件(腹腔镜组84例,开腹组74例)。按照入组与排除标准进行筛选:腹腔镜组排除者中,术前行ESD 2例,新辅助放疗、化疗2例,同期行其他手术3例,资料缺失2例;开腹组排除者中,术前行ESD 3例,新辅助放疗、化疗1例,同期行其他手术4例,资料缺失2例。最终,腹腔镜组符合条件75例,开腹组符合条件64例。
倾向性匹配分析前,两组血红蛋白水平(P=0.007)、白蛋白水平(P=0.011)和肿瘤位置(P=0.002)差异存在统计学意义。倾向性匹配分析后,两组各项临床病理特征差异均无统计学意义(P>0.05)。见表1。
2.2 两组患者生存情况比较
两组患者均得到完全随访,经Log-rank检验提示,术后3年生存率分别为腹腔镜组76.5%,开腹组75.1%,差异无统计学意义(P>0.05)。见图1。

图1 两组患者的生存情况对比
2.3 两组患者手术情况以及术后临床病理特征比较
与开腹组相比,腹腔镜组术中出血量较少,手术后血红蛋白、白蛋白消耗更少,术后并发症中腹腔感染、切口感染率更低,并发症程度较轻,恢复经口进食时间和术后住院时间更短,但住院费用较高(P均<0.05)。两组手术方式清扫的淋巴结数目差异无统计学意义(P>0.05)。见表2。
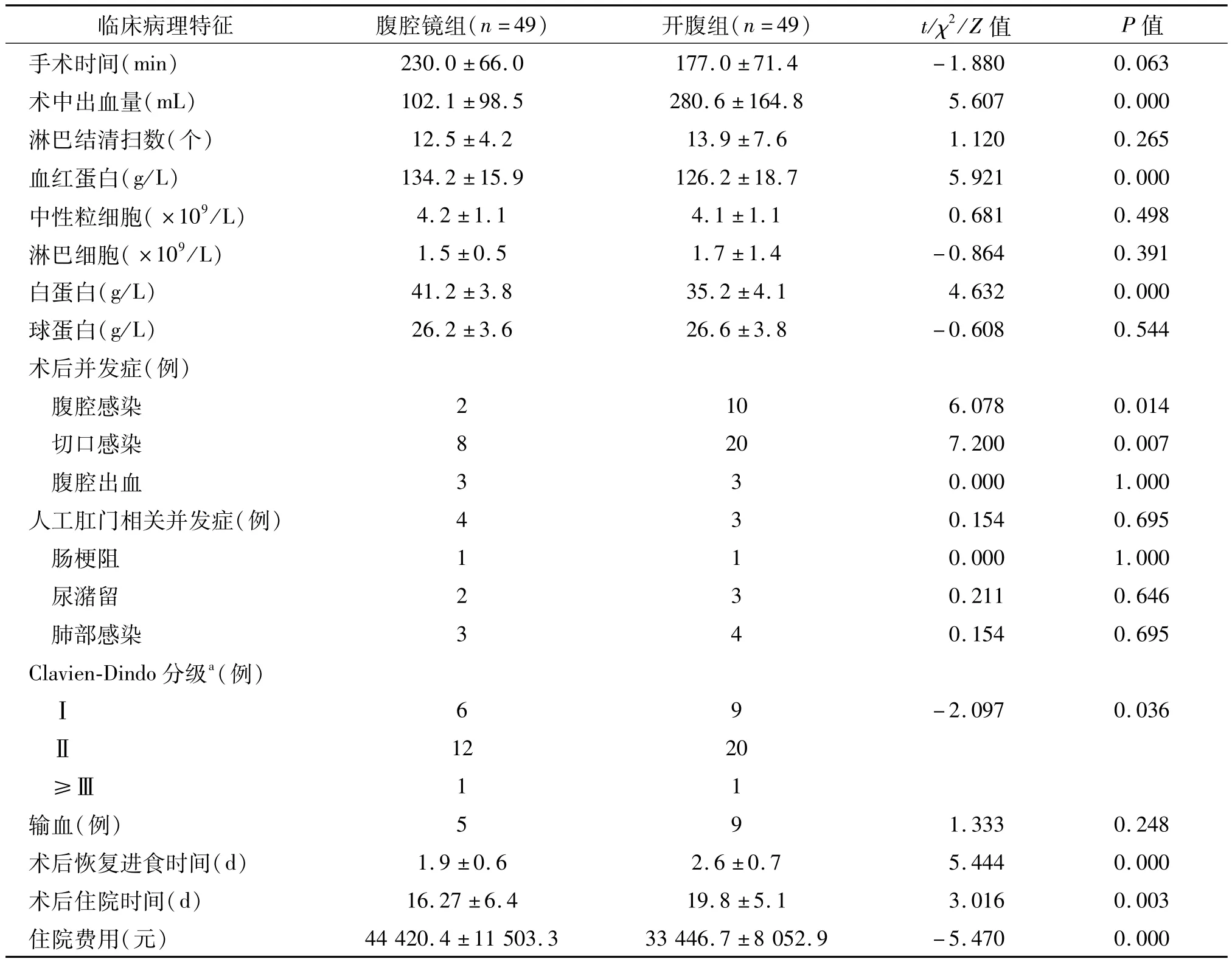
表2 两组患者术后临床特征对比
3 讨论
既往对于直肠癌根治术的回顾性分析只是简单地对比实验组与对照组患者的术前资料,便得出基本资料无明显差异;继而通过比较两组患者的术后资料,便得出两种手术方法孰优孰劣的结论,这样的结论是有失偏颇的。Honda等[7]最近也阐述了该观点:在进行两种治疗方式的回顾性分析对比前,需要尽量多地将患者的术前资料放入倾向性匹配分析模型中(包括术前检验、检查资料以及肿瘤分期情况等),排除两组患者的差异,然后再进行患者预后的对比;这样使得入组人群的基线资料更加平衡,从而减少了对结果的干扰。
我们发现除去一些基线资料,以下问题依然会影响患者预后,需要在进行研究前排除入组之间的差异:①贫血、营养状态、机体炎症状态,这是由于患者的整体状况可能会影响手术医师的术式选择。有报道称,行微创直肠切除术的患者整体营养状态要比开腹手术患者好[8];②已明确的可以预测患者生存情况的各种预后指数[9];③肿瘤的病理学特征[10]。
随机对照研究证实,与开腹手术相比,腹腔镜直肠切除术的短期疗效更加优异[11]。本研究也发现腹腔镜组术后并发症严重程度较轻,术后恢复进食时间和住院时间较短。在进行术后并发症亚组分析时,腹腔镜组腹腔、切口感染率较低,分析原因如下:①腹腔镜设备可以有助于手术医生更加仔细地辨认盆腔解剖结构;开腹手术由于盆腔位置低、空间狭窄,手术医生以及助手往往无法很好地解剖。②微创手术切口小,腹腔显露时间短,患者的内环境受影响程度低;③腹腔镜手术中超声刀的止血效果较一般电刀要好。手术中的出血量与术后输血往往与患者的术后并发症发生率密切相关[12]。本研究同样发现腹腔镜组的出血量较少,血红蛋白、球蛋白和白蛋白消耗更低,并发症也较开腹组少。手术清扫淋巴结数目是评价手术效果的重要标准,并且与患者的长期生存密切相关[13]。本研究中腹腔镜组与开腹组淋巴结清扫数目差异无统计学意义,同时两组患者的长期预后也无明显差异。
腹腔镜手术疗效优异,但住院费用较高。本研究中腹腔镜组住院费用明显高于开腹组。研究证实,行腹腔镜直肠手术患者的近期与中期费用负担较高[14]。由于我国的医疗保险并不是全额支付,所以在选择手术方式时也必须将经济因素纳入考虑范围,不能一味追求技术的先进性。
本次研究虽然运用倾向性匹配分析将两组患者的术前差异缩减至最小,但是证据强度仍然无法与随机对照研究相比。且本次研究为单中心,样本量偏少,可能存在统计学误差。所以,下一步应开展大规模多中心随机对照研究。
综上所述,腹腔镜经腹会阴直肠切除术与开腹手术相比,在近期疗效方面有较大优势,但医疗费用较高,在为低位直肠癌患者选择手术方式时需要制定个体化方案。
