颤抖蛋白异构体7在乳腺癌中的表达及其与患者预后的关系
2019-08-14徐振雷王庆伟
徐振雷,王庆伟
(南京医科大学附属淮安第一医院1.烧伤整形科,2.检验科,江苏淮安223001)
qkI基因编码一组RNA结合蛋白的剪接异构体,主要调控细胞分化[1-2]。在神经祖细胞、肌细胞和单核细胞中,颤抖蛋白(Quaking,QKI)异常表达可导致细胞发生严重的分化缺陷[3-4]。qkI基因编码3个主要的RNA结合蛋白,QKI-5,-6和-7,其C末端30个氨基酸不同;QKI-5 C端含有核定位序列,主要定位于细胞核中,QKI-6分布在整个细胞中并与QKI-5形成异源二聚体,QKI-7主要定位于细胞质中[5]。QKI可作为预测结肠癌、肺癌、口腔癌和胃癌预后的生物标志物[6-9],QKI-5通过Ras-MAPK信号通路抑制肾透明细胞癌的增殖和诱导细胞周期停滞[10],也可以预测前列腺癌患者的预后[11]。但是,QKI-7在乳腺癌发生发展过程中的作用尚不清楚。本研究拟观察QKI-7在乳腺癌组织中的表达,并分析其与患者预后之间的相关性。
1 资料与方法
1.1 一般资料与试剂
组织芯片购于上海芯超生物有限公司,共142例原发性乳腺癌组织及对应癌旁组织(距离肿瘤边缘>5.0 cm)。所有患者临床病理资料和随访资料均完整,均为女性,年龄29~83岁,平均53.3岁;肿瘤直径为0.5~15.0 cm,平均3.5 cm;其中,淋巴结转移90例;组织学类型:浸润性导管癌134例,浸润性导管癌伴浸润性小叶癌7例,筛孔癌1例;根据美国癌症联合会(AJCC)乳腺癌TNM分期标准:Ⅰ期12例,Ⅱ期83例,Ⅲ期47例。手术前均未经过放射治疗、化学治疗和靶向药物治疗,无远处转移;患者接受乳腺癌保乳手术或乳腺癌根治手术,手术时间为2001年1月至2004年8月,随访时间截止到2013年7月,随访9~13年。
小鼠抗人单克隆抗体QKI-7(上海文渊阁生物科技有限公司);小鼠抗人P53和Ki-67抗体(美国Sigma公司);兔抗小鼠二抗购于上海威奥生物科技有限公司;通用型免疫组化检测试剂盒购于吉泰生物有限公司。
1.2 免疫组织化学检测QKI-7、P53和Ki-67的表达
采用SP免疫组织化学染色法,将组织芯片在80℃微波中加热20 min;二甲苯浸泡脱蜡15 min;50%、70%、80%、95%梯度乙醇水化各2 min;PBS冲洗3次,每次5 min;3%过氧化氢固定10 min;置于95℃0.01mol/L枸橼酸缓冲液(pH=6.0)中煮沸15 min,行抗原修复;滴加正常山羊血清室温封闭20min;滴加小鼠抗人QKI-7(1∶2 000)、P53(1∶1 000)、Ki-67(1∶1 000),4℃孵育过夜;滴加兔抗小鼠二抗(1∶1 000)室温孵育 2 h;PBS洗 3次,每次 5 min;DAB显色,脱水、透明、封片、镜检;用PBS代替一抗作为阴性对照,用已知阳性片作为阳性对照。
1.3 免疫组织化学结果判定
将组织芯片置于光镜下观察和评分,结果判断综合考虑低倍镜下阳性细胞的染色强度和高倍镜下阳性细胞所占比例。染色强度和阳性细胞百分比评分标准:基本不着色为0分,淡黄色1分,棕黄色2分,黄褐色3分。组织芯片置于显微镜下计数200个细胞,阳性细胞百分数<10%为0分;10%~40%为1分;40%~70%为2分;≥70%为3分。两者相加,0~2分为阴性;3~6分为阳性[12]。由2位有资质的病理科医师采用双盲法进行判读,阴阳性判断不一致时,以第三位病理科医师的判读结果为准。
1.4 统计学方法
采用SPSS 17.0进行统计学分析,QKI-7、P53及Ki-67在乳腺癌和癌旁组织中的阳性率比较采用χ2检验,QKI-7与P53和Ki-67表达相关性采用Spearman等级相关分析,乳腺癌组织中QKI-7的阳性率与各临床病理参数的相关性采用Pearson、Fisher精确检验和似然比检验。采用Kaplan-Meier检验评估总生存期,组间生存时间的比较采用Log-Rank法。P<0.05为差异有统计学意义。
2 结果
2.1 QKI-7在乳腺癌组织及对应癌旁组织中的表达比较
免疫组织化学染色结果显示,QKI-7主要位于细胞质中,P53和Ki-67主要位于细胞核。乳腺癌组织中QKI-7阳性表达率(28.2%,40/142)明显低于癌旁组织(78.9%,112/142,χ2=73.378,P<0.05)。此外,乳腺癌组织中P53阳性表达率(21.8%,31/142)明显低于癌旁组织(93.7%,133/142,χ2=150.139,P<0.05),Ki-67阳性表达率(54.9%,78/142)明显高于癌旁组织(17.6%,25/142,χ2=42.791,P<0.05)。见图1。
2.2 乳腺癌组织中QKI-7表达与患者临床病理参数间的关系
结果显示,肿瘤组织中QKI-7表达与肿瘤直径、淋巴结转移、TNM分期及孕激素受体相关(P均<0.05),QKI-7阳性率越低,肿瘤直径越大,肿瘤越趋于淋巴结转移、TNM分期越高;而与患者年龄、组织学类型、雌激素受体和HER2受体情况等无明显相关性(P均>0.05)。见表1。
2.3 乳腺癌组织中QKI-7的表达与患者预后的关系
将142例乳腺癌患者按QKI-7表达分为阴、阳性两组,Kaplan-Meier分析结果显示,QKI-7阳性患者累积生存率(87.80%)明显高于QKI-7阴性患者(61.39%,Log-Rank检验,P=0.001 8)。见图2。

图1 乳腺癌组织和癌旁组织中QKI-7、P53和K i-67的表达(免疫组化染色×200)
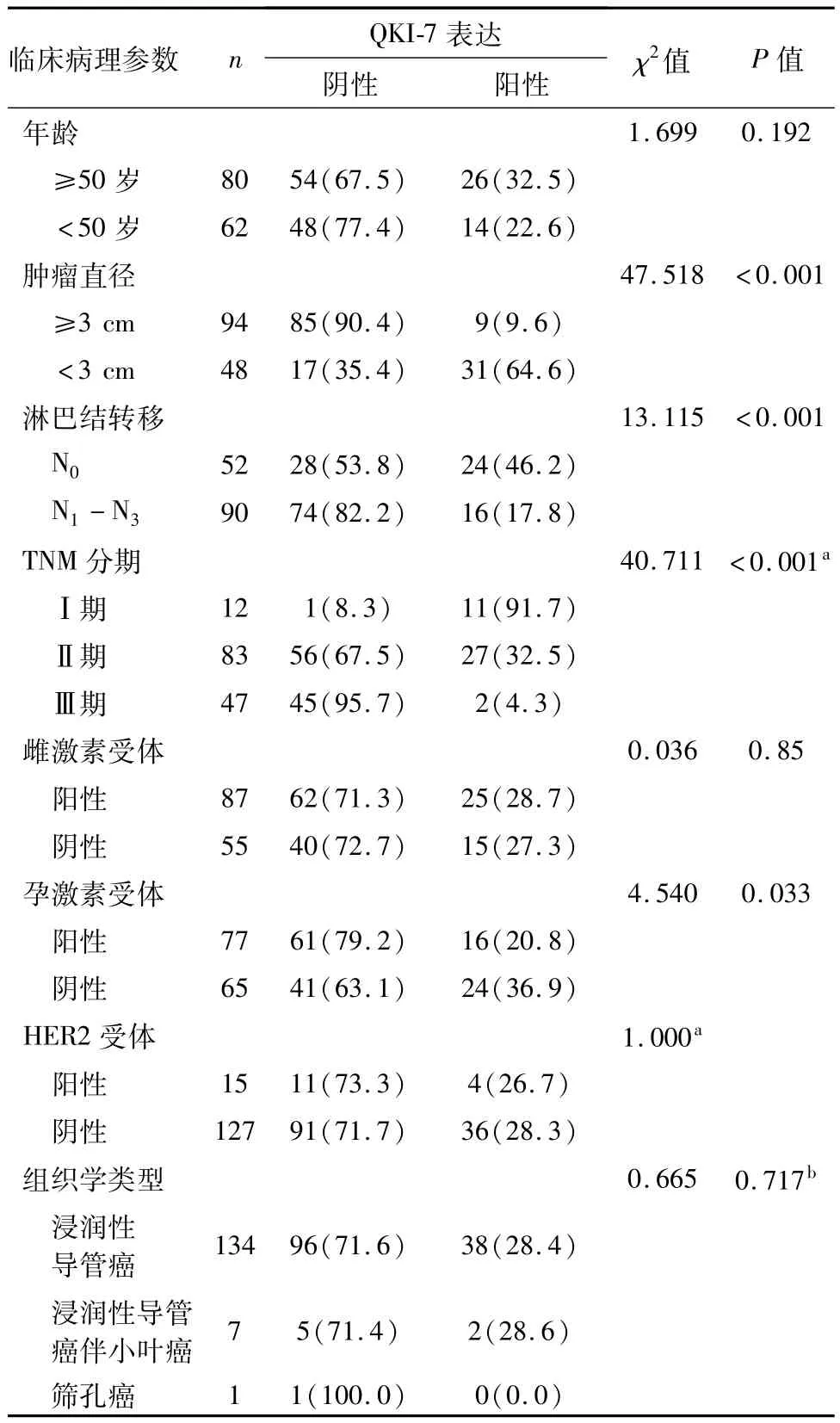
表1 乳腺癌组织中QKI-7表达与患者临床病理参数之间的关系 n(%)
2.4 乳腺癌组织中QKI-7表达与P53及Ki-67表达的相关性
相关分析结果显示,乳腺癌组织中QKI-7表达与P53表达呈正相关(r=0.579,P<0.05),而与Ki-67表达呈负相关(r=-0.329,P<0.05)。见表2。

图2 不同QKI-7表达患者的Kaplan-Meier生存曲线

表2 Spearman检验分析QKI-7与P53及Ki-67表达的相关性
3 讨论
以往有研究显示QKI在多种实体恶性肿瘤中表达下调,其通过抑制肿瘤细胞的生长和侵袭转移发挥抑癌基因的作用[8,13]。本实验结果显示,QKI-7表达在乳腺癌组织中显著下调,且随肿瘤直径增大、TNM分期升高而表达降低;此外,QKI-7在转移乳腺癌组织中较无转移乳腺癌组织表达更低,由此表明,QKI-7低表达在乳腺癌增殖和侵袭转移的过程中可能发挥负面作用。孕激素受体是配体激活的核转录调节因子,与配体结合后移位至胞核同DNA结合,促进乳腺上皮细胞增殖和分化[14]。QKI-7与孕激素受体呈负相关,推测QKI-7异常低表达时孕激素受体促进乳腺上皮细胞过度增殖。以往研究报道,胃癌中QKI低表达与患者不良预后有关[9],结直肠癌中QKI异常低表达促进患者术后的复发,同时也是患者术后复发的独立危险因素[6]。本实验生存分析发现,QKI-7阳性表达患者总生存率显著高于QKI-7阴性表达者,说明QKI-7可以作为乳腺癌患者的不良预后标志物。
Ki-67是衡量细胞增殖活性的生物学标志物,Ki-67高表达的乳腺癌患者预后较差[15]。P53是最早发现的抑癌基因之一,同时也是肿瘤中最常发生突变的基因,在约50%的恶性肿瘤中发生突变[16]。本实验结果显示,与癌旁组织相比,P53在乳腺癌组织中的表达水平显著降低,可能在乳腺癌的发生过程中发挥负面作用;而Ki-67在乳腺癌中的表达显著升高,其可能促进乳腺癌的发生。本实验通过相关性分析发现,乳腺癌组织中QKI-7阳性表达与细胞增殖指标Ki-67阳性表达呈弱负相关,而与P53阳性表达呈中等正相关,提示QKI-7更可能与P53共同参与乳腺癌的进展,两者在乳腺癌发展过程中可能起协同作用,但具体作用机制还有待进一步研究证实。
综上所述,QKI-7在乳腺癌组织中低表达,且其可能与肿瘤增殖、淋巴结转移、TNM分期相关,提示QKI-7参与乳腺癌的发生发展;生存分析结果表明,QKI-7低表达与患者的不良预后有关,由此表明,QKI-7可作为乳腺癌患者潜在的预后标志物。今后需要在体外细胞层面和体内动物实验中进一步验证QKI-7与乳腺癌恶性生物学行为之间的关系,探讨QKI-7参与乳腺癌发生发展的机制。
