益生菌对急性肝内胆汁淤积模型大鼠肝损伤的保护作用及机制研究*
2019-08-14王菊平马姝丽李小芹
王菊平,马姝丽,李小芹,周 方
(郑州大学附属儿童医院/河南省儿童医院/郑州儿童医院:1.药学部;2.消化科,郑州 450000)
肝内胆汁淤积发生与肝细胞功能异常、胆管损伤密切相关,典型症状为黄疸、大便浅黄,实验室指标中胆红素上升[1-2]。急性肝内胆汁淤积好发于儿童,特别是婴儿,是导致其残疾或死亡的主要原因[3]。临床治疗以熊去氧胆酸等药物治疗为主,价格较高,且部分患儿无效。
益生菌可促使肠道菌群生态平衡,其常用于肠道感染防治[4]。相关报道发现益生菌对慢性酒精性肝损伤、胆汁淤积性黄疸有一定疗效[5-6]。但目前关于益生菌对急性肝内胆汁淤积性肝损伤疗效的相关报道较少。本研究对α-异硫氰酸萘酯(ANIT)致急性肝内胆汁淤积幼鼠模型行益生菌预处理,检测二胺氧化酶(DAO)、D-乳酸(D-LA)等肠黏膜屏障功能血清指标及肝细胞核因子-κB(NF-κB)、肿瘤坏死因子-α(TNF-α)表达,分析益生菌的作用机制,现报道如下。
1 材料与方法
1.1材料
1.1.1实验动物 断乳2周的健康、雄性清洁级SD大鼠60只,体质量65~100 g,购自上海义森生物科技有限公司,由本实验室饲养,自由饮水。
1.1.2药物、主要试剂及设备 益生菌-培菲康胶囊(上海信谊药厂有限公司,规格:0.21 g,国药准字S10950032);α-萘异硫氰酸酯(α-naphthylisothiocyanate,ANIT,美国Sigma公司);总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)试剂盒(上海超研生物科技有限公司);DAO、D-LA试剂盒(上海恒远生物科技有限公司),多克隆鼠抗NF-κB抗体、多克隆羊抗TNF-α抗体(美国Santa Cruz公司);迈瑞BS-350全自动生化分析仪(武汉盛世达医疗设备有限公司);光学显微镜(日本Nikon公司)。
1.2方法
1.2.1药物配置 ANIT使用前通过麻油制备为1%溶液;益生菌胶囊、熊去氧胆酸片使用前通过温生理盐水稀释。
1.2.2分组与造模 60只SD大鼠适应性喂养72 h,将其分为正常组、模型组与干预组,每组20只。干预组大鼠每天1次给予益生菌4.2×108个活菌数/kg灌胃,正常组与模型组大鼠则行同等量温生理盐水灌胃。第5天模型组、干预组行0.5%(50 mg/kg)ANIT麻油混合液10 g/L灌胃构建急性肝内胆汁淤积模型,正常组不予以ANIT干预,仅给予等量麻油灌胃。为保证灌胃药物吸收的充分性,所有大鼠灌胃前后12 h内禁食,但不禁饮。造模后48、72 h分别处死大鼠,每组各10只。
1.2.3标本采集 处死大鼠前对其注射1%戊巴比妥钠50 mg/kg,腹腔逐一剪开,腹主动脉分离,抽取3 mL动脉血,以3 000 r/min离心10 min,上清液提取后用于血清相关指标检测。取血后切取肝左叶组织,4%多聚甲醛固定。
1.2.4血清相关指标检测 通过迈瑞BS-350全自动生化分析仪测定各组大鼠血清TBIL、DBIL、ALT水平;通过ELISA法测定血清DAO、D-LA水平。
1.2.5肝组织检测 肝组织常规石蜡包埋,5 μm连续切片,脱水,苏木素-伊红(HE)染色,光学显微镜下观察肝组织病理情况。免疫组织化学法测定肝组织NF-κB、TNF-α表达,SP法免疫组织化学染色,苯二胺显色,苏木素复染,封片(细胞质或细胞核内存在棕黄色颗粒)。400倍光学显微镜下观察,测定吸光度(A)值,重复测量3次,取平均值。
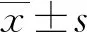
2 结 果
2.1大鼠情况 各组大鼠均存活,正常组大鼠活动、皮毛、尿液颜色均正常;模型组大鼠毛发无光泽,活动量减少,体质量降低,尿液为黄色;干预组大鼠活动、体质量较模型组显著改善。
2.2各组大鼠血清肝功能指标比较 模型组、干预组造模后48、72 h血清TBIL、DBIL、ALT水平均明显高于正常组(P<0.05),而干预组低于模型组,差异有统计学意义(P<0.05),见表1。

表1 各组大鼠不同时间点血清TBIL、DBIL、ALT水平比较
a:P<0.05,与正常组比较;b:P<0.05,与模型组比较
2.3各组大鼠DAO、D-LA水平比较 模型组、干预组造模后48、72 h血清DAO、D-LA水平均明显高于正常组(P<0.05),且干预组低于模型组,差异有统计学意义(P<0.05),见表2。

表2 各组大鼠血清DAO、D-LA水平比较
a:P<0.05,与正常组比较;b:P<0.05,与模型组比较
2.4肝组织病理观察 正常组大鼠肝脏外观、颜色均正常,显微镜下肝小叶显示清晰,无肝细胞病变发生。模型组大鼠肝脏外观显著肿胀,显微镜下肝小叶轮廓模糊,大量炎性细胞浸润汇管区,肝细胞嗜酸性变、点状坏死,造模后48 h上述症状进一步加重,造模后72 h上述症状有所缓解。干预组大鼠肝脏病变较模型组明显减轻,见图1。
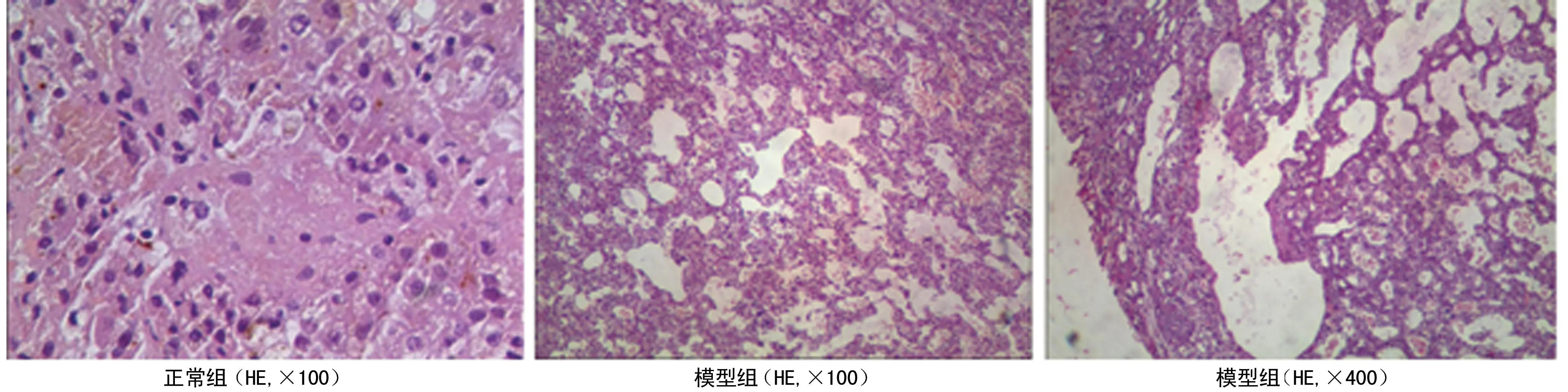
图1各组动物典型的肝组织病理图片
2.5各组大鼠肝组织NF-κB、TNF-α表达比较 模型组、干预组造模后48、72 h肝组织NF-κB、TNF-α表达均明显高于正常组(P<0.05),且干预组低于模型组,差异有统计学意义(P<0.05),见表3。

表3 各组大鼠肝组织NF-κB、TNF-α表达比较
a:P<0.05,与正常组比较;b:P<0.05,与模型组比较
3 讨 论
肝内胆汁淤积主要由胆汁分泌过多、排泄异常引起,胆汁过分堆积易损伤肝细胞,而肝细胞损伤会对肠黏膜造成不同程度的影响,引发肠道功能紊乱,严重时可能导致全身炎性反应综合征(SIRS)、多器官功能衰竭,威胁患者生命[7-8],为此修复机体肠黏膜屏障至关重要。此外,急性肝内胆汁淤积发生后NF-κB、TNF-α等细胞因子水平明显上升,诱导炎性反应,也会破坏肠黏膜屏障。
益生菌为一种常见微生态制剂,在胆汁淤积性肝病、肠道菌群改善等方面应用较多,补充有效剂量益生菌一方面可刺激肠道内有益菌生长,另一方面可经多种途径抑制肠道内致病菌生长、黏附、浸润,有利于肠道内菌群恢复,同时可促进胆汁排泄,抑制炎性因子产生或释放,改善肠黏膜屏障功能[9]。相关文献发现益生菌能保护酒精性肝损伤,这与其对肠道微环境调整,增强肠道屏障功能有关[10]。谢基明等[11]研究发现益生菌可能通过抑制TLR4/ERK通路,使过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPARs)上调以发挥保护急性肝损伤的目的。根据肝内胆汁淤积发病机制及相关研究,笔者对与肠黏膜屏障功能相关的指标(D-LA、DAO、织NF-κB、TNF-α)进行分析,其中D-LA、DAO分别为细菌发酵的代谢产物和肠黏膜上层绒毛细胞内酶,肠黏膜被损坏时,D-LA、DAO被大量释放到血液,致使血清D-LA、DAO水平显著上升。为此临床常将这两项作为肠道屏障功能评价的血清指标。肝内胆汁淤积发生时多伴肠源性内毒素血症,可刺激机体NF-κB、TNF-α等炎性因子释放[12],而上述因子会损伤相关结构及功能,进而损伤机体肠黏膜屏障功能。NF-κB是一种在人体内多种细胞中分布的转录因子,可多向调控基因转录。一旦细胞被胞外信号刺激,会激活单个或多个信号传递途径,致使IκB被磷酸化、泛素化,且经由26S蛋白酶降解和NF-κB解离[13]。NF-κB被激活,快速由细胞质移动至细胞核,与前炎性细胞因子(如TNF-α)、单核细胞趋化蛋白-1(MCP-1)等靶基因相关序列结合,基因转录启动,促使TNF-α等大量释放,放大初始炎症信号。NF-κB活化后对TNF-α等炎性介质触发,引发瀑布样级联反应。TNF-α被证实通过下调闭合蛋白表达,以损坏肠黏膜屏障[14]。
ANIT为间接肝毒剂,通过肝细胞毒性、膜脂质过氧化反应等促使肝细胞及胆管上皮细胞损伤、坏死,同时可造成小叶间胆管附近炎症出现,导致胆管阻塞,胆汁淤积明显,且伴肝实质细胞损害[15]。本实验通过ANIT造模,操作简单,与人类肝内胆汁淤积表现一致性较高。本研究结果发现,ANIT所致急性肝内胆汁淤积大鼠模型成功,大鼠血清TBIL、DBIL、ALT、DAO、D-LA水平比正常组明显上升,可见胆汁淤积会导致肝损伤,影响肠道黏膜功能。本研究模型组、干预组造模后72 h肝功能及其他相关指标比造模后48 h均有所下降,与熊小丽等[7]报道相符。分析其原因:ANIT诱导肝内胆汁淤积形成中在胆汁内与还原性谷胱甘肽结合,随时间推移,结合的ANIT慢慢解离排泄,进而72 h后肝脏胆汁淤积有所改善,这为今后药物干预设立关键时间点提供了依据。此外,本研究发现与模型组比较,干预组造模后48、72 h血清TBIL、DBIL、ALT水平均显著低,提示益生菌能明显改善SNIT所致肝内胆汁淤积大鼠肝损伤程度。分析其原因可能与益生菌下调血清DAO、D-LA水平及NF-κB、TNF-α表达有关。益生菌通过调整肠道内菌群,改变肠道微生态环境,减轻了炎性反应,促进了肠道黏膜屏障功能修复,进而有利于胆汁淤积症状缓解及肝功能恢复。
综上所述,益生菌可通过下调血清DAO、D-LA水平及NF-κB、TNF-α表达,减轻炎性反应,修复肠黏膜屏障功能,达到治疗肝内胆汁淤积的目的。
