曲古霉素通过自噬途径对K7M2 wt细胞凋亡的影响*
2019-08-14罗梅懿宋永丹陈维永
汪 瑜,罗梅懿,黄 歆,宋永丹,陈维永△
(1.四川省成都市第七人民医院/四川省成都市肿瘤医院 610041;2.四川省医学科学院·四川省人民医院,成都 610072)
骨肉瘤是常见的骨原发性恶性肿瘤,主要发生于儿童和青少年的股骨远端和胫骨近端等长骨部位[1]。骨肉瘤起源于间叶组织,恶性程度和侵袭性高,易转移,尤其是易转移至肺部。早先对骨肉瘤最主要的治疗方式是外科切除手术,治疗效果较差,患者生存率低于20%[2]。近年来,随着化疗在骨肉瘤中的应用,患者生存率提高至70%以上,但仍未达到人们的期望水平[3]。因此,寻找一种灵敏度高、不良反应小的抗骨肉瘤药物成为临床和基础研究中需迫切解决的问题。曲古霉素(trichostatin A,TSA)是一种组蛋白去乙酰化酶抑制剂,对乳腺癌[4]、肝癌[5]、骨肉瘤[6]等多种肿瘤均有抑制作用,但其抗肿瘤机制尚不明确。细胞凋亡是指受基因控制的主动性程序性死亡。自噬是细胞自我保护的一种手段,通过自噬清除受损蛋白质和细胞器,克服营养缺乏或低氧等环境,从而促进肿瘤细胞的生存和发展。细胞凋亡和自噬与肿瘤的发生、发展有紧密联系,通过凋亡和自噬途径研究肿瘤相关机制已成为肿瘤领域研究热点之一[7]。研究发现TSA杀伤乳腺癌细胞时,能够促进细胞的凋亡和上调自噬水平[8],而自噬在TSA杀伤骨肉瘤中的作用还未见报道。因此,本研究旨在探讨自噬在TSA抑制骨肉瘤细胞增殖和诱导骨肉瘤细胞凋亡中的作用,为TSA治疗骨肉瘤提供理论依据,也为抗肿瘤药物的研究提供新思路,现报道如下。
1 材料与方法
1.1材料
1.1.1细胞与试剂 小鼠骨肉瘤K7M2 wt细胞和DMEM高糖培养基购于武汉普诺赛公司;胎牛血清购于美国Clark公司;胰酶、双抗购于美国Hyclone公司;CCK-8及Western blot相关试剂购于合肥Biosharp公司;异硫氰酸荧光素标记的膜联蛋白V(Annexin V-FITC)/碘化丙啶(PI)双染细胞凋亡检测试剂盒购于江苏凯基生物公司;Bax、Bcl-2、Beclin-1、LC3抗体购于美国Abcam公司;氯喹(Chloroquine,CQ)购于美国Sigma公司。
1.1.2仪器 台式低速离心机(TDZ4-WS,长沙湘仪离心机仪器有限公司);二氧化碳培养箱(MCO-15AC,上海三洋电机国际贸易有限公司);酶标仪(Multlskan,苏州赛默飞世尔仪器有限公司);流式分析仪(Cytoflex,美国Beckman公司)。
1.2方法
1.2.1细胞培养 K7M2 wt细胞培养在含10%胎牛血清的DMEM高糖培养基,培养条件5% CO2、37 ℃的培养箱。细胞生长至80%融合度时,进行传代或进行实验。
1.2.2CCK-8法检测细胞增殖率 取培养的K7M2 wt细胞,调整细胞浓度为4×104/mL,接种于96孔板,继续培养,待细胞贴壁后,分别加入终浓度为50、100、200、400、600 nmol/L 的TSA,同时设置对照组(TSA浓度为0),每组设6个复孔。继续培养12、24、48 h后,每孔加入10 μL CCK-8,4 h后终止培养,用酶标仪(450 nm)测定各孔细胞吸光度(OD)值。选出TSA实验时基础浓度,并计算各组细胞存活率及半数致死浓度(IC50)。细胞存活率=(药物组平均OD值/对照组平均OD值)×100%。
1.2.3流式细胞术检测细胞凋亡率 取培养的K7M2 wt细胞,调整浓度为4×106/mL,接种于6孔板,继续培养至贴壁后,用TSA的基础浓度及倍数浓度与抑制剂CQ单独或联合作用处理24、48 h,离心收集细胞,用磷酸盐缓冲液(PBS)重悬细胞后,分别加入5 μL Annexin V和5 μL PI,混匀后,室温(20~25 ℃)避光孵育15 min。1 h内上机检测各组细胞凋亡情况,实验重复3次。
1.2.4Western blot检测各蛋白表达情况 收集经实验预处理的K7M2 wt细胞,提取各组细胞总蛋白并用BCA法进行定量。各组取等量蛋白质用10%的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳进行分离,分离后的蛋白质转移至聚偏氟乙烯(PVDF)膜上,用5%的脱脂奶粉封闭1 h后,结合一抗(Bax、Bcl-2、Beclin-1、LC3按1∶1 000稀释,β-actin按1∶400稀释),4 ℃孵育过夜后TBST清洗,然后二抗IgG(稀释比例均为1∶5 000)室温孵育1 h,TBST清洗,ECL暗室显色。显色后的蛋白使用Bio-Rad全功能成像系统采集图像,Image-ProPlus分析光密度,以β-actin为内参,计算各组蛋白质的相对表达水平,实验重复3次。
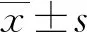
2 结 果
2.1TSA抑制K7M2 wt细胞增殖 用不同浓度TSA分别作用K7M2 wt细胞12、24、48 h,细胞存活率均受到抑制,且呈明显浓度依赖性和时间依赖性。TSA对骨肉瘤细胞12、24和48 h的IC50分别为1 061、539和338 nmol/L。选用338 nmol/L TSA作为后期实验的基础浓度,见图1。

图1 不同浓度TSA对K7M2 wt细胞存活率的影响
2.2TSA促进K7M2 wt细胞凋亡 分别用不同浓度TSA[0(对照组)、169、338和676 nmol/L]处理细胞48 h后,随着TSA浓度升高,细胞凋亡率也升高。与对照组比较,各TSA浓度组细胞凋亡率均显著升高(P<0.01),见图2。

a:P<0.05,与对照组比较
图2TSA诱导骨肉瘤K7M2wt细胞凋亡
a:P<0.05,与对照组比较
图3TSA对K7M2wt细胞凋亡及自噬相关蛋白的影响
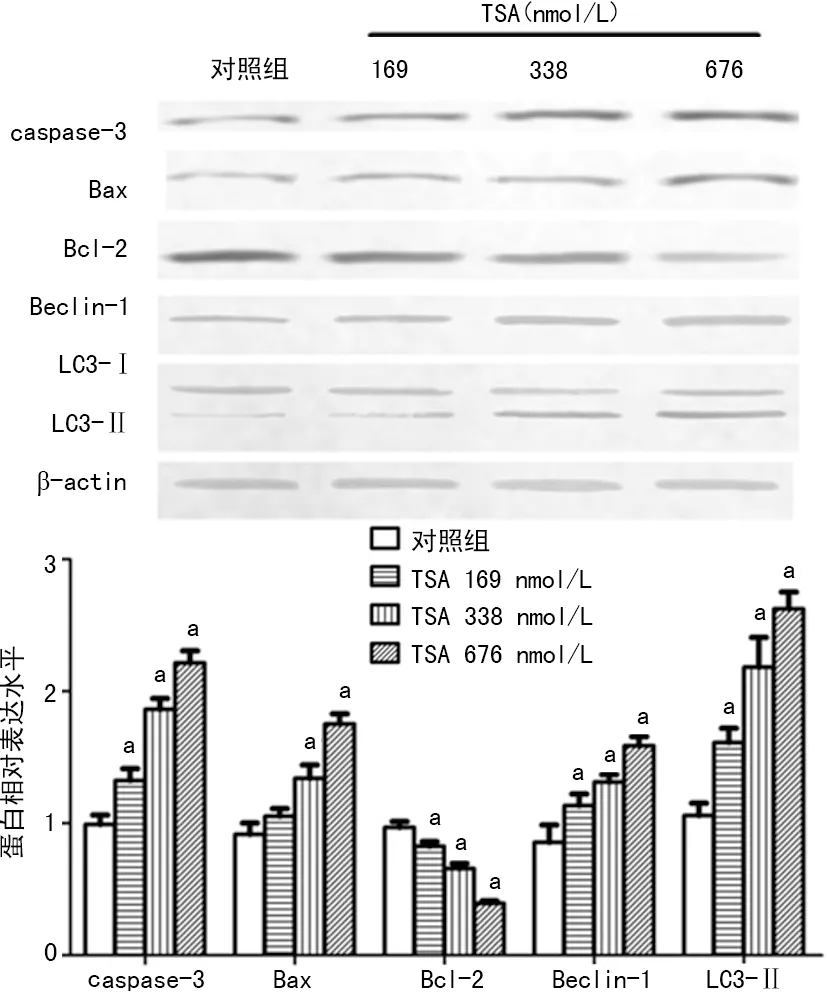
a:P<0.05,与对照组比较
图4CQ和TSA联用促进K7M2wt细胞凋亡
2.3Western blot检测凋亡及自噬相关蛋白 用Western blot检测凋亡相关蛋白表达变化,结果显示用不同浓度TSA处理K7M2 wt细胞24 h后,促凋亡蛋白caspase-3和Bax表达水平均显著上调,抗凋亡蛋白Bcl-2表达显著下调;自噬相关蛋白Beclin-1和LC3-Ⅱ表达水平同样显著上调(P<0.05)。以676 nmol/L TSA变化最显著,见图3。
2.4CQ和TSA联用对细胞凋亡的影响 用流式细胞术检测自噬抑制剂CQ和TSA对细胞凋亡的影响,与对照组比较,CQ和TSA单独作用或联用均能显著提高K7M2 wt细胞凋亡率,且联用后细胞凋亡率显著高于CQ和TSA单独作用(P<0.05),表明CQ可以协同增效TSA诱导的K7M2 wt细胞凋亡,见图4。
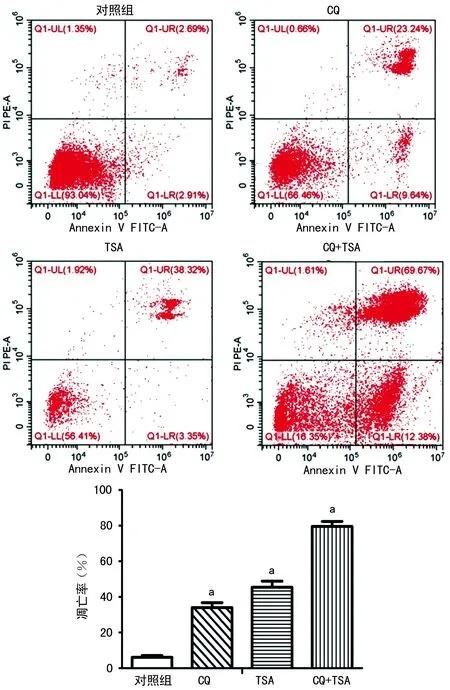
2.5CQ和TSA联用对细胞凋亡及自噬相关蛋白的影响 Western blot检测结果显示,CQ能够抑制Beclin-1和LC3-Ⅱ蛋白的表达,与对照组比较,差异有统计学意义(P<0.05)。与对照组比较,CQ处理后促凋亡蛋白caspase-3和Bax表达上调,Bcl-2表达下调,其中CQ和TSA联合作用的蛋白变化最为显著(P<0.05),见图5。
a:P<0.05,与对照组比较
图5CQ和TSA联用对K7M2wt细胞凋亡及自噬相关蛋白的影响
3 讨 论
组蛋白去乙酰化是抑癌基因失活的重要机制之一,如何抑制组蛋白去乙酰化的水平,对于抗肿瘤研究具有重要的意义[9]。组蛋白去乙酰化酶抑制剂能够抑制组蛋白去乙酰化,进而抑制肿瘤细胞的增殖和分化,是一类有极大应用价值的抗肿瘤药物。TSA是第1个被发现的具有抑制组蛋白去乙酰化酶作用的天然产物。本研究通过体外培养小鼠骨肉瘤K7M2 wt细胞,探讨TSA对K7M2 wt细胞存活率的影响,结果发现TSA可显著抑制K7M2 wt细胞的存活,且呈浓度和时间依赖性。这与HEPP等[10]研究TSA对白血病细胞抑制作用相一致。
细胞凋亡是受多基因精确控制的程序性死亡。大多数抗肿瘤药物都能引起肿瘤细胞凋亡,因此,诱导肿瘤细胞凋亡的能力成为评价抗肿瘤药物药效的主要指标之一[11]。本研究发现,用169 nmol/L TSA处理K7M2 wt细胞48 h后,细胞凋亡率明显升高,随着TSA浓度的增加,K7M2 wt细胞凋亡率增加。同时Western blot实验结果显示TSA处理后,K7M2 wt细胞中促凋亡蛋白caspase-3和Bax表达上调,而抗凋亡蛋白Bcl-2明显下调。表明TSA能够诱导K7M2 wt细胞发生凋亡。
自噬是不依赖caspase途径的细胞程序性死亡,与细胞凋亡关系密切[12]。为了进一步完善TSA抑制骨肉瘤细胞增殖的作用机制,笔者进行了探究。Beclin-1能够正向调控细胞自噬,是自噬形成的重要参与者[13]。LC3参与自噬体膜的形成,包括LC3-Ⅰ和LC3-Ⅱ两种形式,其中LC3-Ⅱ定位于自噬体膜,是自噬体的分子标志物[14]。本实验用不同浓度的TSA处理K7M2 wt细胞24 h后,发现Beclin-1和LC3-Ⅱ蛋白表达上调,且呈浓度依赖性,表明TSA能够诱导K7M2 wt细胞自噬的发生。
为了探究TSA对K7M2 wt细胞作用时自噬和凋亡的关系,本研究用自噬抑制剂CQ和TSA联合作用细胞,分析细胞凋亡的变化,结果发现CQ联合TSA能够有效降低自噬相关蛋白Beclin-1和LC3-Ⅱ的表达,进一步增加细胞凋亡率和提高凋亡相关蛋白caspase-3和Bax的表达,降低Bcl-2的表达,提示TSA诱导的自噬被抑制后,提高了K7M2 wt细胞凋亡。这与周宪春等[8]报道的自噬抑制剂3-MA能够提高TSA诱导T47D细胞凋亡相同。
综上所述,本研究发现TSA能够抑制K7M2 wt细胞的增殖,作用机制可能与诱导细胞凋亡相关;自噬在TSA诱导K7M2 wt细胞凋亡过程中对细胞起保护作用,当加入自噬抑制剂CQ后,降低了自噬对细胞凋亡的保护作用,从而导致细胞凋亡率升高。本研究证明TSA诱导K7M2 wt细胞凋亡可能是通过自噬途径,但TSA通过哪些具体的通路介导K7M2 wt细胞发生自噬及自噬途径如何调控K7M2 wt细胞凋亡仍不明确,TSA在体内能否促进骨肉瘤细胞的凋亡也不明确。因此,在后期研究中需要进一步探究TSA介导K7M2 wt细胞发生自噬及自噬介导细胞凋亡的具体机制,并进行裸鼠骨肉瘤体内治疗实验研究,进一步研究TSA的治疗效果。
