饲料磷真消化率不同的山羊空肠菌群结构差异研究
2019-08-14王立志王之盛彭全辉
金 磊,王立志,王之盛,薛 白,彭全辉
(四川农业大学 动物营养研究所,四川 成都 611130)
磷是动物体内一种重要的常量矿物元素[1-3],饲料中未被动物胃肠道消化吸收的磷,通过粪便排放到体外后,会造成严重的环境污染[4-5]。因此,提高动物对磷的消化利用效率对于降低动物养殖成本和减少环境污染均具有极其重要的意义。反刍动物饲料中的磷主要在小肠中进行消化吸收[6-7],小肠微生物可能是影响其对饲料磷消化吸收的一个重要因素[8-10]。已有关于山羊胃肠道微生物多样性的报道[11-12],但磷消化率不同的山羊小肠微生物的结构与组成是否具有差异仍未知。明晰饲料中磷消化率是否受到小肠微生物多样性的影响,将有助于提高饲料磷利用率相关技术的研发。另外,由于消化道内源磷的存在,采用表观消化率并不能准确衡量动物对磷的消化吸收情况[13-14]。与表观消化率相比,真消化率才能真实且准确地反映出宿主对磷的生物学利用效率[15-17]。本研究采用16S rRNA高通量测序技术比较饲料磷真消化率不同的山羊空肠微生物组成的差异性,旨在促进人们更清晰地认识空肠微生物与宿主饲料磷真消化率之间的关系,增进对空肠微生物与宿主磷消化利用关系的理解。
1 材料与方法
1.1 试验动物与饲养管理
选取24只10月龄,雌性,平均体质量(24.25±2.47)kg的努比亚黑山羊,试验在四川农业大学动物营养研究所实验基地进行,整个试验期试羊单笼饲养,每日饲料(干物质)按体质量3.5%供给,自由饮水。参照我国《肉羊饲养标准》(NY/T 816—2004),以每天每头增重0.1 kg为标准配制日粮,日粮配方和营养水平详见表1。
1.2 试验设计与样品采集
整个试验由2期(Ⅰ期和Ⅱ期)构成,每期包括14 d预饲期和6 d代谢试验期,共40 d。代谢试验期内,每天记录每只山羊的饲料供给量和残留量,并采集当天饲喂的饲料及剩料样品,于-20 ℃保存备用。采用全收粪法收集代谢试验期内山羊粪便,取粪总量的10%,用10%盐酸固氮后于-20 ℃贮存备用。Ⅰ期和Ⅱ期分别饲喂对应日粮,试验第41天晨饲前,屠宰所有山羊,迅速分割出空肠并进行结扎,以防止相邻肠断的内容物流入空肠。无菌采集空肠内容物样品于冻存管中,-80 ℃保存备用。
表1 日粮组成及营养水平(干物质基础)
Table 1 The composition and nutrient level of the diet (dry matter basis) %
1) 预混料是由同一类的多种添加剂或不同类的多种添加剂按一定配比制作而成的匀质混和物,预混料为每kg日粮提供:Fe(FeSO4)30 mg,Cu(CuSO4)10 mg,Zn(ZnSO4)50 mg,Mn(MnSO4)60 mg,VA2 937 IU,VD343 IU,VE30 IU; 2) 营养水平是指日粮中营养成分的含量,代谢能为计算值,其余为实测值。
1) Premix was a homogeneous mixture made from a variety of additives of the same class or a variety of additives of different kinds according to a certain proportion,premix provided the following per kg of the diet: Fe(FeSO4)30 mg, Cu(CuSO4)10 mg, Zn(ZnSO4)50 mg, Mn(MnSO4)60 mg, VA2 937 IU, VD343 IU, VE30 IU; 2) Nutrient level referred to the content of nutrients in the diet, metabolic energy was a calculated value and others were measured values.
根据山羊饲料采食量,饲料和粪便样品中的磷含量等数据,计算出24个山羊个体有机磷的真消化率:
磷真消化率(%)=[(Ⅱ期食入磷-Ⅰ期食入磷)-(Ⅱ期排泄磷-Ⅰ期排泄磷)]÷(Ⅱ期食入磷-Ⅰ期食入磷)×100%[18]。
统计24只山羊对饲料磷真消化率的平均值及标准差,将磷真消化率大于(群体平均值+0.5倍标准差)的山羊作为高磷真消化率组(high true digestibility of phosphorus,HP),磷真消化率小于(群体平均值-0.5倍标准差)的山羊作为低磷真消化率组(low true digestibility of phosphorus,LP)。
1.3 DNA提取和PCR扩增
提取HP组和LP组空肠内容物微生物总DNA,DNA的提取和纯化参照文献[19]方法进行[19]。用细菌通用引物对:515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACVSGGGTATCTAAT-3′),以空肠内容物菌群总DNA为模板,针对细菌16S rRNA基因的V4区用PCR仪进行扩增。PCR反应体系为:5 U·μL-1Taq酶0.25 μL,10×Buffer 5.0 μL,10 mmol·L-1dNTPs 1.0 μL,10 μmol·L-1引物各1.25 μL,50 ng·μL-1DNA模板1.0 μL,补ddH2O至50 μL。扩增反应条件为:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环30次;72 ℃ 5 min。PCR产物用含溴化乙锭的2%琼脂糖凝胶电泳鉴定并用PCR纯化试剂盒纯化和回收。回收的PCR产物用QuantiFluorTM-ST fluorometer定量,送北京诺禾致源生物技术有限公司构建文库,利用Illumina MiSeq测序平台进行高通量测序。
1.4 生物信息学分析
测序平台得到的原始数据经过质控、拼接、Tags过滤和去除剔除嵌合体[20-23]后,使用Uclust[24]聚类算法将序列聚类为OTU(operational taxonomic units),并使用RDF分类器[25]对OTU代表序列从门到属进行物种注释。基于OTU table和rep_set. tree文件及抽样的最大深度,绘制OTU稀释曲线并计算α多样性指数。结合各个样品的OTU种类及其丰度进行计算,获得样品间Unweighted unifrac距离矩阵,并利用加权组平均法(UPGMA)进行聚类分析,然后绘制PCoA聚类图[26-27]。根据门和属水平上物种的结构和组成,用OriginPro 9.0和R x64 3.0.2软件绘制优势菌门柱形图和共享属聚类热图。基于16s rRNA扩增子测序结果,用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states),通过比对KEGG(kyoto encyclopedia of genes and genomes, http://www.genome.jpkegg)数据库,对空肠微生物的基因进行功能预测,并挑选主要功能通路进行组间差异性分析[28-29]。
1.5 数据分析
采用SPSS 18.0统计软件,对LP组和HP组之间细菌的相对丰度进行非参数检验,将P<0.05视为差异显著,P<0.01为差异极显著。对组间差异显著的微生物,用其相对丰度与宿主对饲料磷的真消化率进行相关性(Spearman)分析。
2 结果与分析
2.1 山羊有机磷真消化率
如图1所示,24只山羊对日粮有机磷真消化率的平均值为(78.61±7.65)%,变异系数为9.73%。HP和LP组各挑选6只山羊,饲料有机磷的真消化率平均值分别为(89.20±0.01)%和(68.95±0.05)%,HP组山羊饲料有机磷真消化率极显著高于LP组(P<0.01)。
2.2 空肠内容物16S rRNA基因的高通量测序和OUT统计
对12个样本进行测序,共获得900 688条有效序列。基于相似性大于97%的原则,将获得的有效序列进行聚类,共获得5 611个OTU。其中HP组有3 830个OTU,平均每个样品含(2 313±179)个OTU;LP组有3 977个OTU,平均每个样品含(2 085±271)个OTU;两组间共享的OTU有2 196个(图2)。
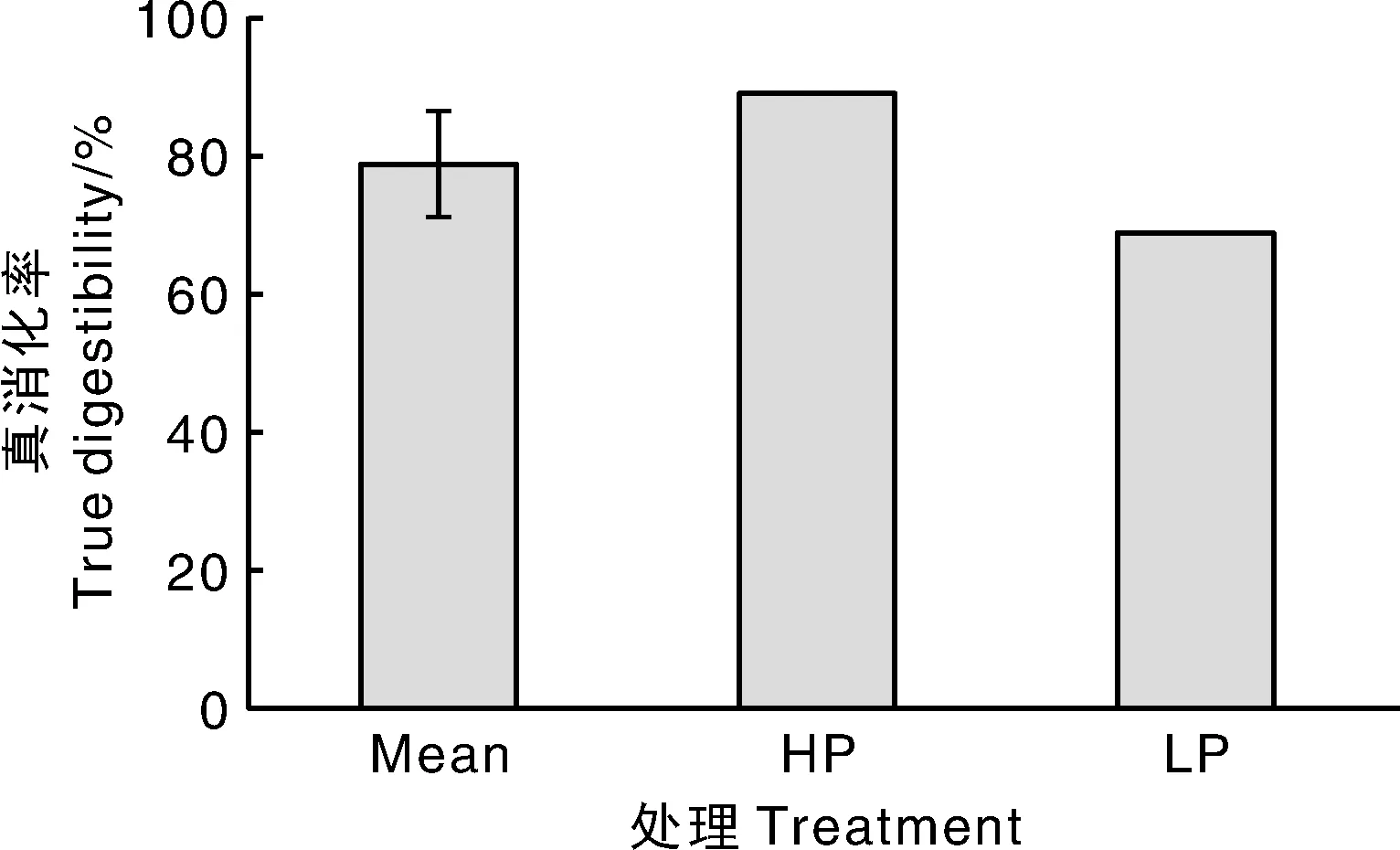
图1 磷真消化率Fig.1 True digestibility of phosphorus
各样品稀释曲线如图3所示。在本试验的测序深度下,各条曲线最终均趋于平缓,说明试验的测序量足以覆盖各样品的绝大多数微生物。
2.3 山羊空肠微生物的α多样性分析
α多样性指数主要用于评价样品中微生物的丰富性和均匀性。表2列出了HP组和LP组样品的Shannon、Chao1、Goods coverage和PD_whole_tree指数。在同一测序深度下,HP组的α多样性指数均大于LP组,但仅Chao1指数在组间具有显著差异(P<0.05)。
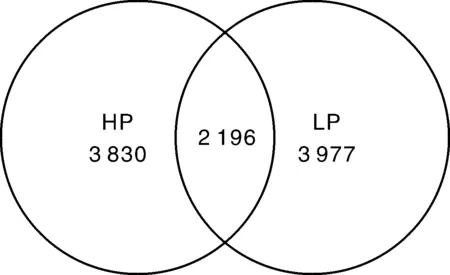
图2 OTU维恩图Fig.2 OTU venn diagram
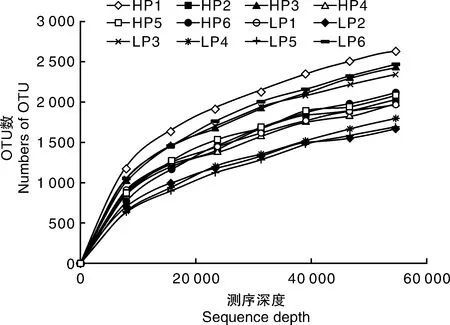
图3 各样品的稀释曲线Fig.3 Rarefaction curves of each sample
2.4 山羊空肠微生物门水平和属水平上的微生物组成
将所得有效序列在不同分类水平上进行物种注释和统计,将相对丰度大于0.1%的微生物视为优势菌群。HP和LP组均有8个优势菌门,2个组相对丰度排名前10的门均依次分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、黏胶球形菌门(Lentisphaerae)、螺旋体门(Spirochaetes)、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)、螺旋体菌门(Saccharibacteria)、疣微菌门(Verrucomicrobia)和绿弯菌门(Chloroflexi)(图4)。厚壁菌门(Firmicutes)在HP和LP组的相对丰度分别达到了59.75%和70.69%,处于绝对优势地位。对HP和LP组的优势菌门进行组间差异分析(表3),HP组厚壁菌门(Firmicutes)的相对丰度极显著低于LP组(P<0.01),拟杆菌门(Bacteroidetes)极显著高于LP组(P<0.01)。
在属水平上,2个组相对丰度大于0.1%的微生物属共有47个(图5)。对HP和LP组的优势菌属进行组间差异性分析,其中有显著性差异的菌属如表3所示,HP组Prevotella、Rikenellaceae_RC9_gut_group、Fibrobacter、Ruminococcus_2和Clostridium_sensu_stricto_1的相对丰度显著高于LP组(P<0.05),而Desulfovibrio和Victivallis的相对丰度显著低于LP组(P<0.05)。
如表3所示,在门水平,宿主的磷真消化率与拟杆菌门(Bacteroidetes)的相对丰度极显著正相关(P<0.01),与厚壁菌门(Firmicutes)的相对丰度极显著负相关(P<0.01)。在属水平,山羊磷真消化率与Prevotella、Fibrobacter和Victivallis的相对丰度显著正相关(P<0.05),与Desulfovibrio和Ruminococcus_2的相对丰度极显著正相关(P<0.01),与Clostridium_sensu_stricto_1的相对丰度极显著负相关(P<0.01)。
表2 组间α多样性指数的差异性比较
Table 2 Comparison of α diversity index between the two groups

组别GroupShannonChao1Goods coveragePD_whole_treeHP7.38±0.852170.24±202.840.99±0.01107.26±7.30LP6.60±1.521779.45±304.720.99±0.0193.31±15.13P值P value0.3020.0260.1610.07
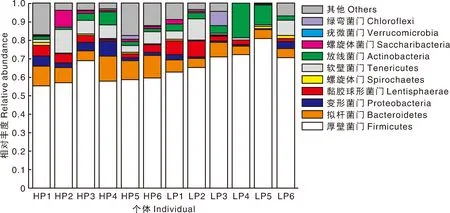
图4 门水平上的菌群组成Fig.4 Composition of microorganism at phylum level
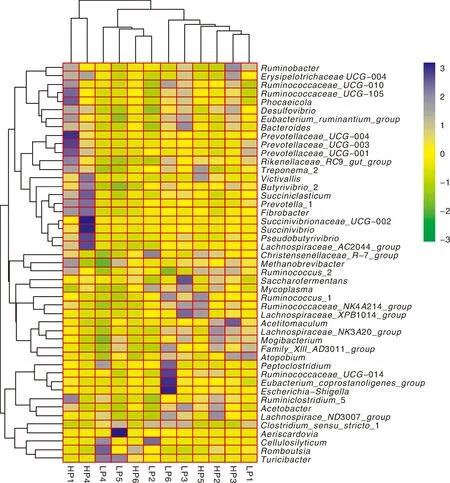
图5 共享菌群在属水平上的聚类热图Fig.5 Log-scaled percentage heatmap of bacteria community structure at the shared-genus level
表3 HP和LP组在门和属水平上差异的菌群及其与磷真消化率的相关性
Table 3 The difference between HP and LP groups at the level of portal and genera and their correlation with true phosphorus digestibility
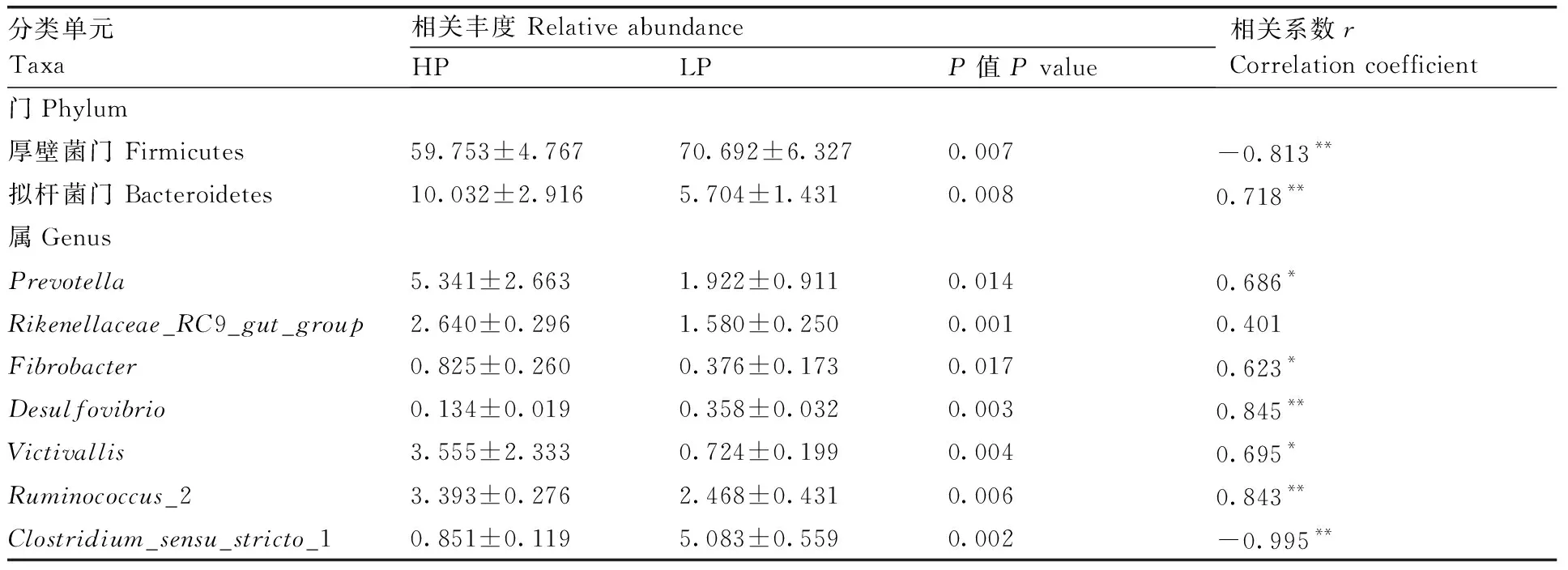
分类单元Taxa相关丰度 Relative abundanceHPLPP值 P value相关系数rCorrelation coefficient门Phylum厚壁菌门 Firmicutes59.753±4.76770.692±6.3270.007-0.813**拟杆菌门 Bacteroidetes10.032±2.9165.704±1.4310.0080.718**属GenusPrevotella5.341±2.6631.922±0.9110.0140.686*Rikenellaceae_RC9_gut_group 2.640±0.2961.580±0.2500.0010.401Fibrobacter0.825±0.2600.376±0.1730.0170.623*Desulfovibrio0.134±0.0190.358±0.0320.0030.845**Victivallis3.555±2.3330.724±0.1990.0040.695*Ruminococcus_23.393±0.2762.468±0.4310.0060.843**Clostridium_sensu_stricto_1 0.851±0.1195.083±0.5590.002-0.995**
**表示极显著相关(P<0.01),*表示显著相关(P<0.05)。
**Represented extremely significant correlation(P<0.01), * Represented significant correlation(P<0.05).
2.5 PICRUSt基因预测
基于本试验16s rRNA扩增子的测序结果,用PICRUSt对空肠微生物的基因进行功能预测,2个组共预测到了35个功能基因。图6展示了相对丰度处于前20位的功能基因,这20种功能基因分别占HP组和LP组总基因丰度的93.49%和94.08%。图6由下到上基因的相对丰度逐步降低,相对丰度最高的基因其功能依次为膜转运、碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素代谢、脂质代谢等。这20种功能基因,其相对丰度在组间的差异均不显著(P>0.05)。
3 讨论
本试验采用限饲,磷的供给量低于肉羊饲养标准,满足采用差量法测定饲料磷真消化率的条件。本研究测定的山羊对饲料磷的真消化率平均值为78.61%,略高于单胃动物猪[30]和鸡[31]。分析原因,可能是由于反刍动物胃肠道具有更丰富的胃肠道微生物,微生物可能会显著影响宿主对饲料中磷的消化吸收。动物对日粮中磷消化的影响因素主要包括日粮磷的来源、磷的水平、钙磷比和日粮植酸的水平等[32-35]。一般日粮中磷含量越高,无机磷的含量越低,动物对磷的消化利用效率越低[36]。但本试验结果发现,饲喂相同饲粮且遗传背景相同的山羊,饲料磷的真消化率也存在显著的个体差异。
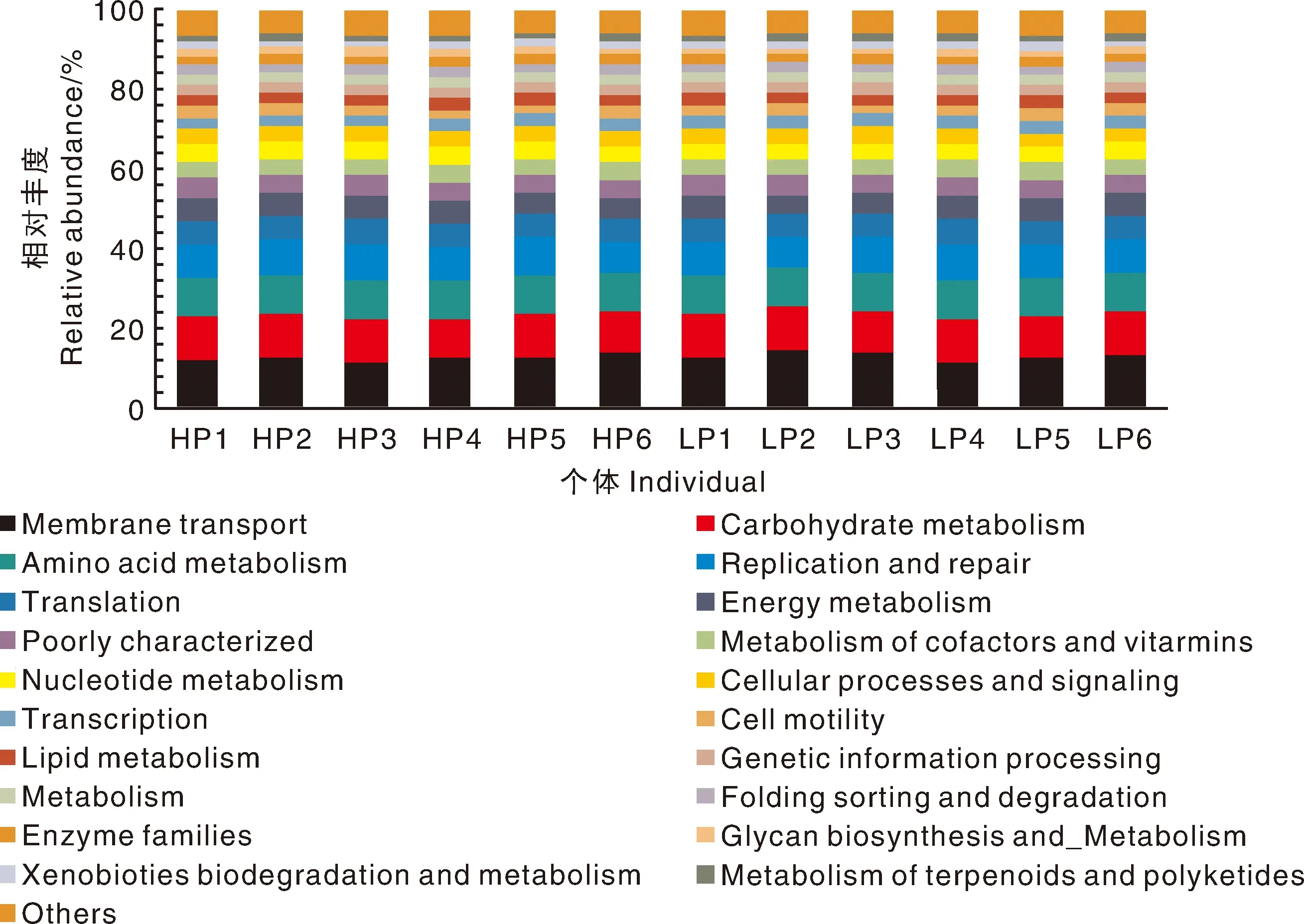
图6 20种优势功能基因的相对丰度组成Fig.6 The composition of the relative abundance contributed by the top 20 genes
学者们普遍认为小肠是磷消化吸收的主要场所,但有关宿主对饲料磷的消化吸收与小肠中微生物的相关性研究还未见报道。本研究采用高通量测序技术探索宿主磷真消化率与空肠微生物组成关系,较全面地覆盖了研究对象的空肠微生物,能真实全面地反映其微生物组成情况。研究结果发现,HP组α多样性指数中的Chao1指数显著高于LP组,暗示HP组微生物的丰富度或者是均匀度高于LP组;但是HP组和LP组之间OTU数并无显著差异,表明2组的微生物丰富度并无显著性差异。综合OTU数和Chao1指数的分析结果可以得出,HP组在空肠微生物的均匀度上要显著高于LP组,PCoA聚类图也直观地证明了这一点。
在本研究中,HP组和LP组空肠微生物相对丰度最高的门均是厚壁菌门(Firmicutes),肉牛和奶牛上的研究都表明[37-38],厚壁菌门(Firmicutes)在空肠微生物中处于绝对优势地位,这可能与反刍动物日粮中粗饲料含量较高有关,有研究表明,胃肠道中厚壁菌门(Firmicutes)的比例与日粮中粗饲料的含量呈显著正相关[39]。在门和属水平上,HP和LP组之间均存在差异显著的菌群,并且这些差异菌群与宿主对饲料磷的真消化率之间存在显著的相关性,说明空肠微生物的结构会显著影响山羊对饲料磷的消化吸收。在本研究中,HP组Bacteroidetes属的相对丰度极显著高于LP组,同时隶属于Bacteroidetes门的Prevotella属和Rikenellaceae_RC9_gut_group属的相对丰度也显著高于LP组,并且三者的相对丰度均与磷真消化率之间呈显著的正相关。这些结果表明,空肠中的Bacteroidetes门菌群可能有助于宿主对饲料磷的消化吸收。尤其值得注意的是Bacteroidetes门的Prevotella属,其所能消化分解的底物非常广泛,例如隶属于Prevotella属的短普雷沃氏菌,不但具有很高的蛋白酶活性,还能发酵葡萄糖、乳糖和纤维二糖;栖瘤胃普雷沃氏菌和布氏普雷沃氏菌,能分泌木聚糖酶和羧甲基纤维素酶以降解淀粉、木聚糖等营养物质[40]。因此,普雷沃氏菌属几乎可以单独完成蛋白质、糖类和碳水化合物等营养物质的降解任务。本研究中,Prevotella属菌群可能也参与了饲料中植酸磷的分解,使得植物性饲料中所含的原本不能被宿主利用的磷被释放出来,从而被山羊消化吸收。已有研究表明,Prevotella属菌群能分泌微生物植酸酶催化植酸的水解,释放饲料中的植酸磷,提高宿主对饲料植物磷的消化率[41]。
以有研究表明,Fibrobacter和Ruminococcus_2均是动物胃肠道中重要的纤维分解菌。Fibrobacter能产生多糖酶,这些酶能够降解日粮中的多种纤维类物质[42-44]。隶属于Ruminococcus属的白色瘤胃球菌和黄色瘤胃球菌都是主要的纤维分解菌种,在纤维素和半纤维素的降解中发挥着重要作用。HP组的Fibrobacter和Ruminococcus_2的相对丰度显著高于LP组,且相对丰度都与山羊对饲料磷的消化率显著正相关。产生这种现象的原因可能是饲料纤维结构的破坏促进了饲料中被束缚的磷的释放,纤维物质的降解发酵可以提高饲料磷的消化吸收率[45]。
目前为止,人们对肠道微生物在宿主营养物质消化代谢的过程中发挥的作用认知十分有限。通过PICRUSt基因预测,空肠微生物最主要的功能类别为代谢功能类,如能量代谢、糖酵解途径、碳水化合物代谢、脂肪代谢和氨基酸代谢等,这与前人的研究结果一致[46-47]。必须指出的是,虽然本研究表明,空肠微生物与宿主对饲料磷的真消化率存在显著的相关性,但目前尚缺乏直接的证据证明微生物的差异直接影响了山羊对饲料磷的消化吸收。但不可否认的是,本研究首次发现了空肠微生物的组成与山羊磷的真消化率存在关联性,这为今后研究调控微生物以促进磷的消化利用提供了崭新的思路。
