UCH-L1在弥漫大B细胞淋巴瘤中的表达及预后相关因素探讨
2019-08-14王金洁徐如君
王金洁 徐如君
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤中最常见的一种,约占每年新发淋巴瘤的25%~30%[1]。DLBCL具有显著的异质性,大约有30%~40%的DLBCL患者治疗无效或治疗后迅速复发,疾病进展快,预后差[2]。因此,探索新的治疗靶点成为了当前淋巴瘤研究的热点。泛素羧基末端水解酶 1(ubiquitin carboxy terminal hydrolase 1,UCH-L1)是去泛素化酶家族成员之一,参与泛素介导的蛋白质降解途径,对维持细胞正常生理功能具有重要的意义。UCH-L1基因表达异常与多种人类肿瘤的发生有关,其在淋巴瘤的发生、发展中也起着至关重要的作用。然而,UCH-L1在DLBCL中的表达情况及与患者预后的相关性国内尚未见相关报道。原癌基因B细胞淋巴瘤因子2(Bcl-2)和B细胞淋巴瘤因子6(Bcl-6)属于抗细胞凋亡家族,在淋巴瘤的发生、发展中起着重要作用,Ki-67是与细胞周期密切相关的核抗原。本研究从UCH-L1在DLBCL组织样本中的表达入手,研究其与DLBCL临床病理特征及预后相关因素的关系,探讨其潜在价值,并分析了其与Bcl-2、Bcl-6和Ki-67表达的相关性。
1 对象和方法
1.1 对象 收集本院2014年1月至2018年1月存档的石蜡包埋DLBCL组织样本149例,患者男85例,女64 例;年龄 15~89(62.01±15.03)岁;按照 Hans分型分为生发中心样B细胞淋巴瘤(germinal center like-B cell lymphoma,GCB)45例和非生发中心样B细胞淋巴瘤(non-germinal center like-B cell lymphoma,Non-GCB)104例。所有患者均由2位病理医师参照WHO(2008)造血与淋巴组织肿瘤分类法独立进行诊断。另取6例反应性增生的正常人扁桃体作为对照组。本研究经医院医学伦理委员会批准通过。
1.2 临床资料收集 收集患者的临床资料,包括性别、年龄、Hans分型、Ann Arbor分期、乳酸脱氢酶(LDH)水平(参考值50~240U/L)、白蛋白水平、有无B症状、有无骨髓侵犯和国际预后评分指数(IPI)等相关资料。
1.3 免疫组化染色 3μm厚切片石蜡包埋标本采用En Vision两步法,按照试剂盒说明书行免疫组化染色。兔多克隆抗体UCH-L1(克隆号ABP52672)购自中国台湾Abnova公司,以细胞质见棕黄色颗粒为阳性,比较细胞形态、胞质染色强弱及阳性细胞数。鼠抗人单克隆抗体 Bcl-2(克隆号 ZM-0010)、Bcl-6(克隆号 ZM-0011)和Ki-67(克隆号ZM-0167)均购自北京中杉金桥生物技术有限公司,Bcl-2为细胞质或胞膜着色,Bcl-6、Ki-67为细胞核着色。Ki-67结果以计数1 000个肿瘤细胞中阳性细胞表达百分数来标注,Ki-67在20%~30%以下为相对惰性的淋巴瘤,30%~80%为侵袭性的淋巴瘤,>80%为高侵袭性的淋巴瘤[3],故以80%为分界。其余指标以30%的肿瘤细胞出现定位清晰的棕黄色为阳性表达。采用PBS代替一抗作为阴性对照。
1.4 统计学处理 采用SPSS 19.0统计软件。计量资料以表示;计数资料组间比较采用χ2检验。采用Spearman等级相关分析UCH-L1阳性表达与Bcl-6、Bcl-2、Ki-67表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 UCH-L1表达情况 对6例反应性增生的正常人扁桃体行UCH-L1 HE染色可见两个滤泡生发中心,连续切片免疫组化染色发现UCH-L1阳性表达于滤泡生发中心内,而在套细胞、边缘区淋巴细胞和滤泡间淋巴细胞中呈阴性表达(图1-2)。在病例样本中,UCH-L1呈散在片状或弥漫阳性表达于肿瘤组织中,而在周围正常组织中未见其表达(图3)。

图1 反应性增生的正常人扁桃体HE染色情况(×100)
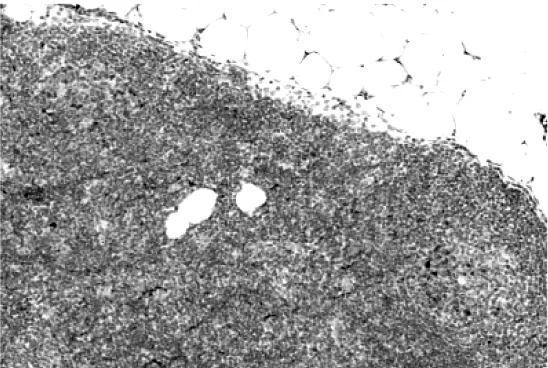
图2 反应性增生的正常人扁桃体UCHL1表达情况(En Vision法,×100)

图3 1例GCB型DLBCL病例UCH-L1表达情况(En Vision法,×100)
2.2 DLBCL组织中UCH-L1阳性表达与临床病理特征的关系 149例DLBCL患者中,36例UCH-L1阳性表达,UCH-L1阳性表达患者发病年龄15~89(55.08±17.58)岁。DLBCL组织中UCH-L1阳性表达与患者年龄和Hans分型均有关(均P<0.05),而与患者性别无关(P>0.05),见表 1。
2.3 DLBCL组织中UCH-L1阳性表达与预后相关因素的关系 DLBCL组织中UCH-L1阳性表达与Ann Arbor分期、LDH水平和IPI均有关(均P<0.05),而与白蛋白水平、有无B症状和有无骨髓侵犯均无关(均P>0.05),见表2。
2.4 UCH-L1 阳性表达与 Bcl-6、Bcl-2、Ki-67 表达的相关性分析 UCH-L1阳性表达与Bcl-6、Bcl-2、Ki-67表达均无相关性(均P>0.05),见表3。
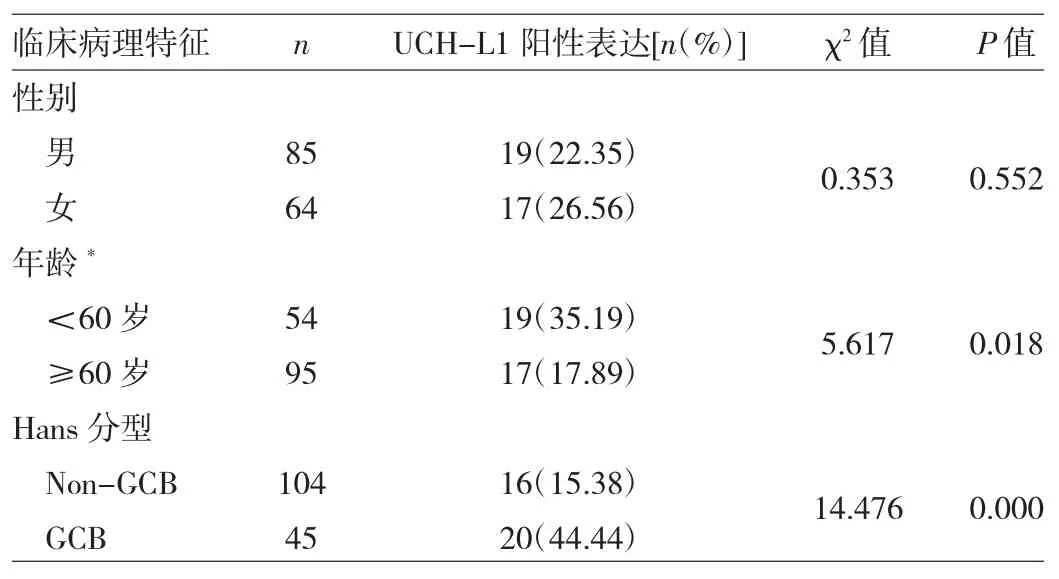
表1 DLBCL组织中UCH-L1阳性表达与临床病理特征的关系

表2 DLBCL组织中UCH-L1阳性表达与预后相关因素的关系
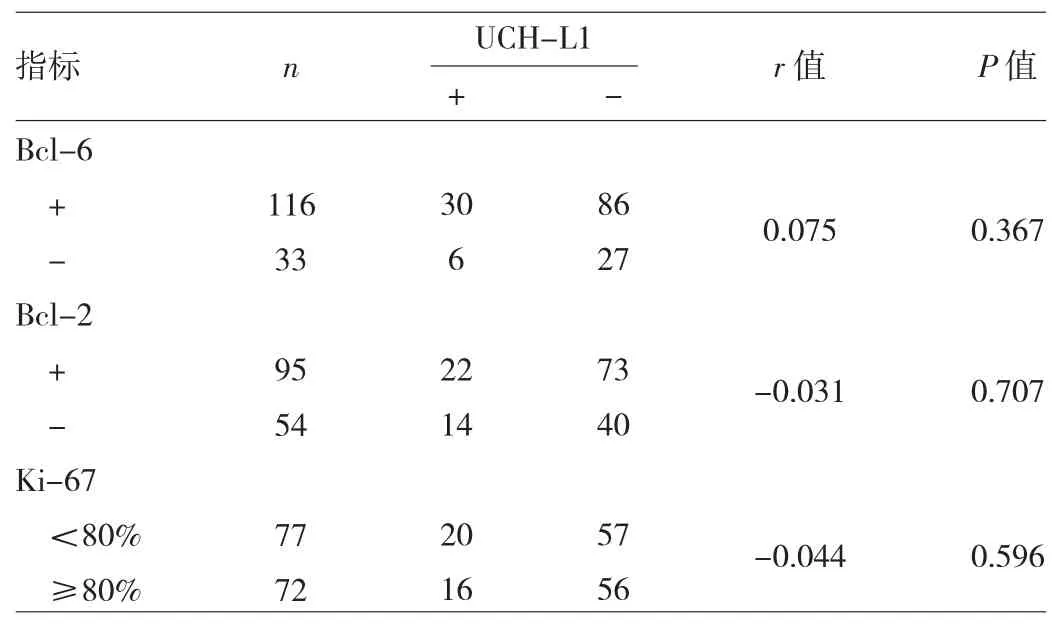
表3 UCH-L1阳性表达与Bcl-6、Bcl-2、Ki-67表达的相关性分析
3 讨论
UCH-L1是一种去泛素化酶,具有泛素羧基端水解酶的活性,参与泛素介导的蛋白质降解途径,能高效并高度选择性地进行细胞内蛋白转换,对维持细胞正常生理功能具有重要意义。UCH-L1最初被发现特定表达于脑、睾丸和卵巢组织中,其表达失调与阿尔茨海默病、帕金森综合征等神经退行性疾病和性别发育异常密切相关[4]。近年来,越来越多的研究发现UCH-L1基因表达异常与多种人类肿瘤的发生有关,但它在不同肿瘤中的功能却并不一致。在非小细胞肺癌、乳腺癌、肾癌中,UCH-L1是一个癌基因,其高表达与肿瘤侵袭性有关并往往提示患者预后不良[5-7];在鼻咽癌、肝癌中,UCH-L1却起着抑癌基因的作用,由于启动子区高甲基化使其表达缺失,进而促进了肿瘤的发生、发展[8-9]。在淋巴瘤方面,人们发现UCH-L1去泛素化酶活性在恶性B细胞生长和生存中是必不可少的,起着关键性作用,UCH-L1过表达明显增加转基因小鼠淋巴瘤的形成,在Burkitt淋巴瘤和EB病毒感染的B淋巴细胞中普遍存在UCHL1基因高表达[10-13]。尽管国外已有不少研究指出UCHL1在B细胞淋巴瘤发育进展过程中是一个多功能的癌前因子[10-15],但在临床病例样本中的研究较少,有关UCH-L1在DLBCL中的表达情况及与预后因素的关系国内尚未见相关报道。
DLBCL是B细胞非霍奇金淋巴瘤中最常见的一种亚型,具有高度异质性,按Hans分型可分为GCB型和Non-GCB型两型。免疫组化染色发现UCH-L1特异地表达于反应性增生的正常人扁桃体的滤泡生发中心内,本研究中GCB型UCH-L1阳性表达率明显高于Non-GCB型,提示UCH-L1与GCB型DLBCL的发生高度相关,且UCH-L1阳性表达者年龄较小,多见于中青年。在与预后相关因素分析中发现UCH-L1表达阳性者往往具有较高的LDH水平、Ann Arbor分期(Ⅲ~Ⅳ期)和IPI(3~5分),这些都提示患者预后不良。研究指出UCH-L1过表达会影响生发中心B细胞有关细胞的周期进展、细胞增殖和凋亡以及DNA修复信号通路基因的表达,其表达的增加预示了一种不依赖于Myc表达的DLBCL早期复发的可能性[14],这可部分解释为何UCH-L1阳性的DLBCL患者预后较差。
原癌基因Bcl-6属于抗细胞凋亡家族,编码核转录抑制蛋白,在生发中心B细胞和具有生发中心B细胞表型的淋巴瘤中高表达。Bcl-2是凋亡抑制基因,能抑制肿瘤细胞凋亡,在淋巴瘤的发生、发展以及对放化疗的敏感性上起着重要作用[16]。有研究指出在生发中心B细胞中UCH-L1能与Bcl-6协同作用,共同促进小鼠淋巴瘤的发生,UCH-L1高的肿瘤通常具有显著的形态学特点——具有典型或不典型的Burkitt淋巴瘤组织学结构,免疫组化表现为Bcl-2阴性,Bcl-6阳性[14-15]。Ki-67是与细胞周期密切相关的核抗原,可作为判断细胞增殖状态和肿瘤恶性程度的指标,Katzenberger等[3]认为Ki-67在套细胞淋巴瘤中是一个独立的预后指标。本研究显示UCH-L1阳性表达与Bcl-6、Bcl-2、Ki-67表达均无相关性。可能原因为对阳性判断标准不一,本研究以30%的肿瘤细胞出现定位清晰的棕黄色为阳性,这一标准与其他研究者相比,可能有所不同;也可能是受不同克隆号的单克隆抗体的影响。
综上所述,UCH-L1阳性表达在生发中心源性DLBCL患者中更为普遍,且与提示患者预后不良的指标密切相关,这可为DLBCL患者临床分型和预后分析提供一定的参考意义。淋巴瘤发生、发展本身是一个多基因、多因素、多阶段的病理过程,UCH-L1对DLBCL的影响可能涉及肿瘤细胞的周期进展、细胞增殖及凋亡等多方面因素,其具体的作用机制尚需设计严密的细胞及动物实验进一步阐明。
