川芎嗪减轻博莱霉素诱导的大鼠肺纤维化的作用机制研究
2019-08-14郑小芳胡慧佳李跃周燕王利民
郑小芳 胡慧佳 李跃 周燕 王利民
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种原因不明的以寻常性间质性肺炎为特征性病理改变的慢性间质性肺疾病,该病治疗手段有限且疗效欠佳,确诊后中位生存期仅2~4年。近年研究发现吡非尼酮和尼达尼布等抗纤维化药物在改善IPF患者症状及延缓肺功能下降方面有一定效果,但该类药物价格昂贵且安全性尚未完全确认[1]。中医学认为“瘀血内阻”贯穿该病始终,川芎为行气活血的代表中药,临床及基础研究证实以川芎为主的中药制剂及其主要成分川芎嗪能改善百草枯、博莱霉素(bleomycin,BLM)、矽肺等因素所致的肺纤维化。其中BLM气道内滴注所致的肺纤维化模型,其病理生理与人类肺间质纤维化相似,因此广泛应用于IPF的研究。上皮间质转化(epithelial-mesenchymal transition,EMT)被认为是纤维化疾病发生、发展的重要机制之一,而Sonic Hedgehog(Shh)蛋白在肺损伤时过度激活,参与肺泡上皮细胞损伤后修复过程,最终引起肺组织重塑[2]。Coon等[3]研究表明Shh信号通路活性与组织纤维化程度呈正相关。本研究旨在探讨川芎嗪减轻BLM诱导的大鼠肺纤维化的作用机制,以及该作用机制是否通过Shh信号通路抑制EMT过程来实现。
1 材料和方法
1.1 实验动物 清洁级SD雄性大鼠60只,体重(230±20)g,购自上海西普尔-必凯实验动物有限公司,饲养于浙江中医药大学动物实验中心屏障环境中,室温(23±2)℃,相对湿度60%~70%,每日光照明、暗各12h,以标准饲料饲养,所有操作均通过浙江中医药大学实验动物与伦理委员会批准。
1.2 主要材料及仪器 硫酸BLM(批号:H1608020,规格:20g,杭州瑞宏生物技术有限公司);川芎嗪(批号:FY17630226,纯度98%,南通经纬生物科技有限公司);环巴胺(Cyc,批号:HBA20170706B,纯度>98%,南京特拉维斯生物科技有限公司);羟脯氨酸测定试剂盒(批号:20171218,规格:50管/48样,南京建成科技有限公司);兔紧密连接蛋白-1(ZO-1)多克隆抗体(批号:057102,规格:100μl,美国 Proteintech 公司);兔 α-平滑肌肌动蛋白(α-SMA)多克隆抗体(批号:81A40002015,规格:100μl,英国Abcam公司);兔Shh多克隆抗体(批号:81A8420014,规格:100μl,杭州联科生物技术股份有限公司);兔胶质瘤相关癌基因同源物-1(Gli1)多克隆抗体(批号:GR3202163-7,规格:100μl,英国 Abcam公司);病理图文分析系统(德国卡尔蔡司公司)。
1.3 方法
1.3.1 动物分组及造模 采用随机数字表法将60只SD大鼠分为对照组(Con组)、模型组(BLM组)、川芎嗪低剂量组(L-Lig组)、川芎嗪中剂量组(M-Lig组)、川芎嗪高剂量组(H-Lig组)和Shh通路抑制阳性对照Cyc组(Cyc组)6组,每组10只。除对照组外,其余5组采用一次性气道滴注BLM溶液(药物溶于0.9%氯化钠溶液,4mg/ml)1.25ml/kg构建肺纤维化模型。于造模次日起,Con组和BLM组每日予0.9%氯化钠溶液2.5ml/kg灌胃给药,L-Lig组、M-Lig组和H-Lig组每日分别予川芎嗪溶液(药物溶于0.9%氯化钠溶液,8mg/ml)1.25、2.5和5.0ml/kg灌胃给药,Cyc组每日予Cyc(药物溶于10%DMSO溶液,2mg/ml)5.0ml/kg腹腔注射给药,各组均给药56d。实验过程中Con组无动物脱组,BLM组脱组5只,L-Lig组、M-Lig组和 H-Lig组分别脱组 1、3、3 只,Cyc组脱组4只,最终Con组10只,BLM组5只,L-Lig组、M-Lig组和H-Lig组分别为9、7、7只,Cyc组6只。1.3.2 标本收集 造模后第56天处死大鼠并收集标本。1.3.2.1 血清 3%戊巴比妥钠(1ml/kg)腹腔注射麻醉大鼠,用剪刀先剪去剑突处鼠毛,75%乙醇溶液消毒皮肤,持5ml注射器针头紧贴剑突下以30°斜行向上进针刺入心脏采血5~6ml,3 000r/min,离心10min后取血清保存至-20℃冰箱内。
1.3.2.2 肺组织 打开胸腔,分离肺组织(注意清理肺门周围软组织),切取左肺组织保存于-80℃冰箱,以备Western blot检测;切取右肺组织在0.9%氯化钠溶液中漂洗干净,置于4%甲醛中固定,用于后续HE染色及Masson三色染色。
1.3.3 肺组织病理形态观察及Ashcroft评分 右肺组织经甲醛固定、乙醇脱水、二甲苯透明、浸蜡、包埋切片、脱蜡、HE染色、脱水封片后,光学显微镜100倍视野下观察肺组织病理形态。根据Ashcroft评分标准[4]对肺泡炎和肺纤维化程度评分,0分:肺组织结构正常;1分:肺泡间隔或支气管壁轻度增厚;3分:肺泡间隔或支气管壁中度增厚,但不伴有明显的肺泡结构紊乱;5分:肺泡结构破坏,有条索状纤维带或纤维组织团块形成;7分:肺泡结构严重破坏,广泛的纤维灶形成,蜂窝肺;8分:满视野纤维化病灶;2、4、6分介于相应分数之间。
1.3.4 肺组织胶原沉积面积计算 右肺组织固定至切片,脱蜡步骤同上,经铁苏木素、丽春红、苯胺蓝染液完成Masson三色染色,使用病理图文分析系统计算蓝染的胶原沉积面积。
1.3.5 血清羟脯氨酸含量检测 采用碱水解法。血清样本经水解、调pH至6.0~6.8、加入活性炭后离心取上清液,检测波长550nm处吸光度值,羟脯氨酸含量(μg/ml)=[(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)] ×标准管含量(5mg/ml)×[(水解液总体积(10ml)/取样量(ml)] 。
1.3.6 肺组织EMT相关指标ZO-1、α-SMA、Shh信号通路Shh蛋白及下游转录因子Gli1蛋白表达水平检测采用Western blot法。取部分肺组织加入组织裂解液(每10mg肺组织加入200μl裂解液),于4℃匀浆机进行匀浆,14 000r/min,离心5min后取上清液,加5×上样缓冲液后煮沸5min。制备10%SDS-PAGE胶,按40μg蛋白量上样;80V电泳至Marker分离后改120V;300mA转膜100min;5%脱脂奶粉室温封闭1h,加入ZO-1(1∶2 000)、α-SMA(1∶1 000)、Shh(1∶1 000)、Gli1(1∶2 000)一抗后4℃过夜;TBST洗涤3遍后加入二抗,室温摇床孵育2h;TBST洗膜后ECL显像,以β-actin为内参,采用Image J软件分析各蛋白条带灰度值。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理形态及Ashcroft评分比较HE染色结果显示Con组肺组织结构正常,肺内结构清晰,肺泡间隔正常,无明显水肿、炎症及纤维化表现,肺泡腔内无明显渗出(图1a,见插页);BLM组肺泡结构破坏明显,肺泡腔萎缩或消失,部分肺泡出现断裂、融合,形成肺大泡,肺泡间隔明显增厚,肺间质被纤维细胞替代,肺间质纤维化形成,部分有炎性细胞浸润(图1b,见插页);L-Lig组、M-Lig组、H-Lig组和 Cyc组肺泡破坏,间隔增厚,炎症细胞浸润程度均较BLM组轻,肺间质被纤维细胞替代,呈不同程度肺间质纤维化,但程度较BLM组减轻(图1c-f,见插页)。肺组织Ashcroft评分结果显示,与Con组比较,BLM组Ashcroft评分增加(P<0.05);川芎嗪或Cyc干预后,与BLM组比较,L-Lig组、M-Lig组、H-Lig组和Cyc组Ashcroft评分较均下降(均P<0.05),但各组间比较差异均无统计学意义(均P>0.05),见表 1。2.2 各组大鼠肺组织胶原沉积面积比较 Masson三色染色结果显示Con组肺泡结构正常,被蓝染区域极少(图2a,见插页);BLM组肺泡结构明显破坏,肺泡融合,肺间质、支气管壁和肺泡隔被蓝染区域面积明显增加,间质胶原增生沉积呈弥漫性,呈片状、束状(图2b,见插页);而L-Lig组、M-Lig组、H-Lig组和Cyc组肺泡结构破坏及蓝染区域较BLM组明显减少(图2c-f,见插页)。与Con组比较,BLM组胶原沉积面积增加(P<0.05);川芎嗪或Cyc干预后,与BLM组比较,L-Lig组、M-Lig组、H-Lig组和Cyc组胶原沉积面积均减少(均P<0.05),但各组间比较差异均无统计学意义(均P>0.05),见表 2。

表1 各组大鼠肺组织Ashcroft评分比较(分)

表2 各组大鼠肺组织胶原沉积面积比较(%)
2.3 各组大鼠血清羟脯氨酸含量比较 与Con组比较,BLM组血清羟脯氨酸含量增加(P<0.05);川芎嗪干预后,与BLM组比较,L-Lig组、M-Lig组和H-Lig组血清羟脯氨酸含量均下降(均P<0.05),但各组间比较差异均无统计学意义(均P>0.05);Cyc干预后,Cyc组与BLM组血清羟脯氨酸含量比较差异无统计学意义(P>0.05),见表 3。

表3 各组大鼠血清羟脯氨酸含量比较(μg/ml)
2.4 各组大鼠肺组织ZO-1、α-SMA蛋白表达水平比较 与Con组比较,BLM组大鼠肺组织ZO-1蛋白表达水平下调(P<0.05),α-SMA蛋白表达水平上调(P<0.05)。川芎嗪或Cyc干预后,与BLM组比较,L-Lig组、M-Lig组、H-Lig和Cyc组大鼠肺组织ZO-1蛋白表达水平均上调(均P<0.05),α-SMA蛋白表达水平均下调(均P<0.05),见图3和表4。
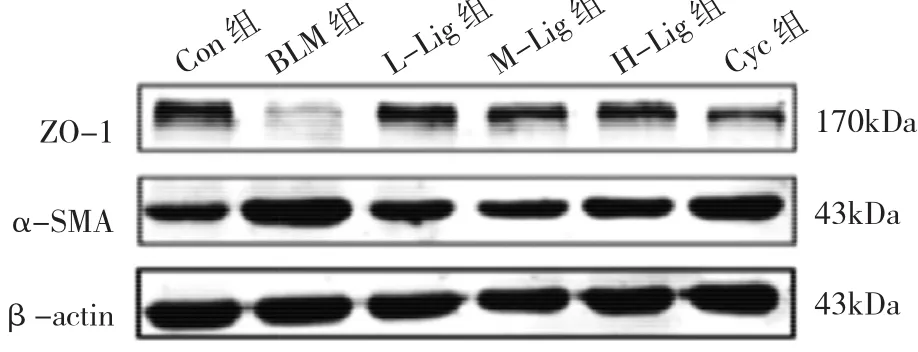
图3 各组大鼠肺组织ZO-1、α-SMA蛋白表达的电泳图
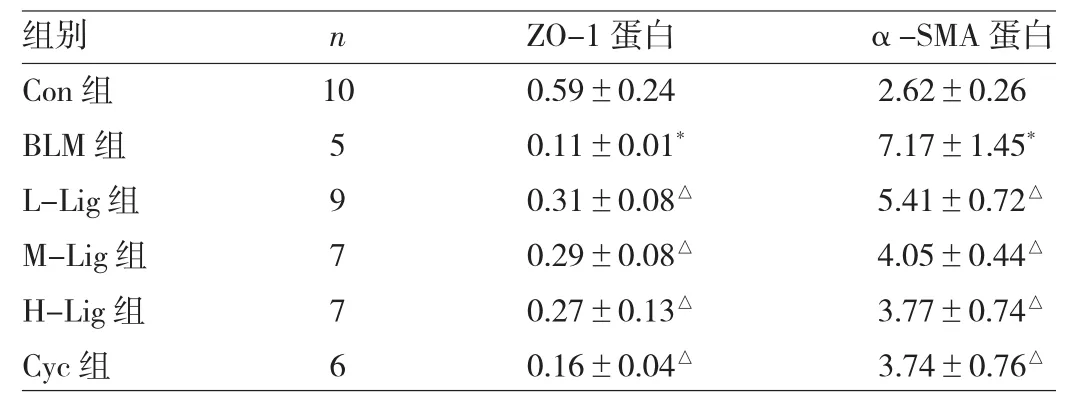
表4 各组大鼠肺组织ZO-1、α-SMA蛋白表达水平比较
2.5 各组大鼠肺组织Shh、Gli1蛋白表达水平比较 与Con组比较,BLM组大鼠肺组织Shh、Gli1蛋白表达水平均上调(均P<0.05);川芎嗪或Cyc干预后,与BLM组比较,L-Lig组、M-Lig组、H-Lig组和 Cyc组大鼠 Shh、Gli1蛋白表达水平均下调(均P<0.05),见图4和表5。
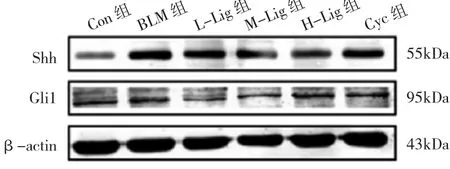
图4 各组大鼠肺组织Shh、Gli1蛋白表达的电泳图

表5 各组大鼠肺组织Shh、Gli1蛋白表达水平比较
3 讨论
川芎嗪是中药川芎的主要活性成分,大量研究证实川芎嗪可减轻BLM诱导的肺泡炎症与肺间质纤维化[5-6]。本研究使用BLM诱导大鼠肺纤维化模型,探讨川芎嗪的抗肺纤维化作用及其可能机制。
肺组织病理的改变是最直观的疗效衡量标准。本研究病理评分显示,大鼠肺纤维化模型肺泡炎与肺纤维评分较Con组升高,表明本实验模型制作成功。经川芎嗪干预后,大鼠肺组织Ashcroft评分下降,血清羟脯氨酸含量下降。由于羟脯氨酸是胶原的主要成分之一,其水平间接反映组织中胶原含量,提示川芎嗪能抑制BLM诱导的大鼠肺组织胶原沉积,降低肺组织羟脯氨酸含量及胶原沉积面积,减轻肺纤维化程度。
目前IPF的发病机制尚未完全明确,普遍认为与上皮损伤、炎症、氧化应激等因素有关,使得肺组织损伤与修复失衡,肌成纤维细胞增多,细胞外基质堆积,肺组织重塑[7-8]。EMT被认为是多种疾病发生、发展的重要机制,包括发育障碍、器官纤维化、肿瘤等[9]。炎症、氧化应激、内质网应激等可以激活EMT,导致上皮细胞标志分子如ZO-1表达下调,间质细胞标志分子如α-SMA等表达上调,上皮细胞失去极性,转化成纺锤形的间质细胞,促进肺纤维化发生、发展[10-11]。本研究中,笔者检测了EMT相关指标,结果显示BLM组肺组织ZO-1蛋白表达水平下调,α-SMA蛋白表达水平上调,而川芎嗪干预后,与BLM组比较,L-Lig组、M-Lig组和H-Lig组大鼠肺组织ZO-1蛋白表达水平均上调,且α-SMA蛋白表达水平均下调,提示川芎嗪通过抑制EMT,减轻肺纤维化程度。
另外有研究发现,IPF的发生与调控发育的信号通路的异常激活有关[12],Shh信号通路正常活化是肺发育的必要条件,它控制了早期肺部发育和适当的肺分支形态形成时的EMT[13]。在其他器官中,Shh信号通路已被证实会促进纤维化。例如,在斑马鱼胰腺癌中,旁分泌的Shh信号会导致纤维化反应[14]、Shh通路过度激活也会促进肾纤维化[15-16]、肝纤维化[17]和硬皮病的皮肤纤维[18-19]。在成纤维细胞中激活Shh信号通路也可能是重要的发病机制,该基因信号会刺激成纤维细胞释放胶原蛋白以及向肌纤维细胞分化[20]。研究证明,Shh信号通路参与基底增生、细胞外基质合成和α-SMA的表达过程[21-22]。已有研究通过瞄准Gli转录因子抑制Shh基因信号,在小鼠模型中预防肺纤维化取得理想结果[23]。本研究中,笔者检测了Shh蛋白及其下游转录因子Gli1蛋白表达水平,并以Shh信号通路抑制剂Cyc为阳性对照。结果显示,BLM组Shh、Gli1蛋白表达水平均高于Con组,川芎嗪能够抑制Shh信号通路,减少Shh、Gli1的表达。同时结果显示,Cyc能抑制BLM诱导的大鼠肺组织胶原沉积,并能抑制BLM诱导的ZO-1蛋白表达水平下调及α-SMA蛋白表达水平上调。提示Shh信号通路参与了BLM诱导的肺纤维化过程,同时抑制Shh信号通路是川芎嗪改善BLM诱导的大鼠肺纤维化的机制之一。
综上所述,Shh信号通路参与了肺纤维化的形成,川芎嗪通过抑制Shh信号通路,从而抑制EMT,减轻BLM诱导的肺纤维化模型的肺泡炎症及肺纤维化程度,为川芎嗪治疗IPF提供了理论依据。
