RON/PI3K信号通路在子宫内膜癌中的表达及临床意义
2019-08-14庄晓苹邵玲燕林琼琼
庄晓苹 邵玲燕 林琼琼
子宫内膜癌是女性生殖道最常见的恶性肿瘤之一。随着社会经济的发展,人们生活方式、饮食结构的改变以及雌激素等药物的广泛使用,子宫内膜癌发病率呈逐年上升趋势[1]。研究表明,酪氨酸激酶受体(RON)异常表达导致自身磷酸化,激活下游通路,而下游通路RON/磷酯酰肌醇3-激酶(PI3K)是蛋白质合成的主要信号调节通路,该通路激活后可以产生一系列级联反应,从而促进细胞的增殖、侵袭、转移[2]。目前国内尚无RON/PI3K信号通路在子宫内膜癌中表达的相关报道。本研究通过检测RON/PI3K信号通路在子宫内膜癌中的表达,为设计新型靶向药物对该病患者进行精准治疗提供参考。
1 对象和方法
1.1 对象 收集2010年1月至2013年1月在温州市中西医结合医院妇产科住院的160例患者的子宫内膜组织,其中子宫内膜癌80例(子宫内膜癌组),不典型增生80例(不典型增生组);并收集同期20例因子宫肌瘤行全子宫切除术患者的正常子宫内膜组织(正常组)。本研究经温州市中西医结合医院医学伦理委员会批准通过,患者均签署知情同意书。
1.2 方法
1.2.1 试剂 兔抗人 RON(ab85063)、PI3K(ab32089)、磷酸化 PI3K(pPI3K)(ab182651)抗体均购自美国 Abcam公司,RT-PCR引物由大连TAKARA公司合成,ECL化学发光底物购自上海碧云天生物技术有限公司。
1.2.2 子宫内膜组织RON、PI3K和pPI3K蛋白表达水平检测 采用Western blot法。提取总蛋白,用BCA法测定总蛋白浓度。蛋白上样量50μg,12%SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉室温封闭2h,TBST冲洗15min×3次。加入兔抗人RON(1:2 500稀释)、PI3K(1∶5 000稀释)、pPI3K(1∶5 000 稀释)抗体,室温孵育1.5h,4℃冰箱过夜。TBST 冲洗15min×3次,加入二抗(1:5 000),室温孵育1.5h,TBST冲洗10min×3次。加入ECL化学液,成像仪上进行曝光获得凝胶图像。应用Image J软件对目的蛋白和内参蛋白的灰度值进行分析,计算出目的蛋白的相对表达水平(目的蛋白与内参蛋白灰度值的比)。
1.2.3 子宫内膜组织RON和PI3K mRNA表达水平检测 采用RT-PCR法。严格按照Trizol RNA试剂盒说明提取总RNA,并将RNA反转录为cDNA。以同一cDNA为模板,PCR反应体系为20μl,反应条件如下:95℃预变性 30s;95℃ 5min,60℃ 30min,72℃ 1min,40个循环;最后72℃延伸7min,至反应结束。引物序列:RON 上游引物:5′-AAGGATGTGCTGATTCCCCA-3′,下游引物:5′-TACCAATGAGAGCCAGCACA-3′;PI3K 上游引物:5′-CCTATTGTCGTGCATGTGGG-3′,下游引物:5′-AATCTGGTCGCCTCATTTGC-3′;GAPDH 上游引物:5′-AGAGCTACGAGCTGCCTGAC-3′,下游引物:5′-AGCACTGTGTTGGCGTACAG-3′。以 GAPDH作为内参,RT-PCR反应结束后得出目的基因及内参基因的Ct值,采用 2-ΔΔCt法进行相对定量,每样本重复3次,最后取平均值。
1.3 子宫内膜癌患者术后随访 采用电话及定期复查的方式随访,随访截止时间为2018年12月30日,以死亡或复发、转移为随访终点。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组子宫内膜组织RON、PI3K和pPI3K蛋白表达水平比较 与正常组比较,子宫内膜癌组和不典型增生组RON和pPI3K蛋白表达水平均上升,PI3K蛋白表达水平均下降,差异均有统计学意义(均P<0.05)。与不典型增生组比较,子宫内膜癌组RON和pPI3K蛋白表达水平均上升,PI3K蛋白表达水平下降,差异均有统计学意义(均P<0.05),见表1和图1。
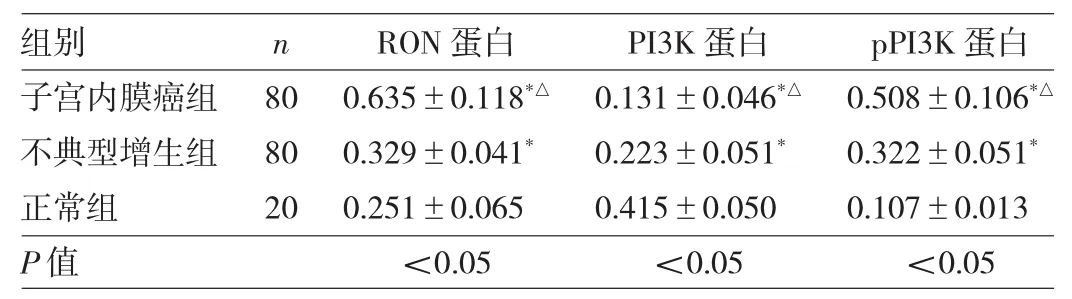
表1 3组子宫内膜组织RON、pPI3K和PI3K蛋白表达水平比较
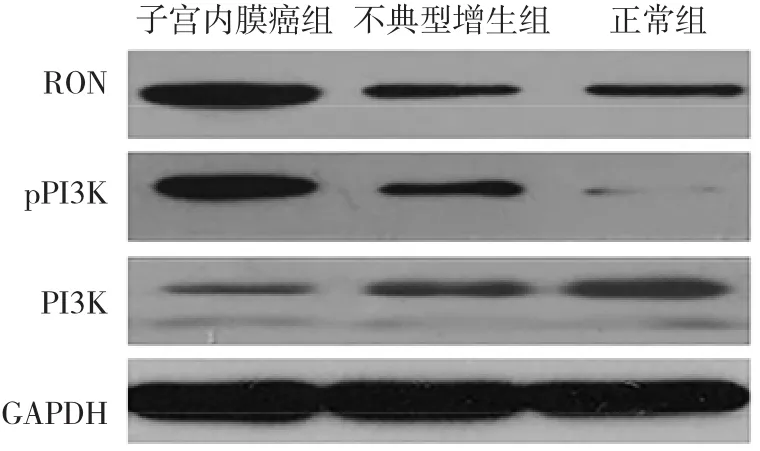
图1 3组子宫内膜组织RON、PI3K和pPI3K蛋白表达的电泳图
2.2 3组子宫内膜组织RON和PI3K mRNA表达水平比较 与正常组比较,子宫内膜癌组和不典型增生组RON和PI3K mRNA表达水平均下降,差异均有统计学意义(均P<0.05)。与不典型增生组比较,子宫内膜癌组RON和PI3K mRNA表达水平均下降,差异均有统计学意义(均P<0.05),见表 2。
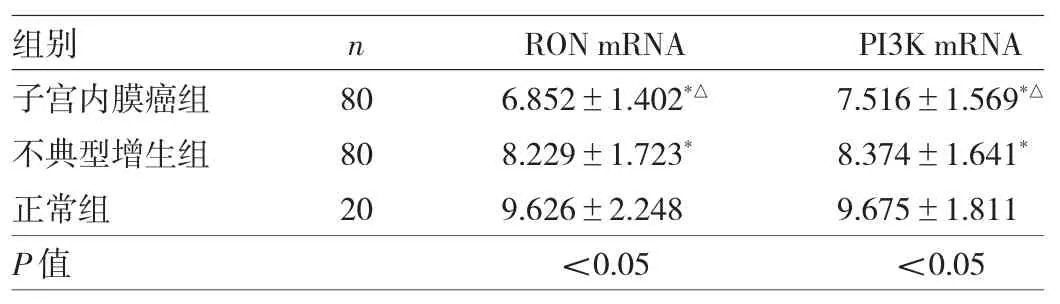
表2 3组子宫内膜组织RON和PI3K mRNA表达水平比较
2.3 子宫内膜癌患者术后随访情况 子宫内膜癌患者术后随访时间为1~60个月,中位生存期为44个月。死亡15例,复发/转移3例,无瘤生存62例。
3 讨论
肿瘤的侵袭和转移是一个动态生物学过程,涉及多种分子的异常表达和相关信号传导通路的调控。RON属于人类受体酪氨酸激酶家族(RTK)中的Met原癌基因亚家族,其生物学效应主要是通过与巨噬细胞刺激蛋白(MSP)结合而活化,介导多种细胞内信号级联反应,在调节细胞生长、增殖、表型转化、侵袭迁移等多个方面起到重要作用[3]。本课题组前期研究发现RON蛋白在正常子宫内膜组织、不典型增生子宫内膜组织和子宫内膜癌组织中表达水平呈递增趋势;Cox单因素回归分析显示,子宫内膜癌患者的预后与肿瘤组织学分级、c-Met/RON异常表达、c-Met/RON共同高表达有关;Cox多因素回归分析显示,肿瘤组织学分级高(低分化)、c-Met/RON共同高表达是子宫内膜癌预后不良的独立危险因素[4]。此外,本课题组在实验中还发现,RON及其下游PI3K信号通路的异常激活[4]。这个结果与Bieniasz等[5]提出在缺氧状态下RON可通过激活PI3K介导细胞增殖、存活、迁移参与肿瘤的发生的研究结论一致。
PI3K存在于细胞质中,是磷脂激酶家族中的一个重要成员[6],具有脂类激酶活性与蛋白激酶活性。PI3K主要从酪氨酸激酶连接受体传递信号,当RON与特异性配体MSP结合后,通过RON受体分子二聚化而产生自身激酶域的磷酸化,与p85α上的SH2区结合,引起PI3KⅠA二聚体构象改变而激活PI3K[7]。PI3K激活后在质膜上产生第二信使三磷酸磷脂酰肌醇(PIP3),PIP3通过与Ak的N端PH结构域结合,将蛋白激酶B(Akt)转位于细胞膜上。同时,在3-磷酸肌醇依赖性激酶1(PDK1)协助下,催化 Akt蛋白的苏氨酸磷酸化位点(Thr308)磷酸化,并通过3-磷酸肌醇依赖性激酶2(PDK2)催化丝氨酸磷酸化位点(Ser473)磷酸化,从而最大限度激活Akt[8]。过度活化的Akt激活其下游哺乳动物雷帕霉素靶蛋白,可以引起肿瘤细胞的快速增殖、蛋白分泌增加、细胞周期加快、G1期时程缩短,从而促进肿瘤的迅速发生、发展[9-11]。因此,RON/PI3K信号通路是蛋白质合成的主要信号调节通路,参与细胞增殖、分化、迁移等的调节。目前已有研究发现RON及其下游信号通路的异常激活(如PLCγ/DAG/PKC通路、PI3K/Akt通路、Ras/Raf/MAPK通路等)与膀胱癌、乳腺癌、卵巢癌、胆管癌、前列腺癌等[12-16]多种恶性肿瘤的发生、发展密切相关,有可能成为肿瘤治疗的一个潜在的重要靶点,因而备受关注。RT-PCR法证实,与不典型增生组和正常组比较,子宫内膜癌组RON和PI3K mRNA表达水平均下降,表明RON/PI3K与子宫内膜癌发生、发展有密切关系。
RON/PI3K牵涉各种肿瘤的进展和转移,包括黏附、侵袭、迁移、增殖、抑制凋亡。Ling等[2]研究RONΔ165E2变异体通过张力蛋白同源蛋白(PTEN)磷酸化激活PI3K/AKT通路,促使肿瘤的发生,在67例人类结直肠癌样本中,约58%的样本存在该变异体高表达,并且与肿瘤浸润深度也呈正相关。Liu等[17]发现短小RON能通过PI3K信号通路来自发主动地引起乳腺癌细胞的转移。PI3K通常以无活性的方式存在细胞质中,受到一些基因刺激后pPI3K磷酸化激活,进一步激活其下游因子如B细胞淋巴瘤因子2(Bcl-2)家族、p53、叉头转录因子等,从而促进肿瘤细胞的调亡、增殖、分化及迁移。本研究Western blot法检测结果显示RON和pPI3K蛋白在子宫内膜癌组表达最高,而在不典型增生组表达量较少,正常组最弱,提示RON和pPI3K表达量随着子宫内膜癌的进展是逐渐增加的,其肿瘤恶性程度越高,pPI3K磷酸化越明显,进一步证实RON通过刺激pPI3K磷酸化,激活PI3K信号通路途径促进子宫内膜癌的浸润、转移。
综合文献证据和本课题研究结果,可以认为RON/PI3K与子宫内膜癌的发生、发展相关,两者有可能作为肿瘤标志物用于子宫内膜癌的诊断和治疗,这为笔者了解RON调控子宫内膜癌转移的机制拓展了思路,同时也为子宫内膜癌转移机制的研究和相关靶向新药物的研发提供新的启示。
