6个假肥大型肌营养不良家系的产前诊断
2019-08-14徐晨阳项延包李焕铮周丽丽徐云芝张康梁徐雪琴
徐晨阳 项延包 李焕铮 周丽丽 徐云芝 张康梁 徐雪琴
假肥大型肌营养不良为常见的原发于肌肉组织的X连锁隐性遗传病,活产婴儿中发病率约为1/3 500[1],患者以男性多见,主要表现为渐进性的肌肉萎缩,站立和行走困难,可累及心脏,部分患儿存在智力障碍[2]。根据临床表型又可分为较严重的杜氏进行性肌营养不良(Duchenne muscular dystrophy,DMD)和较缓和的贝氏进行性肌营养不良(Becker muscular dystrophy,BMD)。患儿携带的患病基因大多遗传自父母,约1/3为新发突变[3]。其发病基因DMD即编码抗肌萎缩蛋白基因位于X染色体p21.2p21.1区域,全长2.4Mb,包含87个外显子,是目前已知最长的基因。约60%患者存在DMD基因外显子缺失,缺失热点为外显子E3-19以及E45-54[4];10%患者存在DMD基因外显子重复,其余患者为点突变、剪切体变异或小的插入/缺失变异[5-7]。本病的临床诊断主要依靠患者临床表型、病理检查和分子诊断等。分子诊断具有创伤小、快速、准确等优点,在临床上尤其适用于产前诊断预防患儿出生。本研究联合多重连接依赖探针扩增技术(multiples ligation-dependent probe amplification,MLPA)、单体型连锁分析及短串联重复序列(short tandem repeats,STR)位点检测对6个假肥大型肌营养不良家系行DMD基因诊断和产前分子诊断,旨在为上述家系的遗传咨询提供理论依据。
1 对象和方法
1.1 对象 本研究通过温州市中心医院医学伦理委员会批准,遵循知情同意原则收集2016年至2018年于本院遗传门诊行产前遗传咨询的6个假肥大性肌营养不良家系(图1)的临床资料,该6个家系先证者均为男性,平均就诊年龄10岁,均表现为双下肢肌无力,经本院或其他医疗机构临床诊断为进行性肌营养不良。其中家系3先证者主要临床表现为走路缓慢、下蹲困难,家系6先证者临床表现为无法站立及抬臂,其余4个家系先证者表现为行走不良。6个家系待检孕妇均为先证者母亲,仅家系3中孕妇口述偶发肌肉酸痛及痉挛,其余5个家系的孕妇均无明显临床表现。另外家系1曾于2013年至本院行首次产前诊断[8],家系2曾于2015年至本院行首次产前诊断,结果均诊断为男性患胎,孕妇最终选择终止妊娠。本次研究期间行产前诊断的胎儿共6例,于孕妇妊娠11~13周取胎儿绒毛样本适量或妊娠18~23周取胎儿羊水10ml,同时采集先证者及孕妇外周静脉血2ml。
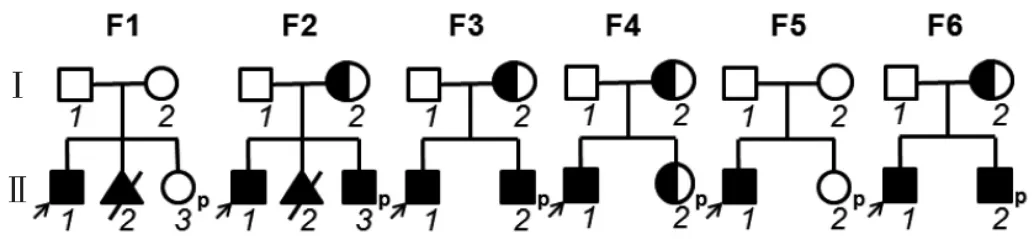
图1 6个假肥大性肌营养不良家系图[从左到右依次为家系(F)1、2、3、4、5、6]
1.2 研究方法
1.2.1 核酸提取 外周血基因组DNA提取采用Qiagen公司的QIAamp Blood Mini Kit试剂盒,胎儿绒毛基因组DNA提取采用厦门艾德生物的核酸提取试剂盒,胎儿羊水基因组DNA提取采用厦门恺硕生物的DNA提取试剂盒(110型),抽提出的DNA于Thermo Scientific的 NanoDrop 2000c进行精确定量,并对DNA质量进行评估。1.2.2 MLPA检测 采用荷兰MRC-Holland公司的SALSA MLPA试剂盒P034、P035对孕妇、先证者及胎儿样本进行MLPA检测,按说明书进行变性、杂交、连接和PCR。PCR产物与LIZ-500及去离子甲酰胺按比例混合,在ABI公司的3130自动化基因分析仪上进行毛细管电泳,原始数据应用Coffalyser软件分析处理,得出基因相对拷贝数比值。根据试剂盒说明,正常拷贝数比值范围为0.70~1.30。
1.2.3 单体型连锁分析 针对DMD基因序列内部及上下游区域8个单体型较高的STR位点,设计并合成荧光标记引物,采用ABI公司的3130自动化基因分析仪及GeneMapper分析软件对6个家系的先证者、孕妇及胎儿进行单体型连锁分析。
1.2.4 STR位点检测 采用上海天昊医药的Human Personal Identification Detection Kit试剂盒进行STR位点检测确认胎儿样本亲缘性并排除母源污染,在ABI公司的3130自动化基因分析仪上分别对6例胎儿及孕妇DNA 样本的 16个 STR 位点(D5S818、D7S820、D8S588、D13S317、D16S539、D18S51、D8S1179、D2S1338、THO1、G4S0001、G2S0002、vWA、G15S0001、G5S0001、G7S0005和G10S0001)进行测定,然后用GeneMapper软件自动分析等位基因的基因型。
2 结果
2.1 MLPA检测结果 6个家系成员MLPA检测DMD基因的结果和妊娠结局见表1。
由表1可见,6例先证者中外显子缺失型5例,分别为E51缺失、E56-66缺失、E46-47缺失、E10-52缺失、E49-51缺失,重复型1例为E3-7重复;6例患者母亲中 4 例为缺失型携带者,2 例(F1:Ⅰ-2、F5:Ⅰ-2)DMD基因未检出异常;研究期间共6例胎儿行产前分子诊断,其中缺失型男性患胎 3 例(F2:Ⅱ-3、F3:Ⅱ-2、F6:Ⅱ-2),正常女胎 2 例(F1:Ⅱ-3、F5:Ⅱ-2),携带者女胎 1 例(F4:Ⅱ-2)。各家系DMD基因的MLPA检测图谱见图2。
2.2 连锁分析结果 对孕妇、胎儿和先证者进行单体型连锁分析,结果显示胎儿F2:Ⅱ-3、F3:Ⅱ-2及已终止妊娠的F1:Ⅱ-2、F2:Ⅱ-2于X染色体有1种单体型,F4:Ⅱ-2有2种单体型,遗传的母源X染色体单体型均与先证者一致,与MLPA结果相符;胎儿F5:Ⅱ-2有2个单体型,遗传的母源X染色体单体型与先证者不一致,亦与MLPA结果相符。
家系1胎儿F1:Ⅱ-3遗传的母源X染色体单体型与先证者F1:Ⅱ-1一致,但MLPA检测结果与其母亲相同为未见拷贝数异常,而F1:Ⅱ-2与先证者单体型一致且均为缺失型患者,详见表2。
家系6胎儿F6:Ⅱ-2与先证者F6:Ⅱ-1均有1种单体型,表示男性胎儿。两者进行连锁分析的8个位点中有6个位点一致,2个位点不一致,详见表2。
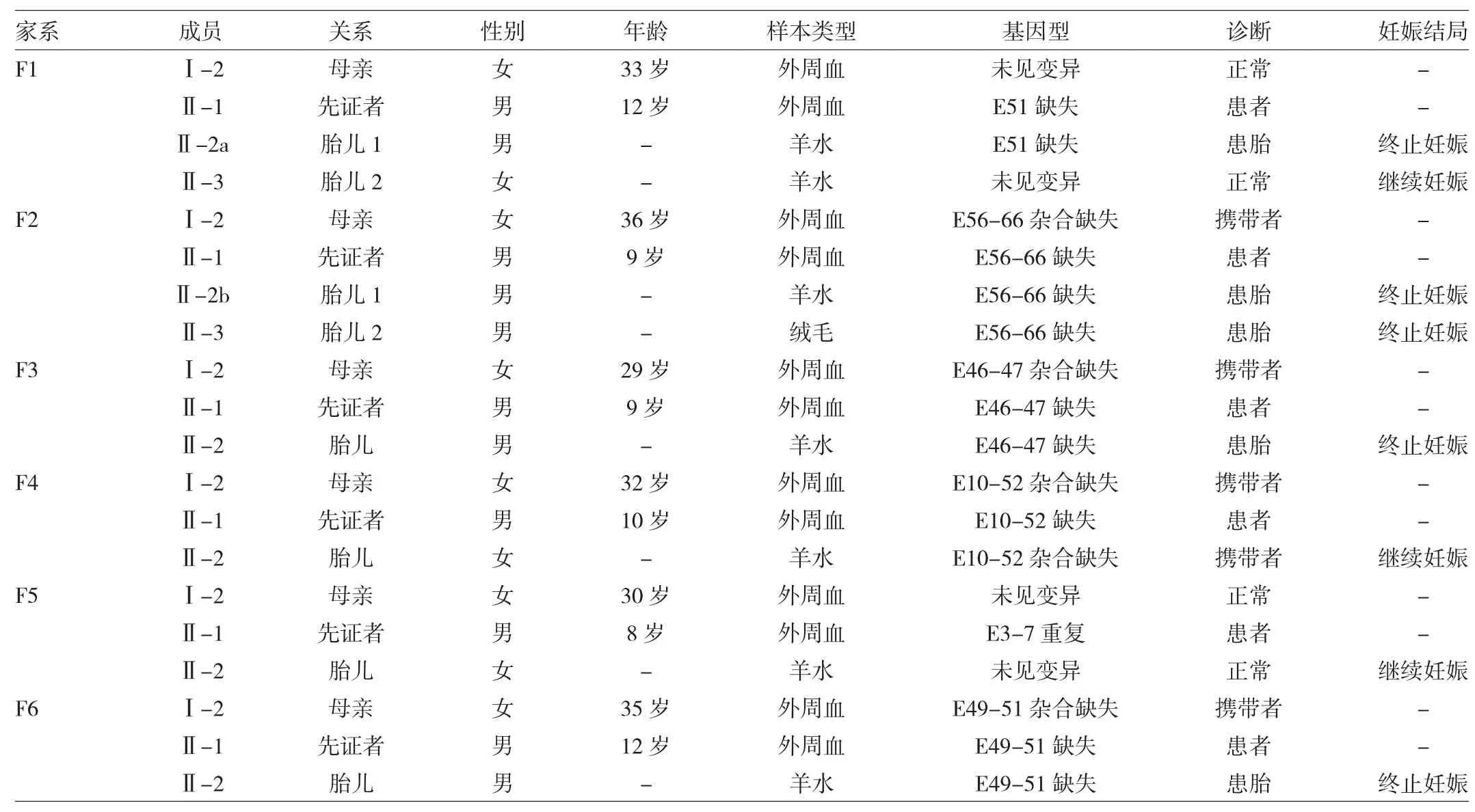
表1 各家系成员DMD基因MLPA检测结果

图2 各家系DMD基因的MLPA检测图谱(a:家系1的E51缺失;b:家系2的E56-66缺失;c:家系3的E46-47缺失;d:家系4的E10-52缺失;e:家系5的E3-7重复;f:家系6的E49-51缺失)

表2 家系1、6的单体型连锁分析结果
2.3 STR位点检测 本次研究采集胎儿羊水样本5例,绒毛样本1例。比对各胎儿样本与孕妇外周血DNA的STR位点,结果显示6例胎儿样本,分别有12、10、10、9、11、9 个位点可以排除母源污染。
3 讨论
DMD基因位于Xp21.2p21.1区域,全长2.4Mb,包含87个外显子,是目前已知最长的基因。DMD基因突变频率高和突变形式多样的形式多样,其中缺失突变占55%~65%,重复突变占5%~10%,其他微小突变约占25%~30%[4-6]。本次研究未发现微小突变,纳入的6个家系均为缺失重复突变,且以缺失突变为主,占5例(5/6),重复突变仅1例(1/6)。5例缺失突变中家系1存在DMD基因E51缺失,家系3存在E46-47缺失,家系4存在E10-52缺失,家系6存在E49-51缺失,均涉及缺失热点区域外显子 E45~54(4/5)。
5例缺失型先证者年龄相近,其中先证者(F6:Ⅱ-1)表现为重型的上下肢肌无力(3个外显子缺失),先证者(F1:Ⅱ-1、F2:Ⅱ-1、F4:Ⅱ-1)表型相对较轻,肌无力暂不累及上肢(分别有1、11、43个外显子缺失),先证者(F3:Ⅱ-1)临床表型最轻,能缓慢行走(2个外显子缺失),这5例家系无明显的表型严重程度和缺失范围的相关性。DMD/BMD为X连锁隐性遗传病,患者以男性多见,女性为携带者,但由于X染色体的随机失活,约20%女性会存在轻微的临床表型,如肌无力、心脏受累、认知功能障碍、肌肉疼痛或痉挛等[9]。该机制可能为先证者母亲(F3:Ⅰ-2)存在的肌肉酸痛及痉挛提供一种解释,但由于未进一步进行血清肌酶、心电图、肌电图等相关检测,因此不排除其他偶发因素。
文献表明DMD患者中约1/3为新发突变,2/3源自遗传[2],又有文献表明新发突变中14%是由于生殖腺镶嵌体导致[10],生殖腺镶嵌体本身通常不发病,但可产生正常和异常两种配子。通过对6例孕妇外周血的基因检测,发现孕妇(F1:Ⅰ-2、F5:Ⅰ-2)的DMD基因均未见变异,表明这2例先证者可能为新发突变或其母亲为生殖腺镶嵌体。其中孕妇(F1:Ⅰ-2)与本次腹中女胎(F1:Ⅱ-3)均未携带变异,并且女胎(F1:Ⅱ-3)的其中1种单体型与先证者相同,但从该孕妇曾连续孕有两胎相同基因突变患儿(F1:Ⅱ-1、F1:Ⅱ-2),可推测该家系先证者新发突变可能性较低,而其母亲为该缺失型突变的生殖腺镶嵌体可能性高。因此,对于先证者为新发突变型DMD基因患者,尽管其母亲非相同突变携带者,但仍不能排除生殖腺镶嵌体可能,再次妊娠时需进行产前基因诊断[11]。
目前,国内外常用的DMD/BMD分子检测技术包括多重PCR技术、MLPA技术、直接测序法、NGS、单体型分析等[12-14]。前两者适用于DMD基因缺失/重复突变的检测,直接测序法适用于微小突变的检测,NGS可同时检测缺失、重复和点突变,但目前该技术成本昂贵且费时较长,尚未广泛应用于DMD基因检测[15],而单体型分析更适合作为信息完整家系的辅助诊断技术。运用STR单体型连锁分析诊断DMD基因的局限性在于无法排除 5%-10%的基因内重组[6,16],本研究中胎儿(F6:Ⅱ-2)与先证者(F6:Ⅱ-1)存在2个STR位点不一致,表明该家系DMD基因内发生了联会交换,只采用单体型连锁分析无法准确进行产前诊断。
综上所述,不同临床背景的家系采用不同技术方法的组合可以提高检出率。本次研究采用MLPA技术对6个家系进行DMD基因检测明确了该6个家系的基因型,同时结合单体型连锁分析确保了产前诊断的准确性,为进一步的遗传咨询和诊疗提供可靠的依据。
