RanBPM调控IFN-λR1-STAT5通路分子机制研究
2019-08-12张俊文赵乔佳杰黄秉仁刘福生
张俊文 赵乔佳杰 杨 霞 马 雯 黄秉仁 刘福生
Ⅲ型干扰素(interferon λs,IFN-λs)是重要抗病毒、抗肿瘤细胞因子[1]。IFN-λs的受体是由白介素10受体2(interleukin 10 receptor 2, IL-10R2)和干扰素λ受体1(IFN receptors, IFN-λR1)组成的异源四聚体[2],虽然Ⅲ型干扰素与Ⅰ型干扰素结合的受体不同,但是它们均是通过激活Janus激酶(Janus kinase, Jak)-信号转导和转录激活因子(signal transducers and activators of transcription, STAT)来传递信号,因此Ⅲ型干扰素表现出与Ⅰ型干扰素类似的生物活性。典型的Jak-STAT信号通路依赖于STAT的磷酸化,干扰素结合其受体后引起Jak以及下游的STAT1和STAT2的磷酸化,与干扰素调节蛋白9(interferon regulatory factor 9, IRF9)组成复合体,形成干扰素刺激因子3(IFN-stimulated gene factor 3, ISGF3),进入细胞核启动基因的转录,发挥其抗病毒、抗增殖及抗微生物等活性[3, 4]。关于干扰素λ信号通路同干扰素α信号通路比较的区别,首先IFN-λR1不是普遍表达的,尤其在免疫细胞中其表达有明显的差别,所以免疫细胞对IFN-λ1更加敏感。此外,IFN-λ和IFN-λR结合亲和力与IFN-α的结合亲和力比较差异很大。最后,以单核苷酸多态性(single-nucleotide polymorphisms,SNP)形式出现的遗传变异与参与IFN-λ信号通路的级联反应有关,这与乙肝和丙肝病毒感染的临床进程和治疗关系密切[5]。
与Ⅰ型干扰素不同的是,IFN-λs还能诱导除STAT1以外的其他STAT的磷酸化,如STAT3和STAT5[6]。这就意味着IFN-λ信号途径比其他的IFN途径要复杂的多。前期研究发现在肝癌细胞系中IFN-λ1能够引起STAT5的磷酸化[7]。由此笔者推测IFN-λ1的受体IFN-λR1可能参与STAT5的相互作用。同时前期研究中笔者也发现IFN-λR1能与RAN蛋白在微管组织中心的结合蛋白(ran binding protein in the microtubule-organizing center, RanBPM又被称为RanBP9)相互作用,增强了干扰素刺激反应原件(IFN-stimulated response elements, ISRE)的活性,调控干扰素λ途径[8]。但是,RanBPM是否能与STAT5相互结合,进而调控其活性影响干扰素λ途径尚不清楚。本研究中笔者将以STAT5A为研究对象,明确RanBPM能否与其相互作用,以及相互作用后对IFN-λ信号途径的影响。
材料与方法
1.材料:人胚肾细胞株HEK293T、肝癌细胞株Huh7、Hep3B由本实验室保存。表达质粒pCMV-Myc、pFlag-CMV2、pFlag-IFN-λR1及其截短体质粒,pHA-RanBPM及其截短体质粒,pMyc-STAT5A,报告基因质粒pGL3-basic、pSTAT5-luc、pRL-SV40由本实验室保存或构建。胎牛血清、DMEM、PBS、0.05%胰酶、青霉素/链霉素和转染试剂Lipofectamine 3000购自美国Invitrogen公司;重组人干扰素lambda1(rhIFN-λ1)由本实验室纯化;双荧光素报告基因试剂购自美国Promega公司;蛋白酶抑制剂购自瑞士Roche公司;Protein A/G-琼脂糖介质购自美国GE公司;anti-Flag和anti-HA、抗体购自美国Sigma公司,anti-Myc抗体购自美国Santa Cruz公司。
2.细胞培养:HEK 293T、Huh 7或Hep 3B细胞培养于DMEM培养基中(含10%胎牛血清、100U/ml青霉素、100μg/ml链霉素),在含5%CO2的37℃恒温培养箱培养。细胞用含0.05%胰蛋白酶消化、传代,待细胞增殖旺盛、状态良好时进行实验。
3.细胞转染和rhIFN-λ1处理细胞:消化细胞,将细胞传到6孔板或96孔板后,细胞汇合度达到80%左右,可以进行细胞转染。细胞转染前2h,将培养基更换为含3%胎牛血清的DMEM培养基,然后按照Lipofectamine 3000说明书进行转染。转染6h后将培养基更换含10%胎牛血清的常规培养基。细胞转染24h之后,弃掉旧培养基,细胞用PBS洗3次。然后再细胞中加入含3%胎牛血清的DMEM培养基,放置到37℃恒温培养箱中继续培养2~4h,然后加入rhIFN-λ1(终浓度为200ng/ml)处理相应的时间。
4.细胞裂解和免疫共沉淀:细胞转染24h后,观察细胞状态以及细胞数量。配置新鲜的细胞裂解液(含150mmol/L NaCl,50mmol/L Tris-HCl pH值为7.6,1% NP-40,10% glycerol,蛋白酶抑制剂)。弃掉细胞培养基,然后用PBS洗细胞,加入适量的细胞裂解液。用细胞刮棒将细胞刮下,将细胞放置在冰上15min,然后12000r/min离心10min。取离心上清液,测量蛋白浓度。取1/10裂解液体积作为参照物(input),用于检测细胞裂解液中各个目的基因的表达情况。取400μg总蛋白,首先用与免疫共沉淀抗体同属种的IgG进行预处理1h,然后再加入1μg免疫共沉淀的抗体,放置到4℃混匀仪上过夜。然后加入40μl protein A/G-Sephorose 介质,4℃继续孵育1h。然后3000r/min离心2min,弃上清,用细胞裂解液洗涤介质,15分/次,洗涤2次;加入上样缓冲液,混匀后在沸水中使蛋白变性。根据目的蛋白的相对分子质量,配置不同浓度的SDS-PAGE分离蛋白,Western blot法检测目的蛋白的表达。
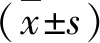
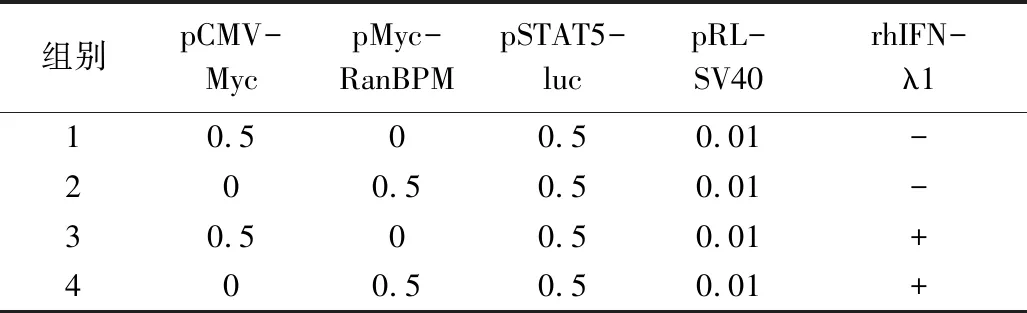
表1 双荧光素酶报告基因实验中各组每孔转染质粒量(μg)
结 果
1.IFN-λR1中含有两个STAT5的结合位点:生物信息学分析显示IFN-λR1中有两个STAT5A的结合位点,分别是位于343~346的“YIEP”氨基酸残基和位于406~409的“YLAE”氨基酸残基(图1A)。IFN-λR1中227~249氨基酸为其跨膜结构域,根据STAT5结合位点所在的位置将IFN-λR1膜内区IFN-λR1-ICD分成IFN-λR1-ICDΔ1和IFN-λR1-ICDΔ2。
STAT5A与IFN-λR1、IFN-λR1-ICD、IFN-λR1-ICDΔ1和IFN-λR1-ICDΔ2的免疫共沉淀实验结果显示STAT5A与IFN-λR1中的两个截短体IFN-λR1-ICDΔ1和IFN-λR1-ICDΔ2都能相互作用,IFN-λR1含有两个STAT5A的结合位点(图1B)。
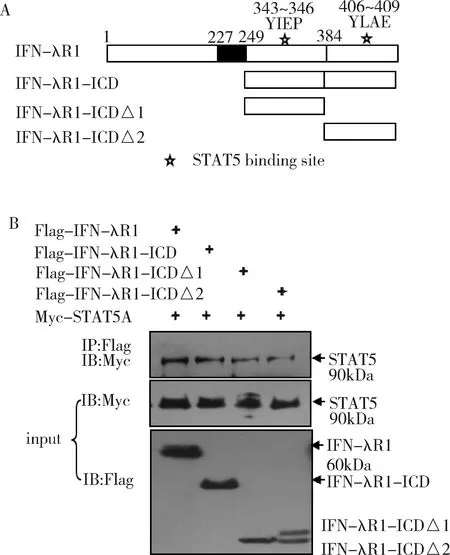
图1 IFN-λR1中含有两个与STAT5A相互作用的位点
A.IFN-λR1截短体示意图,227~249IFN-λR1为跨膜结构域,343~346IFN-λR1和406~409IFN-λR1为预测的STAT5结合位点;B.STAT5A与IFN-λR1截短体的相互作用
2.RanBPM与STAT5A相互作用的鉴定:采用免疫共沉淀的方法检验了RanBPM与STAT5A的相互作用(图2A)。然后对RanBPM的结构域进行分析,发现RanBPM中也有两个STAT5A的结合位点,分别是位于177~180的“YIGL”氨基酸残基和位于526~529的“YCHS”氨基酸残基,其中“YIGL”位于氨基端的脯氨酸富集区结构域(pro-rich domain),“YCHS”位于CTLH结构域和CRA结构域中间(图2B)。STAT5A与RanBPM的截短体质粒共转染后,免疫共沉淀结果显示含有STAT5A结合位点的截短体RanBPM-N和RanBPM-C与STAT5A相互作用(图2C)。
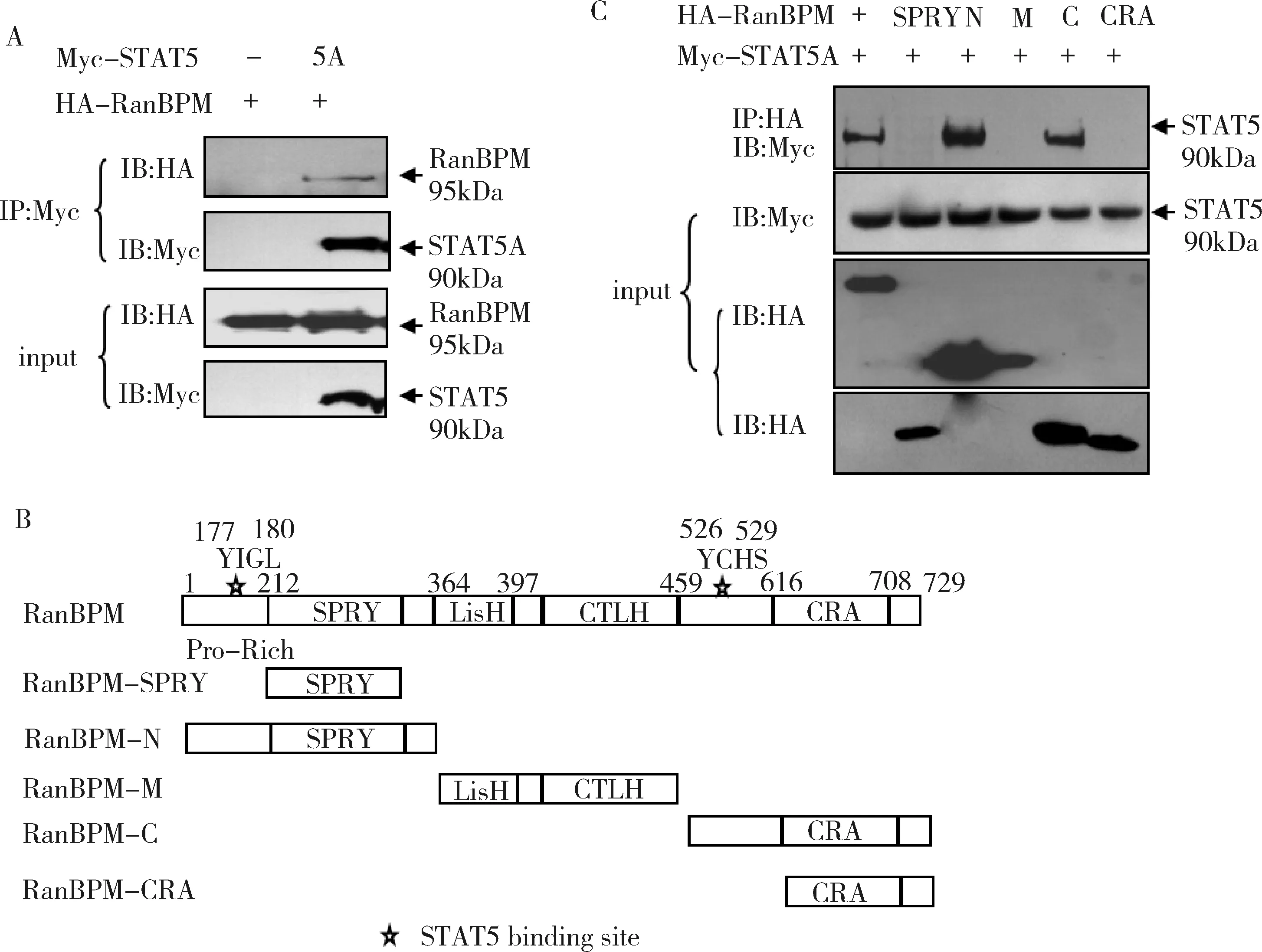
图2 RanBPM中与STAT5A 相互作用结构域的鉴定
A.STAT5A和RanBPM的相互作用;B.RanBPM截短体示意图,RanBPM中含有5个结构域,177~180RanBPM和526~529RanBPM是预测的STAT5的结合位点;C.STAT5A和RanBPM各个截短体的相互作用
3.RanBPM影响IFN-λR1与STAT5A的相互作用:IFN-λR1、STAT5A和RanBPM能形成一个蛋白复合体,但尚不清楚IFN-λR1的配体IFN-λ1对这个蛋白复合体的形成有何作用。IFN-λR1、STAT5A和RanBPM共转染的情况下,加入IFN-λ1处理12h后,免疫共沉淀与IFN-λR1结合的蛋白。RanBPM增强IFN-λR1与STAT5A的结合;加入IFN-λ1刺激后,IFN-λR1与RanBPM,以及IFN-λR1与STAT5A之间的相互作用都明显增强,但是转染RanBPM组的相互作用更强(图3)。
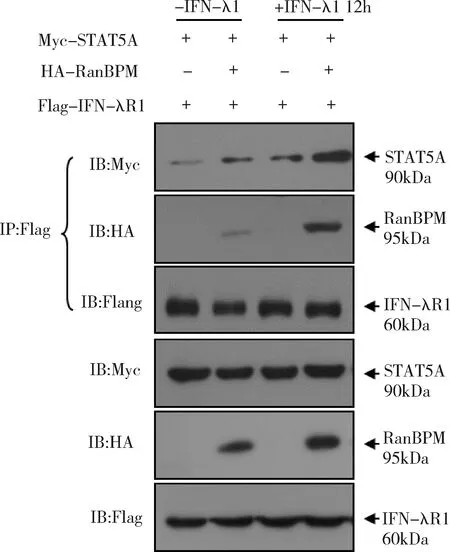
图3 RanBPM增强了IFN-λR1和STAT5的相互作用
4.RanBPM影响STAT5A报告基因活:为了检测STAT5A和RanBPM相互作用后对STAT5A转录能力的影响,采用双荧光素报告基因实验检测了STAT5A的转录能力。在两株肝癌细胞Huh 7和Hep 3B细胞中,在转染RanBPM后,增强了STAT5A的双荧光素酶报告基因活性;同时,在加入IFN-λ1刺激后STAT5A双荧光素酶报告基因活性明显增强,差异有统计学意义(图4,P<0.05)。
讨 论
干扰素根据其受体的特征,可将干扰素分为Ⅰ、Ⅱ和Ⅲ 3种类型。Ⅰ型干扰素如IFN-α已在在临床上广泛用于黑色素瘤、肾癌、毛细胞性白血病、慢性骨髓性白血病、淋巴瘤和卡波西肉瘤等多种肿瘤的治疗[9]。
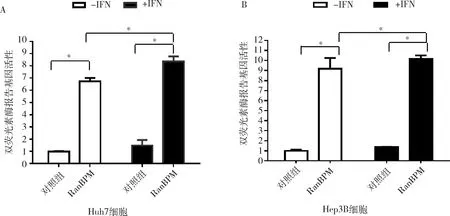
图4 RanBPM增强了STAT5A报告基因活性
A.在huh7细胞利用双荧光素酶报告实验检测RanBPM对STAT5A报告基因活性的影响;B.在Hep3B细胞中利用双荧光素酶报告实验检测RanBPM对STAT5A报告基因活性的影响。*P<0.05
IFNλ包括3个家族成员IL-28a(IFN-λ2)、IL-28b(IFN-λ3)以及IL-29(IFN-λ1),他们具有类似的结构[10]。相对于Ⅰ型干扰素,上皮细胞中更容易表达IFN-λ1,因此上皮细胞中IFN-λ1的特异性受体IFN-λR1也是高表达的,因此IFN-λ1被认为是上皮来源的细胞因子[11]。IFN-λ1在体内外表现出抗病毒,抑制肿瘤增殖以及免疫调节的能力。同时,IFN-λR1的表达与Ⅰ型干扰素受体不同,具有组织特异性,其在骨髓造血细胞及脑、脊髓中枢神经细胞表达量很低,与目前临床上普遍应用的IFN-α比较,在发挥生物活性的同时有效地减少发热、抑郁及骨髓抑制等不良反应[12]。这也使得IFN-λ可望成为一种新型的免疫生物制剂。因此,深入研究IFN-λ信号通路中除了活化JAK-STATs等已知的信号途径外,是否还有其他的信号分子参与调控干扰素的生物学活性或其信号途径,对于指导其临床应用具有重要的指导作用。
实验室前期研究发现IFN-λR1能够与RanBPM相互作用,RanBPM参与调控IFN-λ信号途径,是新的调控干扰素途径的蛋白。本研究通过生物信息学的分析发现IFN-λR1中含有两个与STAT5A结合的位点,通过免疫共沉淀实验发现含有结合位点的截短体参与STAT5A的相互作用;通过分析RanBPM的结构域发现,存在两个与STAT5A相互作用的位点,分别位于氨基端的脯氨酸富集区以及CTLH结构域和CRA结构域中间;免疫共沉淀实验证实RanBPM与STAT5A相互作用。
RanBPM在细胞中广泛表达,是细胞质、细胞核之间的穿梭蛋白,具有核定位和出核序列,更有利于RanBPM在细胞质-细胞核穿梭,但是其功能尚不完全清楚[13]。现在普遍认为RanBPM是一个脚手架蛋白,介导细胞中多个蛋白的相互作用[14]。RanBPM由4个结构域组成,分别是氨基端富含脯氨酸的结合SH3的结构域,中间的SPRY结构域和LiSH/CTLH结构域,以及羧基端的CRA结构域。SPRY和CRA两个结构域介导了与多个蛋白的相互作用,其中包含多个受体如雄激素受体、糖皮质激素受体和甲状腺受体等[15]。同时RanBPM还能与转录因子相互作用,调控其转录活性,如艾巴病毒早期蛋白Rta和Zta、TIP60等[16,17]。本研究发现,RanBPM中含有两个STAT5结合位点,这两个位点在SPRY和CRA结构域之外。这就丰富了RanBPM与转录因子相互作用位点,为RanBPM的转录共激活功能提供结构基础。
本研究发现,在IFN-λ1刺激下,IFN-λR1、RanBPM和STAT5A之间的相互作用会增强;双荧光素酶报告基因实验也证明了相互作用增强后,STAT5A的转录活性也会增强。哺乳动物中有7类STAT分子,分别是STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6,其中STAT5A和STAT5B蛋白的相似度约为91%[18]。STAT5A和STAT5B可被催乳素、生长因子、白介素、GMCSF等多种因子激活[19]。STAT5参与多个细胞功能调控过程,如细胞增殖、细胞分化等。STAT5参与调控NK(natural killer)细胞的成熟化过程,发挥免疫调节的功能[20]。同时STAT5A的异常激活会利于肿瘤细胞的存活和肿瘤的恶性进展,参与化疗抵抗过程。因此,IFN-λ治疗肿瘤的研究中,应考虑细胞中RanBPM对IFN-λ信号的调控作用以及对STAT5A作用,避免因其过度激活带来的不良反应。
