白细胞介素4和白细胞介素13与M2型肺泡巨噬细胞在肺纤维化中的作用研究进展
2019-08-12尹健彬
尹健彬,皮 娜,张 旋
(昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明650500)
肺纤维化(pulmonary fibrosis,PF)是一种治愈难度很大而且死亡率高的慢性间充质性肺病,其经多种刺激因子刺激而引起肺泡上皮细胞损伤、成纤维细胞增殖、成纤维细胞向肌成纤维细胞转化和胶原的形成并引起病理性的细胞外基质沉积,以及由于瘢痕的形成而致使肺结构发生进行性和不可逆性的破坏[1],导致气体交换受阻、肺功能急剧下降、呼吸困难等器官功能障碍[2],最终发展成为因呼吸衰竭而危及生命的纤维化间充质性肺病。虽然近些年对PF 治疗的研究有了长足的发展,但是对于PF发病机制的认识到目前仍不清楚,然而研究者们普遍认为,在这种疾病发生发展的许多形式中通常伴有炎症和免疫反应的过程[3],其中不乏包括肺泡巨噬细胞(alveolar macrophage,AM)参与的炎症反应和2 型辅助性T 细胞(type-2 helper T cell,Th2)参与的免疫反应。
白细胞介素4(interleukin-4,IL-4)和IL-13 主要是由CD4+T 细胞极化的Th2 细胞亚群分泌的炎性细胞因子[4]。有研究报道,IL-4和IL-13参与支气管哮喘的发生过程,是引起气道高反应性和持续炎症的始作俑者[5];对特发性PF 的临床研究发现,患者肺组织中的Th2 相关细胞因子分泌明显增多[6],在PF 动物模型上的研究更是体现出IL-4 和IL-13含量与PF存在正相关关系[7];骨髓来源并存在于外周血或周围组织中的单核细胞,是宿主防御和应对有害刺激的先天性免疫细胞,而AM 是肺内衍生的常驻细胞,具有吞噬和抗原提呈功能,能够防御外来病毒和微生物入侵,是肺内的第一道天然防线[8];当受到刺激时,这些新募集来的单核细胞和常驻AM在肺组织微环境中被遇到的介质激活,分化为促炎性的经典激活巨噬细胞(classically activated macrophages,M1)和抗炎性替代激活巨噬细胞(alternatively activated macrophages,M2)亚群。研究显示,在PF形成过程中,M2型巨噬细胞发挥着重要的作用[9]。为阐明这一关系,本文以近年来发表的国内外文献为依据,对IL-4和IL-13与M2型巨噬细胞在PF过程中的相互作用及影响进行综述。
1 Th2 相关细胞因子IL-4 和IL-13 与肺纤维化
机体的免疫应答有自限性内在调节的功能,从而避免自身过度免疫应答引起的损伤,以保证机体自身内环境的稳态,而其调节功能的发挥有赖于T细胞的参与[10]。研究发现,在外源性或自身免疫紊乱刺激下,使得机体自身异常的免疫反应贯彻于肺部炎症的启动、发展以及PF的整个过程,这让研究者们越来越认识到肺组织中的T细胞亚群及其分泌的细胞因子在维持免疫平衡中的重要性;免疫功能异常在肺部引起的炎症及其后续产生的纤维化,不得不让人们的目光从细胞水平转向炎性因子介导的分子水平。
在经不同抗原刺激后,CD4+T细胞可分化为表达不同细胞因子的效应细胞群即Th1和Th2细胞亚群,因其分泌不同的细胞因子而介导不同的免疫应答类型即Th1型和Th2型细胞因子反应[11],有研究认为二者之间存在着相互拮抗作用,1 型反应分泌的细胞因子在介导细胞免疫的同时拮抗2型反应的发展[12],而2 型反应又反过来抑制1 型反应和1 型反应驱动的炎症[13],从而保证2 个细胞亚群平衡和适度的免疫应答。Th2 细胞群主要分泌IL-4,IL-5,IL-6,IL-10和IL-13等细胞因子[11],以其为主介导的2 型免疫对机体既有保护作用[13]又有致病活性[14],Th2细胞因子的过度产生是许多过敏性和纤维化疾病发生发展的主要机制。自1995 年Wallace 等首次提出PF中存在“Th2优势”学说以来,不断有研究证实了这一观点。最新的报道称,碳纳米管诱导的PF其机制主要就是激活了Th2细胞以及诱导产生了Th2细胞因子(即Th2 优势),特别是IL-4 和IL-13[15]。Mojiri-Forushani等[16]的研究显示,缬沙坦对PF具有显著的保护作用,这种效应的有效途径是通过抑制博来霉素诱导的Th2细胞因子IL-4的产生来实现。
大量研究显示,纤维化的发生与Th2 型细胞因子的发展密切相关[17],其主要以IL-4 和IL-13 介导巨噬细胞的激活、成纤维细胞的增生和分化、ECM的沉积等最终导致PF 的形成(图1)。存在于AM和成纤维细胞等细胞膜表面的IL-4α 受体亚型(alpha subunit of IL-4 receptor,IL-4Rα)/IL-13Rα直接诱导着纤维化激活过程中的次级反应[17],而且证实这些受体驱动了IL-4 和IL-13 的信号传导,并增加巨噬细胞和成纤维细胞的迁移和侵袭性[17-18]。Zhang等[19]研究发现,CpG-寡脱氧核苷酸可以防止PF 的形成,进一步分析显示,其可能的机制是限制了Th2相关细胞因子(IL-4和IL-13)的表达,同时使Th1 相关细胞因子(IFN-γ 和IL-12)表达增加,巨噬细胞聚集减少等。更令人振奋的是,有直接的研究结果证明,当下调Th2 相关细胞因子时,可以阻止PF的进程[20]。
2 M2型肺泡巨噬细胞的抗炎和促纤维化作用

图1 T辅助性细胞及其亚群在肺纤维化中的作用.
巨噬细胞作为机体固有免疫的重要组成部分,参与包括炎症、免疫反应和纤维化在内的多种疾病的发生发展过程。根据巨噬细胞活化的二分法,巨噬细胞可分为M1 和M2,M1 主要由Th1 型细胞因子IFN-γ激活,主要参与Th1型免疫反应,其通过合成标志性因子诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)促进炎症反应;M2则由IL-4和IL-13 激活,从而上调1 型精氨酸酶(arginase type 1,Arg-1)、Fizzl、YM-1(几丁质酶家族成员)和甘 露 糖 受 体(mannose receptor,MR)等 标 志物[21-22]。有研究显示,在PF进程中,M1和M2之间存在相互拮抗性的平衡,即M1 以促炎和细胞毒性为主,M2 则以抗炎和促纤维化为主。值得注意的是,肺组织在由急性炎性损伤向慢性PF 转变过程也伴随着M1 向M2 的转变,并最终以M2 为主[23]。目前多数学者普遍认为,M1和M2的本质区别在于它们分泌的标记分子iNOS 和Arg-1 对底物L-精氨酸竞争代谢的问题,iNOS催化精氨酸生成NO和瓜氨酸,而Arg-1与精氨酸结合生成尿素和鸟氨酸;鸟嘌呤是胶原蛋白的前体,从而有利于胶原的形成及最终导致PF[24]。
有研究认为,炎性单核细胞衍生的M1是促M2的主要来源[25],然而这种前体关系的直接证据是有限的。当然更多的证据则认为肺中M2主要是来源于AM,当用平阳霉素(博来霉素)处理AM 缺陷的CSF-1 敲除小鼠时,表现出M2 的聚集减少[26]。即使这样,单核细胞和组织衍生的M2 还是能被有效地区分出来。研究显示[27],2 种来源的M2 都表达Arg1,Ym-1 和Fizz-1,但只有单核细胞衍生的M2表达PD-L2,Raldh2,CD206 和CX3CR1,这就为M2 来源的进一步探讨提供了有力的支撑。另外,在人和啮齿动物的纤维化发生过程中,积聚在肺部的M2已被确定为许多关键的促纤维化介质,如转化生长因子β(transforming growth factor-β,TGF-β),结缔组织生长因子(connective tissue growth factor,CTGF)和趋化因子配体18(chemokine ligand-18,CCL-18)的主要来源,M2也被认为通过释放TNF-α,IL-1,IL-10,IL-13,IL-33,PDGF,FGF和纤维连接蛋白促进纤维化,这些在PF 患者和纤维化肺病的动物模型中都有体现[28]。
3 IL-4 和IL-13 受体可能是治疗肺纤维化的有效途径
替代激活的巨噬细胞M2其激活通路存在多种途径,但本文主要阐述由IL-4 和IL-13 刺激并与其受体IL-4Rα 和(或)IL-13Rα 结合,从而发挥的作用。研究认为,IL-4Rα 和(或)IL-13Rα 以3 种不同的形式存在[29]:①IL-4Rα1与γ链(γc)结合形成的受体,主要与IL-4 识别;②IL-4Rα1 与IL-13Rα1 结合形成的受体,主要与IL-4或IL-13识别;在IL-4缺失的小鼠中并未显现出阻止了辐射小鼠中的替代巨噬细胞活化和纤维化[30],其可能原因是IL-4和IL-13存在共享/复合受体组分[16],从而使IL-4介导的效应以其他相类似的作用途径介导,以补偿方式刺激纤维化过程;③IL-13Rα2链受体,其与IL-13识别,但是目前IL-13Rα2 链受体的信号转导还存在争议。参与激活M2 的通路较多,主要包括NF-κB、c-Maf/信号转导和转录激活因子(signal transducer and activator of transcription,STAT)、c-MYC/STAT/过氧化物酶增殖物激活受体γ(peroxisome proliferatoractivated receptor-γ,PPAR-γ)[31]、干扰素调节因子(interferon regulatory factors,IRF)/STAT[32]、JAK/STAT 信号途径[33],但在PF及IL-4R和IL-13R分布的背景下,后3 者是有效的M2 激活途径(图2)。以Janus 激酶(Janus kinase/JAK/STAT)信号途径为例,IL-4 和IL-13 与其受体结合并激活JAK(JAK1和JAK3/JAK2),激活的JAK一方面募集胰岛素受体底物家族(insulin receptor substrates,IRS)与其形成复合物,进一步激活衔接蛋白生长因子受体结合蛋2(growth factor receptor bound-2,GRB-2)和磷脂酰肌醇3-激酶,从而募集STAT6 磷酸化;另一方面JAK可直接引起STAT6的磷酸化和易位;磷酸化后的STAT6 可与PPAR-γ 和Kruppel样因子4(Kruppel-like factor-4,KLF-4)结合使M2极化[21],最终产生Arg-1,而Arg-1 是形成M2 的标志[22]。可见,在PF 形成的IL-4和IL-13刺激通路中其受体扮演着至关重要的作用,有研究显示用IL-4刺激缺乏IL-4R的巨噬细胞群,其组织纤维化程度明显减少,预示着阻断IL-4R 和IL-13R 受体可能是治疗PF的有效途径[16,21]。
4 IL-4 和IL-13 激活的M2 型巨噬细胞对肺纤维化的双重作用
肺中存在多个巨噬细胞群,因其高度可塑性的特点而发挥不同的功能,尽管大多数研究认为IL-4和IL-13激活的M2型肺泡巨噬细胞和PF存在直接关系,但是还是有学者对此存在争议。
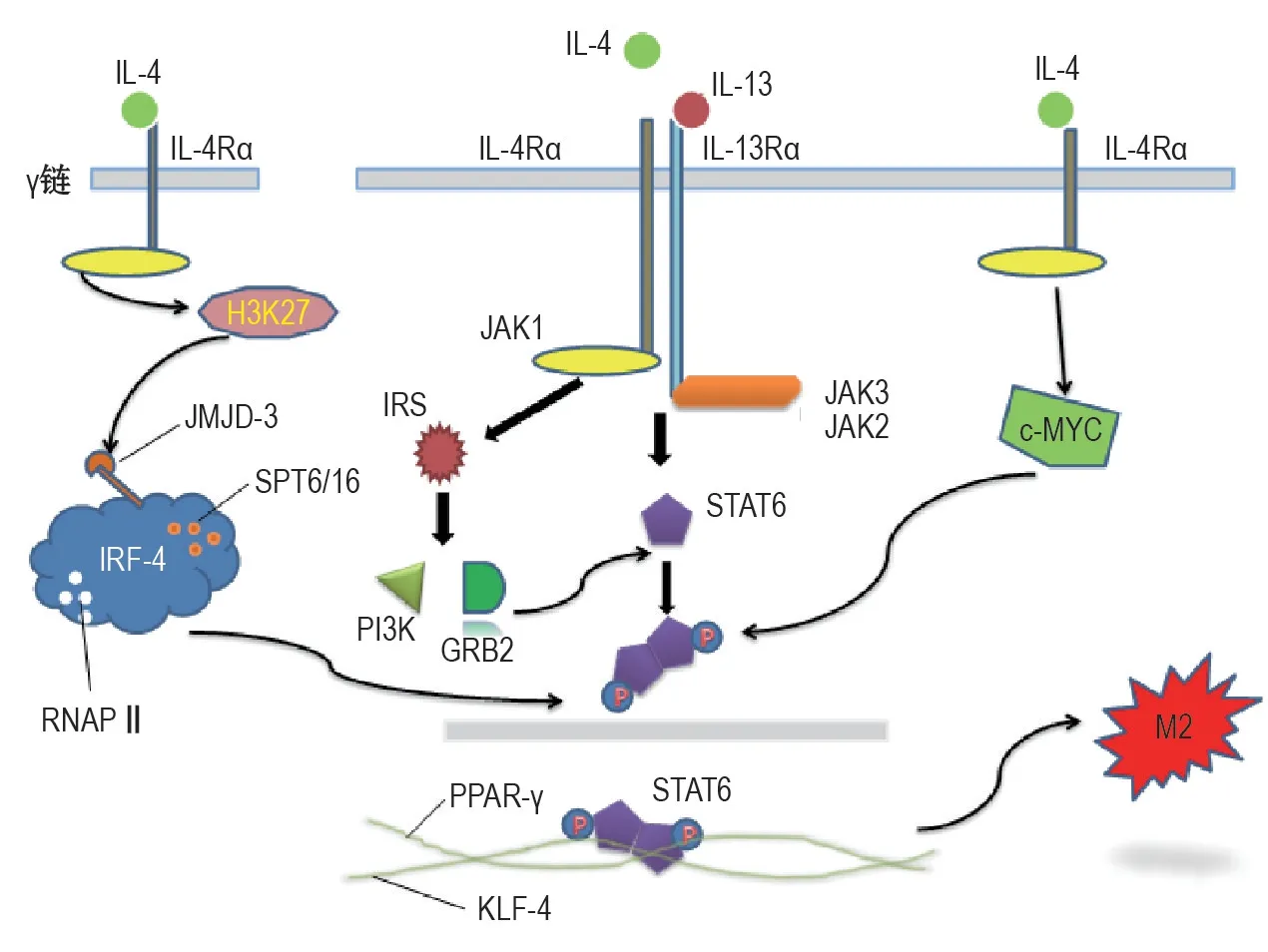
图2 M2巨噬细胞的激活通路.
一方面有研究者认为,M2 型肺泡巨噬细胞可以促进PF的发展[9]。在一定程度上,IL-4/IL-13在肺组织中的含量是评价是否为PF 的指标之一,和正常肺组织相比,PF患者肺组织的IL-13水平更高,研究者从纤维化组织中分离的巨噬细胞经培养产生的IL-13 确实比正常肺组织中的更高[34];虽然目前还没有找到M2 型肺泡巨噬细胞与PF 之间存在直接关系的证据,但是研究者们巧妙的通过检测M2的标记因子在PF中的变化来间接反映M2与PF的联系。有研究发现,来自于特发性PF患者肺组织中的巨噬细胞表达的Arg-1比正常肺组织中的要高[35],也有研究提出,在用Th2细胞因子IL-4和IL-13刺激后“替代激活”的细胞诱导的激酶引起多胺和脯氨酸的合成增多,进而在细胞增殖,胶原沉积和组织修复中起作用[36];Zhu 等[9]的研究结果表明,M2 通过TGF-β/ Smad2 信号转导途径诱导上皮-间质转化(epithelial-mesenchymal transition,EMT),并同时采用IL-4 体外诱导RAW264.7 形成M2,经过培养后检测细胞上清中的TGF-β,发现TGF-β含量增加;由此可见,M2 型肺泡巨噬细胞伴随着PF 发生发展的整个过程,似乎起着促纤维化的作用。
另一方面,一些研究者认为,M2型AM仅仅只是纤维化的结果,并不是病因;它的存在只是作为具有吞噬作用的炎症细胞来清除多余的ECM,也就是说有一定的抗纤维化作用。在矽肺背景下,Carneiro等[37]在Th1 型小鼠C57BL/6 上研究了博舒替尼的抗PF作用,发现博舒替尼能够减少M1并增加矽肺小鼠肺实质和肉芽肿组织中的M2 数量,从而减少其组织中的ECM含量,同时M2以其高内吞的清除能力发挥抗炎作用,使Arg-1,MR和YM-3的表达增加;但Misson等[38]的研究显示,纤维化反应的早期M2相关基因如Arg-1 mRNA的上调与PF的严重程度并没有相关性,Arg-1 mRNA不具有纤维化肺反应的特异性,然而MR却似乎可以促进ECM的摄取[39],最终表现出M2的抗纤维化作用。
无论是促进纤维化的进程还是抗纤维化,M2在某一个方向分泌的相关因子的“量”,实际影响着M2 对肺的病理性进程;某一些因子可能直接促成PF,而另一些因子可能存在“量效关系”,适当量时起着抗炎、组织修复的作用,但一旦过表达就成了促纤维化因子,而这些改变都取决于损伤/刺激的持续时间。有研究者发现,M2可有抗炎和促进伤口愈合的表型,但当这一过程失调时,这些反应的过度激活就可致纤维化的发展[21,40];已知经IL-4和IL-13激活的M2分泌IL-10,其是具有促纤维化作用的经典抗炎细胞因子。有研究显示,IL-10在肺部有抗炎作用[21],其可以改变平阳霉素诱导的炎症反应,从而减缓纤维化的发展[41];然而,发现当IL-10过表达时,就会成为促纤维化因子[42]。因此,经IL-4和IL-13激活的M2 型肺泡巨噬细胞对PF 的作用具体是促进还是拮抗,还需深入研究。
5 展望
无论是M1 或M2,或是M2 分泌的各种相关细胞因子,机体发生PF 必然是肺组织受到了持续的刺激,并分泌产生了高于正常肺组织的Th2相关细胞因子,从而决定了单核巨噬细胞向M2分化,并最终走向PF这条道路,只是PF的程度受刺激程度的影响。同时,有研究显示,自噬可以诱导巨噬细胞向抗炎方向M2 极化,由此笔者考虑由其他途径激活的M2 与由IL-4 和IL-13 活化的M2 的功能在PF中的作用是否存在本质区别,即不同途径的M2 是否是两个有区别的概念,还需要进一步查阅相关参考文献查证。然而,不容忽视的是,Th2相关细胞因子在PF过程中的作用,如何阻断IL-4和IL-13对巨噬细胞的激活作用从而治疗PF,将是抗PF 药物研究的一个重要突破口。
随着高通量测序、基因组芯片以及基因敲除技术等分子生物学的发展和广泛应用,未来通过基因水平控制和筛查,对于IL-4和IL-13与M2型肺泡巨噬细胞的相互作用以及其与PF的作用关系将会越来越明晰,而这些细胞和关键因子也可能会成为潜在的治疗靶点并为抗PF活性化合物的筛选提供一个新的通路。
