猪源产超广谱β-内酰胺酶大肠杆菌的耐药性调查与耐药基因型分析
2019-08-12张青娴徐引弟王治方郎利敏李海利焦文强朱文豪张立宪王克领
张青娴 ,徐引弟 ,王治方 ,郎利敏 ,李海利 ,焦文强 ,朱文豪 ,张立宪 ,游 一 ,许 峰 ,王克领
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
猪大肠杆菌病是由致病性大肠杆菌引起的一种人畜共患的肠道细菌性传染病,是引起1周龄以内仔猪死亡的主要原因[1]。
大肠杆菌为条件性致病菌,鉴于其具有明显且有代表性的耐药性特征指标,常将大肠杆菌作为抗生素耐药参考基因库。头孢菌素具有广谱、高效、耐酶等优点,通常被用作治疗由大肠杆菌引起的感染。然而自2002年以来,在不同国家地区的食源性动物中检出了越来越多的产超广谱β-内酰胺酶(Extended Spectrum Beta-Lactamases,ESBLs)类大肠杆菌。食源性动物中的产ESBLs类大肠杆菌被认为是人群感染耐药性大肠杆菌的潜在来源[2]。2005年以前中国很少在动物分离物中检测到产ESBLs的大肠杆菌,但近年来我国这类大肠杆菌的检出率在急剧增加,其中blaCTX-M型ESBLs是最常见的类型[3-5]。编码ESBLs的基因通常位于细菌携带的质粒、转座子或者整合子上,还可携带其他抗性基因,通过水平传播参与细菌的多重耐药。目前已发现的ESBLs基因主要有blaCTX-M、blaTEM、blaSHV和blaOXA型等[6-11]。
本试验对2018年分离自河南省部分猪场的大肠杆菌进行了ESBLs表型测定,通过PCR方法检测blaCTX-M、blaTEM、blaSHV和blaOXA等 ESBLs耐药基因,旨在调查河南省猪群产ESBLs大肠杆菌的分子流行特点,为预防和追溯ESBLs基因的传播和流行提供理论依据,为指导临床耐药菌株的防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 分点采集河南省部分养猪场(户)猪的粪便或病料样本,所采集地区为鄢陵、内黄、泌阳、汝阳、鹤壁、武陟、滑县、濮阳、济源、方城等10个地市的40多个健康猪群。
1.1.2 主要试剂 LB 肉汤(LB Broth)、LB 琼脂(LB Agar)、Mueller-Hinton琼脂、麦康凯(MC)琼脂、革兰氏染色液等试剂购自北京奥博星生物公司。Taq PCR master mix、DL 2 000 DNA Marker等 PCR 试剂、DNA提取试剂盒、胶回收试剂盒等为上海生工生物有限公司产品。标准菌株大肠杆菌ATCC25922购自中国兽医药品监察所。头孢他啶(CAZ)及头孢他啶/克拉维酸(CAZ/CLA)、头孢噻肟(CTX)及头孢噻肟/克拉维酸(CTX/CLA)药敏纸片购自杭州滨和微生物有限公司。
1.1.3 主要仪器 紫外透射仪、电泳仪(北京六一),PCR扩增仪、生物安全柜(Thermo公司),TK-15台式高速冷冻离心机(SIGMA公司),气浴恒温振荡器(江苏金坛中大),超低温冰箱(REVCO公司),三目生物显微镜(Nikon公司),高压蒸汽灭菌锅(上海申安医疗器械厂)。
1.1.4 试验动物 80日龄昆明小鼠购自郑州大学动物实验中心。
1.2 方法
1.2.1 样本处理 将无菌棉拭子浸泡于含灭菌营养肉汤的试管内,通过直肠拭子收集粪便样品,保存在冰盒里48 h内运送到实验室做进一步处理。部分送检病料(肺脏、心脏、肝脏等),全部病料共计740份。将肛拭子或病料无菌分区划线接种于麦康凯琼脂平板,37℃培养12 h,观察菌落生长情况,挑取典型菌落划线转接到伊红-美蓝平板,纯培养后染色镜检进行形态学鉴定。将镜检疑似大肠杆菌的可疑菌落应用大肠杆菌属特异性引物进行PCR鉴定。
1.2.2 PCR鉴定 将收集到的直肠拭子无菌接种于MC琼脂平板上,37℃培养箱恒温培养12~24 h后,挑取平皿上玫红色、不透明、中等大小的单菌落,接种MC琼脂平皿纯化一代以后进行鉴定。分离株经革兰氏染色后镜检和 16S rRNA(Forward:5′-ATGAA AGCTGGCTACAGGAAGGCC-3′,Reverse:5′-GGTTT ATGCAGCAACGAGACGTCA-3′)分析检测。阳性分离株用终浓度为30.0%甘油肉汤于-20℃冻存备用。
1.2.3 小鼠致病性检测 小白鼠试验前观察3 d,确认健康后用于试验。将待检已纯化的590株大肠杆菌菌株依次接种营养肉汤,37℃培养18 h后,细菌计数后,将菌液稀释成约1×1010CFU/mL,每个菌株为1组,每组接种3只小白鼠,为试验组,设一组对照组。试验组腹腔接种菌液,0.3 mL/只,对照组腹腔接种相同剂量的灭菌生理盐水,隔离饲养,观察小白鼠发病和致死情况。剖检死亡小白鼠,无菌取其心脏血做回归检测试验。
1.2.4 ESBLs的耐药表型测定 根据美国临床和实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的双纸片协同法,对分离株做ESBLs的初筛试验。质控菌株为大肠埃希菌ATCC25922。将头孢噻肟和头孢噻肟/克拉维酸(或头孢他啶和头孢他啶/克拉维酸)置于接种的Mueller-Hinton琼脂平板上,间隔20 mm,37℃恒温培养12~24 h,任意一组或两组头孢他啶(CAZ)抑菌环直径≤25 mm或头孢噻肟(CTX)抑菌环直径≤27 mm,且含棒酸纸片的抑菌环直径大于不加棒酸纸片的抑菌环5 mm以上,可初步诊断为ESBLs阳性。
1.2.5 ESBLs分离株的基因型测定 参考GenBank上已发表的ESBLs耐药基因序列,设计出4对特异性引物,分别对应blaCTX-M、blaTEM、blaSHV和blaOXA等耐药基因,由上海生工生物工程有限公司合成。引物序列如表1。
将上述ESBLs阳性菌株接种LB平皿,37℃温箱内培养18~24 h后,挑取单菌落于100 μL灭菌超纯水中,制成菌液混悬液,100℃煮沸10 min后12 000 r/min离心10 min,吸取上清作为PCR模板备用。阴性对照为质控菌株大肠埃希菌ATCC25922。

表1 基因引物序列及片段长度
PCR 体系终体积为 25 μL,含有 13 μL Taq PCR master mix、上下游引物(20 μmol/L)各 1 μL、5 μL菌液和5 μL ddH2O。PCR在热循环仪中进行,循环条件为:94℃初始变性7 min,进行35个循环的扩增,94℃变性 30 s,53~56℃退火30 s,72 ℃延伸 30 s,最后在72℃下延伸10 min。取PCR扩增产物用1%琼脂糖凝胶电泳分析。
2 结果
2.1 细菌分离鉴定
菌落在SS培养基上生长形态为桃红色、边缘整齐、稍凸起、表面光滑的圆形菌落,其形态疑似大肠杆菌。将临床分离到的细菌在麦康凯琼脂以及伊红-美蓝琼脂平板上进行分离培养,挑取大肠杆菌分离株,运用大肠杆菌的特异性引物进行PCR鉴定,发现均能扩增出大小约为264 bp左右的特异性目的条带(图1)。对鉴定正确的细菌送至生物公司进行测序,测序结果表明分离到的细菌均为大肠杆菌。
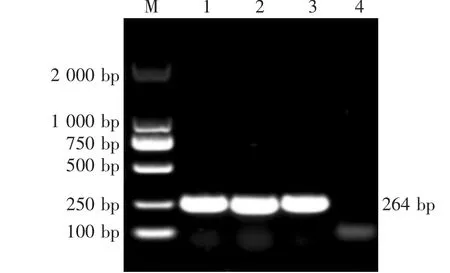
图1 分离的大肠杆菌16S rRNA PCR鉴定
在所有采集到的740份样本中,共分离到590株大肠杆菌,直肠源405株,器官源185株,总分离率为79.73%,分离纯化后放入保存液中-80℃冻存。
2.2 小鼠致病性试验
将590株ESBLs表型阳性大肠杆菌接种营养肉汤,然后将处理过的营养肉汤接种试验动物—小白鼠。接种12 h后,590组中有186组试验组小鼠发病,对照组小白鼠无明显变化。发病小白鼠精神沉郁,采食量大幅减少,呼吸加快,拉稀,体温升高。357只小白鼠24 h内死亡,201只小白鼠48 h内死亡,剖检可见死亡小白鼠肝脏肿大、有出血点和坏死点、心包淤血、肠道膨胀、肠腔充满水样稀便,采集试验组小鼠的心血、肝和脾接种在普通琼脂平板及普通肉汤,37℃培养20 h后,平板和平皿均有细菌生长,经革兰氏染色及生化鉴定表明此菌与接种细菌为同种细菌,表明该菌对小鼠具有较强的致病力。其余的404组试验组小白鼠接种12 h后,出现短暂的精神沉郁和采食下降,此后逐渐恢复,最终表现出与对照组一样的状态;饲养7 d后全部存活,剖检未见明显病变。通过试验结果证明有186组分离病原菌属于致病性猪大肠杆菌,阳性率为31.52%(186/590)。
2.3 ESBLs表型测定
将186株大肠杆菌做ESBLs表型测定,结果表明有112株为阳性菌株。
2.4 产ESBLs菌株的耐药基因型特征
所筛选出的112株ESBLs表型阳性株通过PCR方法进行基因分型,阳性菌株分别在205 bp、415 bp、713 bp和800 bp处扩增出阳性条带,分别提示含有blaCTX-M基因、blaOXA基因、blaSHV基因和blaTEM基因,阴性对照质控菌株大肠埃希菌ATCC25922未扩增出阳性基因。电泳结果与设计相符(图2)。分型结果统计如下:携带blaCTX-M基因阳性率最高,共102株(占91.07%),其次为blaTEM,共77株(占68.75%)。51株(45.53%)为blaCTX-M基因(205 bp)和blaTEM(800 bp)双阳性,9株(8.03%)同时携带blaCTX-M基因和blaSHV基因(713 bp)阳性,2株(1.78%)同时携带blaCTX-M和blaOXA基因(415 bp),28株(25.0%)单独携带blaCTX-M基因,8株(7.14%)单独携带blaTEM基因,仅1株(0.89%)单独携带blaSHV基因,有13株(11.6%)未扩增出上述耐药基因。耐药基因扩增情况见表2。
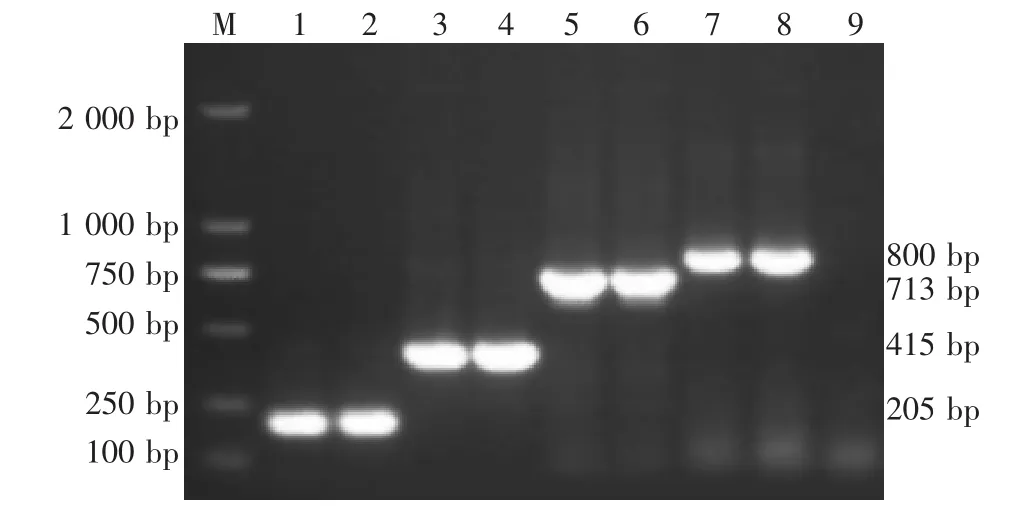
图2 部分菌株ESBLs PCR结果

表2 大肠杆菌产超广谱β-内酰胺酶基因携带情况及基因型
3 讨论
我国大肠杆菌对抗生素的多重耐药性从20世纪90年代开始就表现得十分明显,在过去的20多年里,大肠杆菌对氨苄西林等抗生素耐药性高达90%以上,对头孢曲松或头孢噻肟等第3代头孢菌素的平均耐药率由最初的6%上升接近至56.6%[3]。
本试验对耐药基因测定结果表明,blaCTX-M和blaTEM是河南省最流行的ESBLs类型,且以blaCTXM和blaTEM双阳性为主(45.53%),携带blaCTX-M基因的菌株数占绝大多数(91.07%),其次多的为blaTEM基因,只有2株携带blaOXA基因,与国内大多数学者研究结果一致。郑新添等从福建省龙岩市5个规模化猪场周边水和土壤中分离大肠杆菌ESBLs,其分离率为34.5%,基因型以blaCTX-M型为主,未检出blaOXA基因[9]。沈莉萍等研究了上海市1997—2010年间的猪源大肠杆菌耐药性和产ESBLs菌,发现上海市ESBLs检出率只有7.54%,其基因型以blaTEM和blaCTX-M型双阳性为主[10]。李晴等从养殖废水中分离的50株产ESBLs菌均含有blaCTX-M和blaTEM基因,谢榕等研究显示河北大肠杆菌ESBLs分离株阳性率74.7%,基因型以blaCTX为主(66.3%),未检测到blaSHV的存在,阳性率最高的为blaCTX、blaOXA双阳性[11-12]。张利勃等介绍辽宁省鸡产ESBLs大肠杆菌基因型以blaTEM为主(100%),其次为blaCTX-M型(37.5%),未发现blaSHV型,且以blaTEM、blaCTX-M双阳性检出率最高(34.4%)[13]。曲志娜等统计了青岛地区鸡源大肠杆菌菌株产ESBLs阳性率为83.13%,blaCTXM型、blaTEM型和blaOXA型ESBLs菌株的检出率分别为100.00%、99.52%和47.83%,未检测出blaSHV型ESBLs菌株[14]。曹敏等研究发现,贵州地区产ESBLs大肠杆菌阳性率为83.54%,以blaTEM基因型为主(90.51%)[15]。Zheng等从2007—2009年期间覆盖中国大陆所有7个地理区域的12个省份收集了896种来自食用动物的大肠杆菌分离株,其中14.2%为产ESBLs菌株,12.4%携带blaCTX-M型耐药基因[4]。近年又有报道在健康的中国人群中粪便样本中分离出含有大量blaCTX-M的大肠杆菌(50.5%)[16]。
Muzaheed等报道了印度南部的肺炎克雷伯菌和大肠杆菌中blaCTX-M基因的高流行率[17]。法国科研人员在牛、猪和家禽中也存在blaCTX-M基因[18]。Leverstein-van Hall等最近报道荷兰患者,零售鸡肉和家禽共享相同的ESBLs基因、质粒和菌株,表明通过食物链将ESBLs基因从家禽传播到人类[19]。
大肠杆菌blaCTX-M和blaTEM耐药基因型检出率的大幅增加,与编码基因的质粒高度转移有关,这可能由于多数猪场广泛使用头孢曲松、头孢噻肟和头孢他啶等第3代头孢菌素[20]。Barlow等报道,blaCTX-M基因被转移至质粒的频率几乎是其他几类β-内酰胺酶的10倍[21]。
本研究证实河南猪群大肠杆菌普遍携带ESBLs,食源动物所携带的ESBLs基因型在人类和兽医学中具有明显相似的流行率。Shiraki等[22]表明blaCTXM-2可能来自牛,随后通过牛胴体的污染传播到食物链。葡萄牙和巴西等国报道了宠物可能是blaCTXM基因潜在库[23-24],这些研究表明迫切需要人类和兽医领域对ESBLs表型开展更详细的长期调查研究,以期更准确地评估哪些因素可能导致抗性菌株从动物传播到人类的风险[25],需要制定出更严格的兽医抗生素政策,以防止这些菌株在动物和人类中的出现和传播,从而减少此类细菌的公共卫生安全。
