2018年北疆地区猪伪狂犬病病毒gE、gB蛋白抗体ELISA检测及分析
2019-08-12杨慧敏屈勇刚谷思颖吴圆圆于会举
魏 其,杨慧敏,屈勇刚,谷思颖,任 敏,吴圆圆,于会举
(1.石河子大学动物科技学院,新疆 石河子 832003;2.石河子市添元生物科技有限公司,石河子 832000)
猪伪狂犬病(Pseudorabies,PR)是由猪伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性、热性和高度接触传染性疾病,已对我国养猪业造成严重威胁。猪是该病毒的储存宿主[1],猪感染PRV后会出现脑脊髓炎、奇痒、发热等临床症状,妊娠母猪易引起流产、产死胎,木乃伊胎等繁殖障碍症状,仔猪感染后死亡率可达到100%[2],因此加大了根除该病的工作难度。猪伪狂犬病的诊断可以通过多种血清学诊断方法,其中血清中和试验具有较强的灵敏性和特异性,被世界动物卫生组织(OIE)列为法定的诊断方法。目前,猪伪狂犬病基因缺失疫苗主要缺失的糖蛋白基因为gB和gE基因,利用大肠杆菌和酵母等表达系统对缺失的糖蛋白进行表达并建立了相应的鉴别诊断方法:gB-ELISA(酶联免疫吸附试验)、gE-ELISA等,试验通过验证并证实这些方法具有很强的特异性及很高的灵敏性且检测方法简单、快捷[3]。
为调查北疆地区猪群PRV野毒感染情况,本试验在2018年2—11月期间从北疆地区的6个规模化猪场共采集血样401份,应用猪伪狂犬病病毒gB、gE抗体检测试剂盒对其抗体情况进行检测,为北疆甚至是新疆各猪场的PR预防和净化工作提供帮助。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 2018年2—11月采自北疆地区(石河子、伊犁、塔城、昌吉)的6个规模化猪场共401份血样,其中21日龄仔猪40份,保育猪50份,肥育猪40份,后备猪114份,母猪85份,公猪72份。采血后置于4℃保存,分离血清检测。
1.1.2 试验仪器和材料 猪伪狂犬病病毒gB(PRV-gB)抗体检测试剂盒、猪伪狂犬病病毒gE(PRV-gE)抗体检测试剂盒,两种试剂盒均由北京爱德士元亨生物科技有限公司生产;微量移液器(Eppendorf)、自动酶标仪(美国BioTek公司生产)。
1.2 试验方法
1.2.1 样品处理 将兽用采血器中的血清分离至EP管中,2 000 r/min离心2 min,立即检测或放到4℃冰箱中保存备用。
1.2.2 检测方法 按照上述ELISA试剂盒说明书对401份血清进行PRV-gB、PRV-gE蛋白抗体水平检测。在室温条件下,被检样品及对照组需要用样品稀释液进行稀释,体积比为1∶1。取100 μL处理好的样品及对照组加入抗原包被板中,阴阳对照各设两组,室温孵育(60±5)min或4℃过夜孵育,加入洗涤液进行洗涤,最后一次洗涤后将板中的残留液体在吸水材料上扣干,避免对抗原抗体结合造成影响,然后每孔加入100 μL的酶标抗体,抗原抗体在室温下结合(20±1)min后重复洗涤步骤,室温条件下加入100 uL的底物液,避光显色(15±1)min后加入50 μL终止液,使反应终止,10 min内应用酶标仪进行检测,判定结果。
1.2.3 结果判定 检测出每孔OD650nm的值,判定本试验成立的条件:阴性对照平均OD650nm值减去阳性对照平均OD650nm值差必须≥0.30,否则结果不成立。
每孔OD650nm的值用S表示,N为阴性对照OD650nm值的平均数。
若S/N>0.70判定gB/gE检测结果为阴性;S/N≤0.60为阳性;介于两者之间结果为可疑。
1.2.4 统计分析 计算gE、gB抗体的阳性率、阴性率、可疑率以及S/N的均值,并用SPSS软件对结果进行统计分析。
2 结果
2.1 北疆地区6个规模化猪场PRV-gB蛋白抗体水平
对北疆地区6个规模化猪场(A~F)401份血样进行检测发现,PRV-gB抗体阳性有374份,平均阳性率为93.27%。A~F场gB抗体的阳性率依次为99.04%、93.33%、55.00%、100.00%、99.40%、83.33%,C 场的阳性率最低,为 55.00%,D 场的最高,为 100.00%。A~F各猪场的 S/N 的均值依次为 0.101 7、0.116 4、0.497 1、0.087 1、0.071 3、0.212 8,所有值均小于 0.60,最小值为 0.071 3,最大值为 0.497 1。结果见表 1。
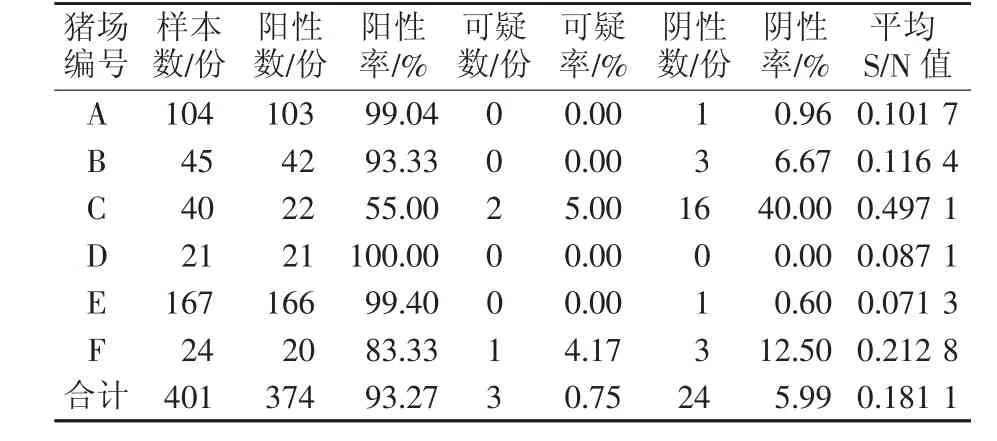
表1 北疆地区猪伪狂犬病病毒gB蛋白抗体ELISA检测结果
不同猪场之间猪伪狂犬病病毒gB蛋白平均抗体水平存在差异,C 场和 A、B、D、E、F 5个场差异显著(P<0.05);F 场和 A、D、E 3 个场差异显著(P<0.05);B场和E场差异显著(P<0.05);A场和D、E两个场差异不显著(P>0.05)。结果见表 2。
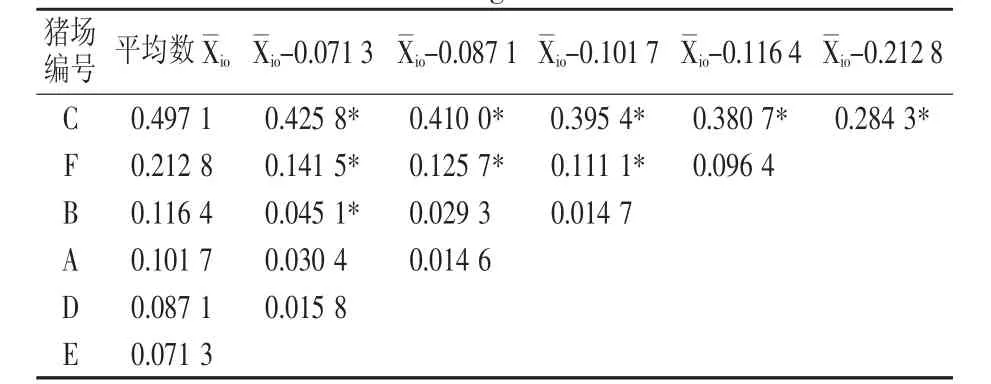
表2 猪场间猪伪狂犬病病毒gB蛋白平均抗体水平多重比较
2.2 北疆地区6个规模化猪场PRV-gE蛋白抗体水平
检测A~F规模化猪场的PRV-gE蛋白抗体水平发现,PRV-gE抗体阳性有181份,阳性率为45.14%。A~F的6个猪场检出gE抗体的阳性率依次为 21.15%、4.44%、0%、57.14%、86.23%、8.33%,很明显C养殖场的阳性率最低0,E场的阳性率最高为86.23%。A~F 各猪场 S/N 的均值为 0.858 2、0.938 3、1.020 0、0.466 0、0.282 0、0.838 0,其中 D、E 场的值均小于0.60,其余4组值均大于 0.70,最小值为0.282 0,最大值为 1.020 0。结果见表 3。

表3 北疆地区猪伪狂犬病病毒gE蛋白抗体ELISA检测结果
不同猪场之间猪伪狂犬病病毒gE蛋白平均抗体水平存在差异,E 场和 A、B、C、D、F 5 场差异显著;D 场和 A、B、C、F 4 个场差异显著(P<0.05);F 场和C场差异显著(P<0.05);A场和C场差异显著(P<0.05);B 场和 A、C、F 3 个场差异不显著(P>0.05);A场和F场差异不显著(P>0.05)。结果见表4。

表4 猪场间猪伪狂犬病病毒gE蛋白平均抗体水平多重比较
2.3 不同类别猪群的PRV-gB、PRV-gE 蛋白抗体水平
将北疆地区的6个规模化养猪场按照其不同类别的猪群来分别检测其gB抗体水平,在401份样品中检测出376份阳性血样,阳性率为93.77%。经试验统计发现21日龄仔猪、保育猪、肥育、后备猪、母猪、公猪的gB蛋白抗体阳性率分别为97.50%、92.00%、100.00%、84.21%、97.65%、100.00%,在这6类猪群中PRV-gB蛋白抗体阳性最高的有肥育猪、公猪均为100%,其次是母猪为97.65%,后备猪检出的阳性率最低为 84.21%,结果见表5。

表5 试验猪场不同类别猪群的PRV-gB蛋白抗体水平
检测21日龄仔猪、保育猪、肥育猪、后备猪、母猪、公猪这6种类别猪群的gE抗体水平,总体的gE蛋白抗体阳性率为39.15%,其中检出阳性率最高的是公猪为68.06%,其次是母猪为56.47%,而保育猪的gE蛋白抗体阳性率最低为12.00%,其余的21日龄仔猪、肥育猪、后备猪的gE蛋白抗体阳性率依次为30.00%、12.50%、32.46%。结果见表6。
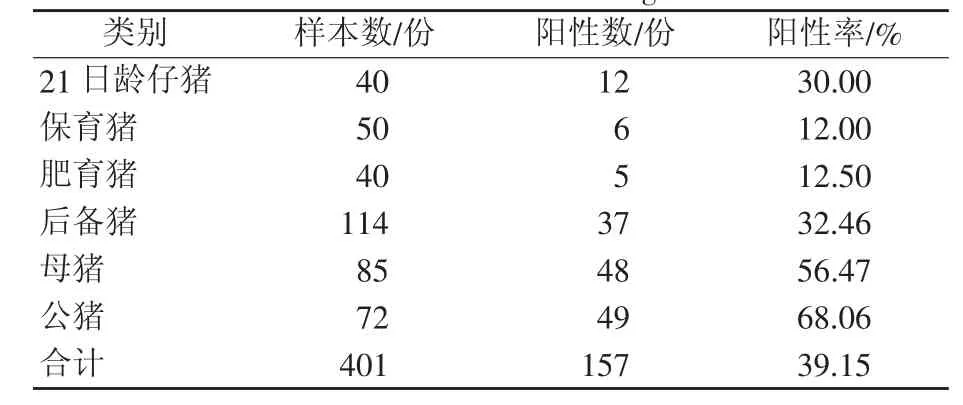
表6 试验猪场不同类别猪群的PRV-gE蛋白抗体水平
3 讨论与分析
3.1 北疆地区各猪场及不同类别猪群PRV-gB蛋白抗体水平
猪伪狂犬病病毒只有一种血清型,但不同毒株的毒力有所差异。该病毒对外界的抵抗能力较强,因此要提前做好仔猪的免疫工作,疫苗毒会抢先与机体的天然靶位产生“占位效应”,降低野毒感染风险[4]。应用PRV-gB蛋白ELISA抗体检测试剂盒对采集的401份血样进行检测,在北疆地区的6个养猪场中有374份检出PRV-gB抗体阳性,平均阳性率为93.27%。从这些养殖场不同类别的猪群来看,有376份检出PRV-gB抗体阳性,平均阳性率达到93.77%,但其中C场的阳性率较低为55.00%,因此对于C场,若该猪场为净化猪场(未接种PR疫苗)则gB抗体阳性率属正常,净化工作良好,若为免疫猪场则gB抗体阳性率较低,需加强免疫工作。从不同日龄猪群的PRV-gB蛋白抗体水平分析,后备猪的gB蛋白抗体阳性率最低为84.21%,阳性抗体水平基本在一个高度。总体来看北疆地区猪群PRV-gB蛋白的抗体水平较高,免疫效果较好。
3.2 北疆地区各猪场及不同类别猪群PRV-gE蛋白抗体水平
关于PRV-gE蛋白抗体检测,张鲁安[5]在 2005年曾报道PRV-gE蛋白抗体阳性率为10.1%,在2013年张倩等[6]通过试验检测PRV-gE蛋白抗体阳性率为15.42%,2016年刘鸽等[2]检测北疆地区的PRV-gE蛋白抗体阳性率为14.91%。据了解本试验的6个养殖场采用的疫苗为PRV-gE缺失株,应用PRV-gE蛋白ELISA抗体检测试剂盒对抽测的401份血样进行检测,从6个抽检的养殖场共检测出181份PRV-gE蛋白抗体阳性,平均阳性率为45.14%;对不同日龄猪群的PRV-gE蛋白抗体检测出157份阳性样品,平均阳性率为39.15%,从C场抽测的血样中,检测PRV-gE蛋白抗体阳性率最低为0,在不同日龄的猪群中保育猪的PRV-gE蛋白抗体阳性率为12.00%。从以上可以看出,PRV-gE蛋白抗体阳性水平呈逐年递增趋势,说明各猪场存在野毒感染。
3.3 加强猪场净化及免疫接种工作
通过试验可以发现,北疆地区预防PR的免疫效果较好,但各猪场仍存有感染的情况,因此要加强免疫接种工作[7],规模场猪要增加抗体检测频率,并针对抗体水平较低的猪群,要尽快补免,及时淘汰感染PRV的猪和免疫耐受猪,避免感染到伪狂犬病病毒。对猪场应进行严格消毒,对于新引入的种猪必须进行科学合理的检疫后才可入群,若发现发病或疑似发病猪立即紧急加强疫苗接种,提高抗体,抑制野毒的活跃性,并配合消毒等生物防疫机制,做到及早控制暴发与避免造成大面积流行[8]。防治猪PRV-gB、PRV-gE的任务重大,高效的基因缺失疫苗及PRV-gB、PRV-gE蛋白抗体ELISA检测方法的联合使用是猪PR防治的基础,同时结合生物安全和优良的饲养管理等措施[9],为猪场的经济发展提供有效支持。
