一种配合饲料替代杂鱼对三疣梭子蟹蜕壳生长、消化酶和免疫酶活力的影响
2019-08-12罗佶龙彭莹莹李泽良蔡雅松许文军谢建军
罗佶龙,彭莹莹,李泽良,蔡雅松,何 杰,许文军,谢建军
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021)
三疣梭子蟹(Portunus trituberculatus,以下简称梭子蟹)肉质鲜美、营养丰富,是我国重要的经济蟹类。自上世纪90年代人工育苗技术突破以来,梭子蟹养殖规模逐渐扩大,已成为沿海地区的主要养殖品种之一,2016年全国养殖产量已达12.53万t[1]。但目前梭子蟹养殖仍然采用投喂冰鲜杂鱼的投喂模式,然而杂鱼具有来源不稳定、质量不可控、携带病原体、易破坏水质等问题严重影响了梭子蟹人工养殖业的可持续性发展[2-5]。因此,采用配合饲料替代杂鱼是梭子蟹养殖产业发展的必经之路。本研究团队近年来在梭子蟹的营养需求研究基础上,开发了一款配合饲料,该配合饲料对梭子蟹生长效果尚未得到评估和验证。
虾蟹类甲壳动物的生长是伴随着蜕壳过程实现的,蜕壳周期的长短、蜕壳后的增重率和特定生长率是直接反应虾蟹类生长速度的重要指标[6]。同时,虾蟹类机体消化酶和免疫酶活性可有效反应其对不同饵料的适应性以及摄食不同饵料后的代谢水平和健康状况[7-8]。
本研究在室内单体养殖条件下,使用团队自主研发的配合饲料全替代或半替代杂鱼投喂梭子蟹,研究该配合饲料替代杂鱼对梭子蟹幼蟹的生长蜕壳、消化酶活性以及非特异免疫能力的影响,旨在初步了解该配合饲料对梭子蟹的生长性能和内在指标的影响,为评估该配合饲料替代杂鱼的可行性提供理论基础。
1 材料与方法
1.1 实验用蟹与养殖条件
实验于2017年在浙江省海洋水产研究所试验场开展。7月中旬使用饵料诱捕的方式从养殖生产池塘中捕获300余只梭子蟹幼蟹暂养至室内水泥池(长×宽×高为8 m×1.8 m×1 m)中备用。次日从中选取120只规格相近(体重为20~30 g)、十足健全,无明显伤痕且行动敏捷的雌体,分别养殖于120个单体塑料筐(长×宽×高为25 cm×15 cm×12 cm)内。塑料筐四周用泡沫浮力架固定,使筐体浮于水面,框底没于水面下约为10 cm处,筐体上方盖一孔径为1.8 cm的塑料网以防止幼蟹外逃。所有塑料筐设置在同一个水泥池内,水深 0.4 m,水温 28±1 ℃,盐度 26,pH 8.2±0.1,连续增氧,DO>5 mg·L-1,亚硝酸盐浓度<0.15 mg·L-1,氨氮浓度<0.5 mg·L-1,实验期间每日上午8:00清除残饵并换水1/3,维持良好水质。
1.2 饵料设计与饲养管理
将120只梭子蟹随机的均分为三组,分别为完全投喂配合饲料组(全替代模式(M1))、配合饲料和杂鱼混合投喂组(半替代模式(M2),配合饲料与杂鱼混合比例为1:3))以及完全投喂杂鱼组(0替代模式(M3)),实验期间所用配合饲料为团队自主开发的配合饲料(配合饲料的常规生化和脂肪酸组成如表1、2)。每日下午6点投饵,投饵量根据摄食情况及时调整(整体上M1组投喂量为蟹体重的3%~4%;M2组投喂量为蟹体重的5%~8%;C组投喂重量为蟹体重8%~12%的杂鱼),次日上午清扫塑料筐内的残饵和粪便,即时捞出死亡个体以免污染水体。
实验期间每日观察蟹体的蜕壳情况,记录蜕壳时间,待新蜕壳的幼蟹甲壳变硬后用毛巾轻轻擦拭体表水分并称量体质量和甲宽,根据以下公式计算增重率和特定生长率。

公式中,WGR为增重率(%),SGR为特定生长率(%),Wn为蜕壳后平均体重(g),Wn-1为蜕壳前平均体重(g),t蜕壳周期(d)。

表1 配合饲料和杂鱼的常规生化组成Tab.1 Conventional biochemical composition of formula feed and trash fish

表2 配合饲料和杂鱼的脂肪酸组成(%总脂肪酸)Tab.2 Fatty acid composition of formula feed and trash fish(%total fatty acids)
1.3 酶活力测定
随机选取第二次蜕壳后约10 d的梭子蟹进行解剖,每个替代组5只蟹,用于酶活力测定。取样时先擦干蟹体体表水分,用1 mL无菌注射器从其游泳足基部抽取1 mL左右血淋巴装于2 mL离心管中,然后活体剥开甲壳,取出肝胰腺、胃装于冻存管中,所有样品保存于-80℃超低温冰箱中,备用于检测消化酶和免疫酶的活性。
消化酶活力的测定:准确称取一定量的胃和肝胰腺组织重量,分别将称取的组织放入各自的匀浆器,再用移液枪准确加入其9倍体积的生理盐水制成10%的组织匀浆液,在冰浴条件下充分匀浆后置于低温离心机以2 500 r·min-1的转速离心10 min,取上清液即为待测的粗酶液。胰蛋白酶、胃蛋白酶和脂肪酶的活性测定均按照试剂盒(南京建成生物工程研究所)操作步骤准确测定。
非特异性免疫酶的测定:将解冻后的血淋巴置于低温离心机内,在4℃、5 000 r·min-1的条件下离心10 min后取其上清液为待测液。血清与上述肝胰腺粗酶液的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)的酶活性均使用试剂盒(南京建成生物工程研究所)生产测定。
1.4 数据分析
实验所得数据均用平均值±标准差表示,使用SPSS 20.0软件对所有数据进行统计分析,对不同模式间采用单因子ANOVA进行方差分析,使用Tukey-HSD法进行多重比较,取P<0.05为差异显著标准,相关图表在Excel上绘制。
2 结果
2.1 配合饲料替代杂鱼对梭子蟹蜕壳和生长性能的影响
由图1可见,在第一次蜕壳中,M1组幼蟹蜕壳周期显著长于M2和M3组P<0.05),且M3幼蟹组略长于M2组 (P>0.05);第二次蜕壳中,M1中的幼蟹蜕壳周期显著长于M3组(P<0.05),M2介于M1和M3之间,但与M1和M3差异均不显著(P>0.05);另外,各实验组幼蟹的第二次蜕壳周期均较长于第一次的蜕壳周期。

图1 配合饲料替代杂鱼对梭子蟹蜕壳周期的影响Fig.1 Effect of formula feed replacement of trash fish on the molting cycle of P.trituberculatus
如表3所示,第一次蜕壳后,各替代组幼蟹的体重与甲长并无显著差异,而在第二次蜕壳后,M1组幼蟹的体重与甲长均显著低于M2和M3组(P<0.05),且M2组幼蟹体重和甲长均略高于M3组;就增重率(WGR)和特定生长率(SGR)而言(图2-3),第一次蜕壳后3组之间的WGR无显著差异(P>0.05),但M1组的SGR显著低于M2和M3组(P<0.05),M2与M3组间几乎无差异(P>0.05);第二次蜕壳后,无论是WGR还是SGR,M1组均显著低于M2和M3组(P<0.05),而M2和M3组却十分接近;另外,由图2可见,3个替代组中,仅M1组幼蟹第二次蜕壳后的WGR显著低于第一次蜕壳后的增重率;而3个替代组第二次蜕壳后的SGR均为第一次蜕壳的1/2左右(图3)。

表3 配合饲料替代杂鱼对梭子蟹体重、甲长变化的影响Tab.3 Effect of formula feed replacement of trash fish on the weight and length of P.trituberculatus
2.2 配合饲料替代杂鱼对梭子蟹消化酶活性的影响
从图4、5可见,3个替代组幼蟹的胃和肝胰腺的蛋白酶和脂肪酶活性规律一致,均为M1>M2>M3,但各组间差异均不显著(P>0.05);M1组幼蟹的胃和肝胰腺的淀粉酶活性均显著高于M2和M3组(P<0.05),而M2和M3组幼蟹中的淀粉酶活性均较为接近(P>0.05)(图6)。

图2 配合饲料替代杂鱼对梭子蟹蜕壳后增重率的影响Fig.2 Effect of formula feed replacement of trash fish on the growth rate of P.trituberculatus after molting

图3 配合饲料替代杂鱼对梭子蟹蜕壳后特定生长率的影响Fig.3 Effect of formula feed replacement of trash fish on specific growth rate of P.trituberculatusafter Molting

图4 配合饲料替代杂鱼对梭子蟹胃和肝胰腺中的蛋白酶活性的影响Fig.4 Effect of formula feed replacement of trash fish on protease activity in stomach and hepatopancreas of P.trituberculatus
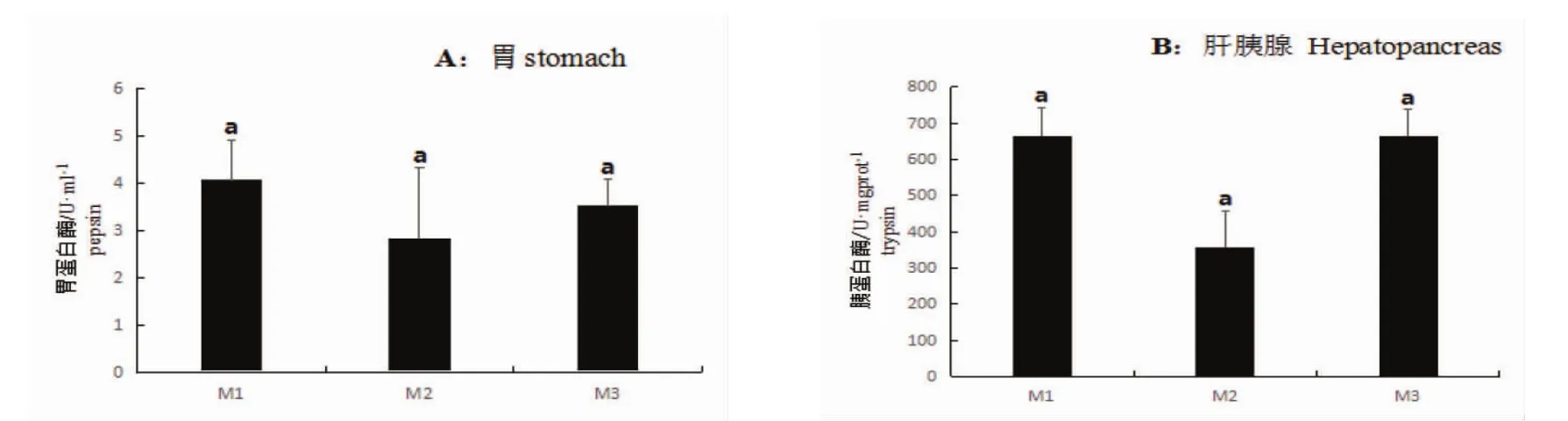
图5 配合饲料替代杂鱼对梭子蟹胃和肝胰腺中的淀粉酶活性的影响Fig.5 Effects of formula feed replacement of trash fish on amylase activity in stomach and hepatopancreas of P.trituberculatus

图6 配合饲料替代杂鱼对梭子蟹胃和肝胰腺中的脂肪酶活性的影响Fig.6 Effects of formula feed replacement of trash fish on lipase activity in stomach and hepatopancreas of P.trituberculatus
2.3 配合饲料替代杂鱼对梭子蟹非特异性免疫酶活性的影响
由图7可见,M2组幼蟹肝胰腺中的超氧化物歧化酶活性较高于M1和M3组,但3个替代组幼蟹血淋巴和肝胰腺中的超氧化物歧化酶活性均无显著差异 (P>0.05);3个替代组中,M2和M3组幼蟹血淋巴和肝胰腺中的过氧化氢酶活性相近且较高于M1组 (图8);3个替代组幼蟹血淋巴和肝胰腺中的酸性磷酸酶和碱性磷酸酶活性均无显著差异,但整体上是M2组较高于M1和M3组(图9、10)。

图7 配合饲料替代杂鱼对梭子蟹血淋巴和肝胰腺中的SOD活性的影响Fig.7 Effects of formula feed replacement of trash fish on superoxide dismutase(SOD)activity in hemolymph and hepatopancreas of P.trituberculatus

图8 配合饲料替代杂鱼对梭子蟹血淋巴和肝胰腺中CAT活性的影响Fig.8 Effects of formula feed replacement of trash fish on catalase activity(CAT)in hemolymph and hepatopancreas of P.trituberculatus

图9 配合饲料替代杂鱼对梭子蟹血淋巴和肝胰腺中ACP活性的影响Fig.9 Effects of formula feed replacement of trash fish on acid phosphatase(ACP)activity in hemolymph and hepatopancreas of P.trituberculatus

图10 配合饲料替代杂鱼对梭子蟹血淋巴和肝胰腺中AKP活性的影响Fig.10 Effects of formula feed replacement of trash fish on alkaline phosphatase(AKP)activity in hemolymph and hepatopancreas of P.trituberculatus
3 讨论
3.1 配合饲料替代杂鱼对梭子蟹生长性能的影响
群体养殖条件下梭子蟹在蜕壳期间的自相残杀极其严重,而单体养殖的方式不仅可提高养殖成活率,并且可精确的观察实验期间梭子蟹每个个体的摄食行为、蜕壳周期以及蜕壳后的增重率和特定生长率[9]。因此,本研究采用了单体养殖的方式研究配合饲料替代杂鱼对梭子蟹生长性能的影响,从研究结果看,配合饲料全替代和半替代杂鱼组的梭子蟹均能顺利蜕壳和生长,但全替代组的梭子蟹2次蜕壳周期均显著长于全杂鱼组,而且蜕壳后的特定生长率也显著低于全杂鱼组,说明本研究所用配合饲料尚不能完好的满足梭子蟹的营养需求,其营养成分含量或配比较差于杂鱼;至于全替代组梭子蟹的第二次蜕壳周期、增重率和特定生长率的差异较第一次有所减小,可能是随着养殖周期的延长梭子蟹对配合饲料的适应性会有所提高[10]。令人可喜的是,半替代组梭子蟹的蜕壳周期以及蜕壳后的增重率和特定生长率等生长指标均能达到全杂鱼组的水平,甚至最终体重略高于全杂鱼组,这可能得益于配合饲料能弥补野杂鱼营养成分上的不足,野杂鱼自带的一些有益菌又能提高配合饲料的利用率[11],这暗示该实验配合饲料和杂鱼在营养上均有不足之处,而混合投喂可以使两者优势互补,达到营养与适口性俱佳的目的。
3.2 配合饲料替代杂鱼对梭子蟹消化酶活性的影响
虾蟹类消化能力的强弱很大程度上取决于消化酶的活性,而消化酶活性与饵料的种类和营养组成有着密切关系[12]。本研究发现配合饲料全替代和半替代杂鱼的投喂模式均未对梭子蟹胃和肝胰腺中的蛋白酶活性产生显著影响,这与施永海等[13]使用配合饲料替代鲜活饵料饲养刀鲚幼鱼的结果一致,这可能是因为偏肉食性的动物,其消化酶活性不能大幅度改变以适应配合饲料;但全替代模式显著提高了梭子蟹胃和肝胰腺中的淀粉酶活性,一方面可能是梭子蟹不能有效利用配合饲料中植物性蛋白源,而动物性蛋白源又并不充足,只能通过提高对淀粉的利用率来满足能量上的需求,相比之下半替代的投喂模式中混合饵料的动物性蛋源相对充足,其无需提高淀粉的利用率,以致淀粉酶活性与杂鱼组无明显差异;另一方面也可能与配合饲料中含有大量富含淀粉的面粉有关,机体需要提高淀粉酶的活性来加速对配合饲料中淀粉的消化。梭子蟹的消化能力对本研究中的配合饲料有一定的适应性,这说明就消化能力而言该配合饲料作为可靠饵料替代杂鱼养殖梭子蟹是可期的。
3.3 配合饲料替代杂鱼对梭子蟹非特异性免疫酶活性的影响
甲壳动物因其无法产生免疫球蛋白,而缺乏获得性免疫能力,所以自身的非特异性免疫肩负了保护机体的主要责任,其中SOD和CAT是抗氧化酶中十分重要的两种酶,SOD能歧化活性氧自由基,产生H2O2和O2,而CAT能使H2O2还原成水,从而降低活性氧对细胞的损伤;ACP、AKP是非特异性免疫系统中重要的两种水解酶[14],同时也是巨噬细胞的标志酶[15],并且还参与甲壳动物的磷、钙、DNA、RNA、蛋白质和脂质代谢[16]。本研究中全替代组各种酶的活性均较低于杂鱼组,这可能还是与该配合饲料不能较好满足梭子蟹的营养需求,致使机体代谢水平降低有关;而半替代组梭子蟹中除血淋巴中的ACP和SOD活性略低于全杂鱼组外,其余的ACP、AKP、SOD以及CAT活性均高于杂鱼组,可能是配合饲料原料(豆粕等)中含有较丰富的P元素,机体需要提高ACP和AKP的活性,以加快磷的代谢[16],并且饲料中添加的维生素C(VC)和维生素E(VE)等抗氧化物质提高了机体抗氧化酶(SOD和CAT)的活性。整体上,完全摄食本研究所用配合饲料将降低梭子蟹免疫能力,而采用该配合饲料和杂鱼混合投喂可提高梭子蟹的免疫能力。
4 小结
综合生长性能、消化酶和非特异性免疫酶活性等参数,本研究认为阶段性的使用该配合饲料部分替代杂鱼养殖梭子蟹是可行的,至于是否能在池塘养殖条件下全程使用还有待进一步验证。另外,使用配合饲料全替代杂鱼将显著影响梭子蟹的蜕壳生长和消化能力,但是完全投喂该配合饲料仍能使梭子蟹顺利蜕壳生长,那么池塘养殖生产条件下全程完全使用配合饲料后最终的养殖效果如何仍值得研究与探讨。
