乳头状甲状腺癌中表皮生长因子受体和黏附斑激酶表达及其临床意义
2019-08-12毕日军郗彦凤
毕日军,郗彦凤
(1.山西医科大学,山西 太原030001;2.山西省肿瘤医院病理科,山西 太原030013)
乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是甲状腺癌最常见的组织学类型,占甲状腺恶性肿瘤的80%,而且近年来发病率呈现快速上升趋势[1]。一般来说,PTC患者通过手术切除,并结合放射性碘疗法,有一个良好预后,5年总生存率大约为95.0%。但是一部分PTC患者初步治疗后会出现复发和/或转移。因此,鉴别PTC患者不良预后有非常重要的意义。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种170 kDa细胞表面糖蛋白。与配体结合后,EGFR激活细胞内MAPK和PI3K/A信号转导通路,促进增殖、生存、血管生成和迁移等[2]。由受体过度表达、自分泌配体刺激或激活突变导致EGFR信号通路紊乱在一些肿瘤中发挥作用,与以转移为特征的晚期恶性肿瘤和预后不良相关[3]。黏附斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸激酶,与癌症进展有关。在癌细胞中,FAK/Src复合物增加会增强EGFR对MAPK和PI3K的激活,从而增强繁殖、生存、迁移能力和转移[4]。高水平FAK与人类多种肿瘤侵袭性相关,包括甲状腺癌[5]。为更好了解EGFR及其下游效应物FAK在甲状腺癌进展中表达情况,本文在PTC样本中检测EGFR和FAK蛋白表达,分析其与临床病理参数的关系,以及肿瘤转移扩散过程中EGFR和FAK的变化。
材料和方法
1 临床资料
收集2016年6月至2018年12月在我院行PTC切除手术的52例患者组织样本,患者平均年龄为49.8±8.4(39~78)岁。入选标准:①患者手术前未进行任何放化疗治疗;②经两位副高以上职称病理医师同时诊断;③符合WHO对PTC诊断标准。排除标准:①应用免疫抑制剂治疗患者;②有风湿性免疫系统疾病;③合并恶性肿瘤;④癌灶较小不能进行连续切片;⑤排除出血、感染及坏死严重者。所有患者或其家属均签署知情同意书。医院伦理委员会审查通过。
2 免疫组化分析
PTC或转移性淋巴组织样本经10%多聚甲醛固定,30%蔗糖在4°C脱水。把脱水后的组织放在预冷的铁片上,OCT包埋。冰冻切片,厚度为10μm,贴片。免疫组化染色用亲和素-生物素技术进行。一抗是多克隆兔抗EGFR和FAK(美国Sigma公司),二抗是生物素标记的山羊抗兔IgG(北京中杉金桥生物技术公司)。抗体反应后,DAB显色,中性树胶封片,显微镜下观察免疫组化染色。
3 免疫组化结果评价
肿瘤切片由两个对临床结果一无所知病理科大夫观察。免疫反应性半定量评价包括强度和分布。染色评分如下:0为无染色;1为弱广泛分布或肿瘤细胞局部(高达40%)染色;2为中等,肿瘤细胞中超过40%染色;3为强,肿瘤细胞弥漫染色。样本评分为0和1是低表达,2和3是高表达。典型染色图片如图1和图2所示。
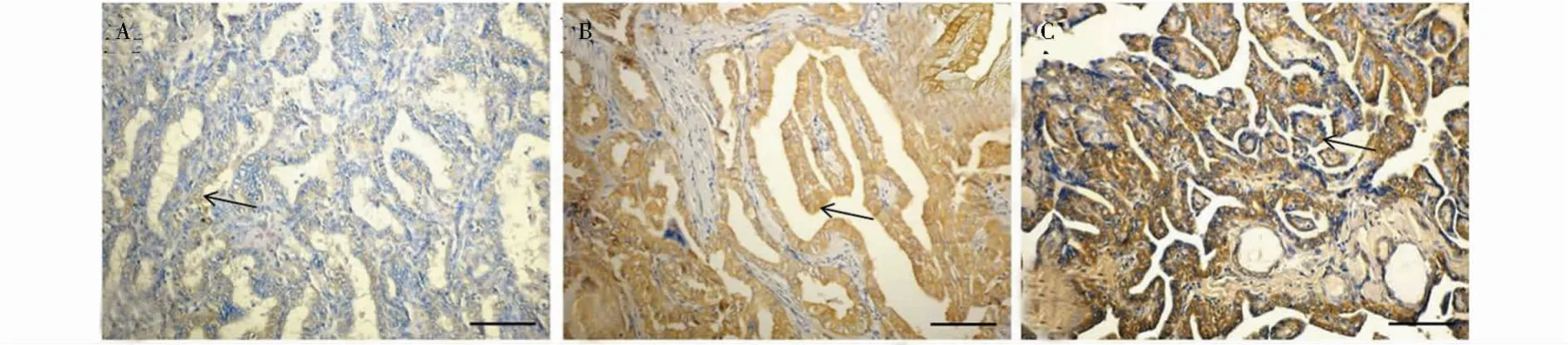
图1 PTC中EGFR免疫组化表达

图2 PTC中FAK免疫组化表达
4 统计学处理
实验数据采用SPSS 20.0统计软件进行分析。采用卡方检验或Fisher精确检验分析EGFR和FAK表达与临床病理参数相关性。采用Spearman相关性分析评估EGFR和FAK免疫组化染色强度的相关性。P<0.05为差异有统计学意义。
结 果
1 PTC中EGFR和FAK蛋白表达水平分析
PTC患者分为两类:低表达(染色得分0和1)和高表达(染色评分2和3)患者。52例患者中有29例(55.8%)EGFR高表达,有30例(57.7%)FAK高表达。通过Fisher精确检验和Spearman相关检验证实EGFR和FAK表达显著正相关(r=0.805,P< 0.001)(表1)。
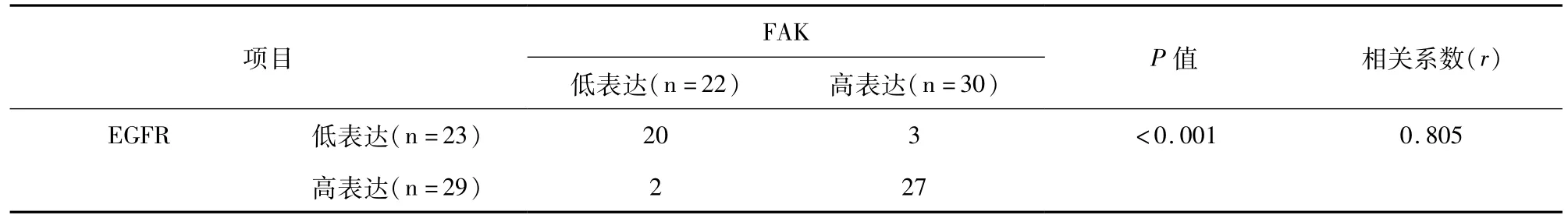
表1 PTC中EGFR和FAK蛋白表达的相关性分析(n=52)
2 EGFR与FAK表达与PTC临床病理参数相关性
我们进一步评估PTC中EGFR和FAK蛋白表达及临床病理参数相关性(表2和表3)。统计分析显示,PTC中EGFR和FAK高表达与年龄和性别无相关性。EGFR和FAK高表达与淋巴结转移、甲状腺外侵袭和晚期pT显著相关(P<0.05)。EGFR和FAK高表达与TNM分期无相关性。EGFR和FAK高表达在不同组织分型PTC中差异有统计学意义(P<0.001)。
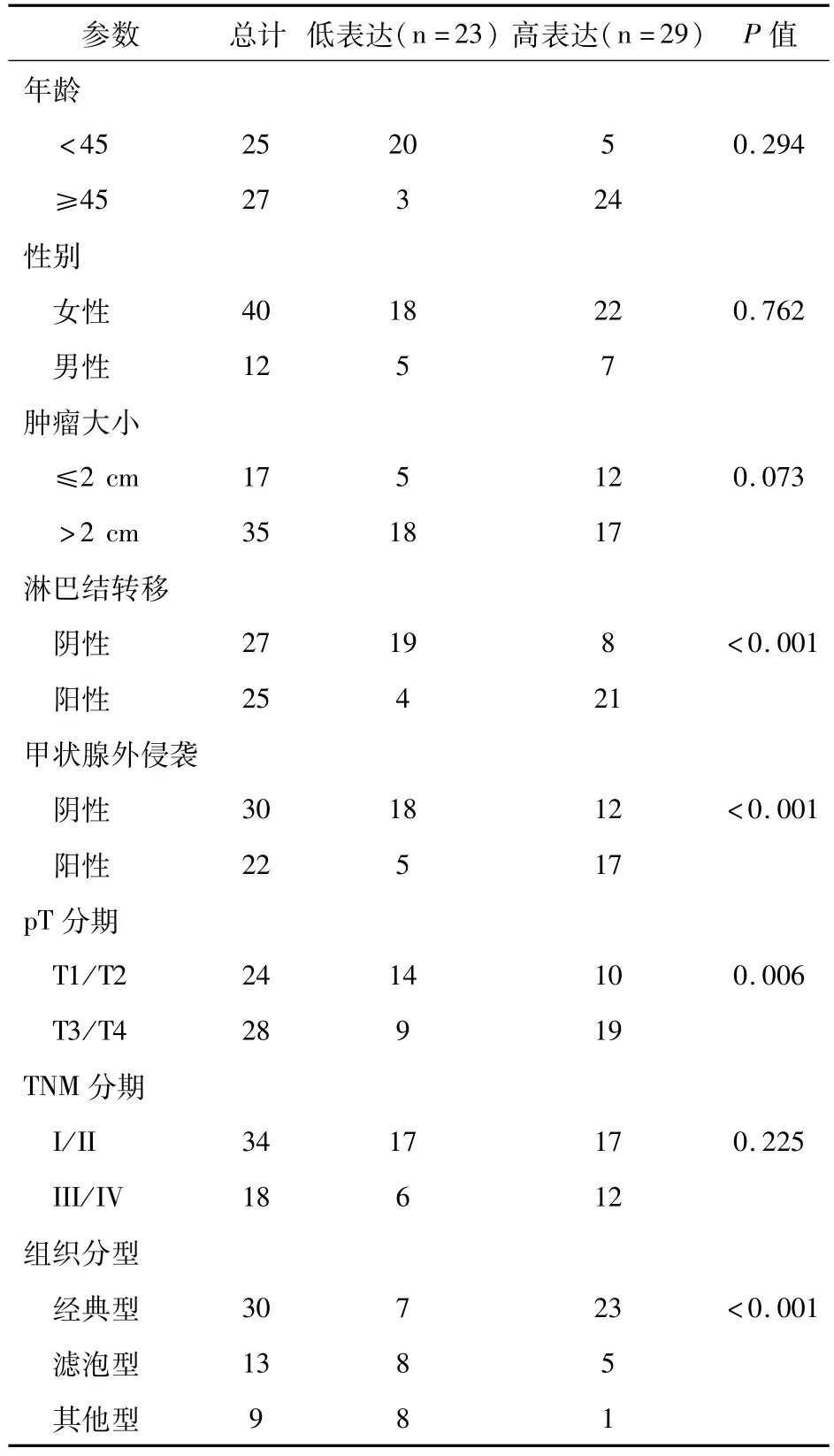
表2 PTC中EGFR蛋白表达与临床病理参数分析
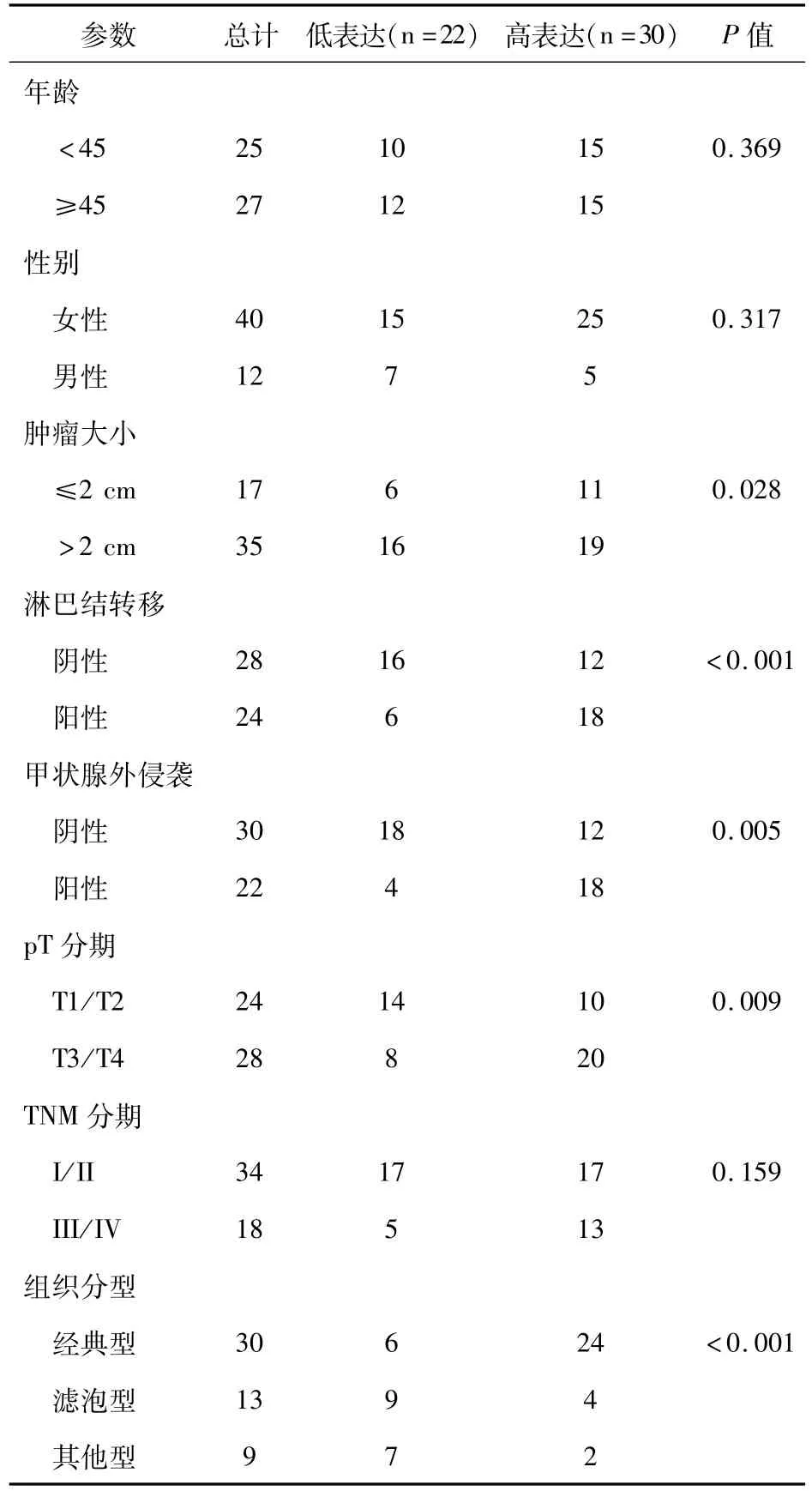
表3 PTC中FAK蛋白表达与临床病理参数分析
3 EGFR和FAK共表达与PTC病理参数相关性
下面进一步分析高水平EGFR和FAK共表达与PTC淋巴结转移和甲状腺外浸润相关性(表4)。结果显示,高水平EGFR和FAK共表达与PTC淋巴结转移和甲状腺外浸润显著相关。52例PTC患者中,24例患者淋巴结转移,20例患者甲状腺外浸润。24例转移性PTC中有20例患者高水平EGFR和FAK共表达;20例甲状腺外浸润患者中有16例患者高水平EGFR和FAK共表达,阳性率分别为83.3%和80.0%。因此,高水平EGFR和FAK蛋白单独或共同表达与PTC患者淋巴结转移和甲状腺外浸润显著相关。
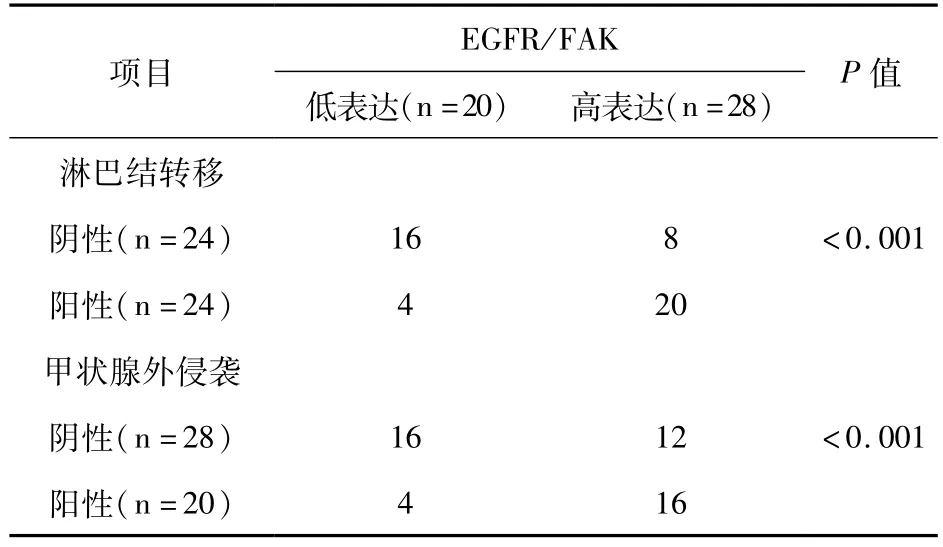
表4 高水平EGFR和FAK共表达与淋巴结转移和甲状腺外浸润相关性
4 原发PTC及相应淋巴结转移组织中EGFR和FAK免疫组化分析
采用免疫组化分析10例PTC原发肿瘤及相应淋巴结转移组织EGFR和FAK蛋白表达。与原发PTC相比较,淋巴结转移组织EGFR和FAK均表现为高表达,其中90%淋巴组织高表达EGFR;80%淋巴组织高表达FAK(表5)。表明EGFR和FAK在PTC淋巴扩散过程中均为高表达。

表5 原发PTC及相应淋巴结转移组织中EGFR和FAK免疫组化表达情况(n=10)
讨 论
本研究结果证实,原发性PTC及相应转移淋巴组织中EGFR和FAK共同高水平表达,可能与PTC进展相关。此外,结果也支持EGFR及其下游效应器FAK,在PTC侵袭和转移中发挥作用。EGFR信号传导通路参与人类肿瘤细胞进展,在一些人类恶性肿瘤中与侵袭性生物学行为和不良临床后果有关[6-7]。关于甲状腺癌,EGFR在未分化甲状腺癌中上调,与去分化、侵袭性表型和不良预后相关[8]。在PTC中,EGFR高表达与患者不良临床病理特征,如局部侵袭性和转移性扩散相关[9]。在甲状腺癌细胞中,配体与EGFR结合后可激活ERK和AKT通路,促进肿瘤细胞增殖,而且能够避免程序性细胞死亡,增强迁移及转移能力。此外,已经证实甲状腺癌细胞侵袭是由EGFR下游基质金属蛋白酶(matrix metalloproteinases,MMPS)的 激 活 进 行 调 节[10]。EGFR和FAK上述几项研究提示EGFR、MMPS和FAK之间的功能联系,可影响恶性细胞迁移及侵袭。
FAK是一种与癌症进展相关的非受体酪氨酸激酶,可整合生长因子和细胞外信号基质,是整合素依赖的细胞运动及促生长因子中效应分子信号通路的调控因子[11]。在癌细胞中,FAK/SRC复合体增加可激活MAPK和PI3K信号通路,此外EGFR也可激活MAPK和PI3K信号通路,均可增强细胞的增殖、生存和迁移能力[2]。FAK/SRC复合体使酪氨酸磷酸化级联,从而能够调节恶性细胞相关信号通路。FAK在甲状腺癌中高表达,但在非恶性组织中低表达,而且与侵袭性表型相关[12]。体外研究表明,MMPS、FAK与EGFR激活有关,并促进肿瘤细胞的迁移和侵袭。因此,抑制FAK表达或活性可阻止EGFR调节的侵袭性,并降低人肺腺瘤细胞A549中MMP-9活性,提示FAK通过调节MMP-9促进癌细胞运动[13]。在乳腺癌细胞中,聚甲醛酸通过减少FAK磷酸化和MMP-9表达抑制EGFG诱导的侵袭、迁移和细胞运动能力[14]。同样,也有报道,EGFR刺激体外甲状腺恶性细胞中FAK磷酸化和MMP-9表达[15]。抑制EGFR信号通路可抑制MMP-9表达和FAK磷酸化,而FAK反义寡核苷酸处理可抑制MMP-9表达和随后的细胞侵袭,从而证明它与侵袭直接相关。我们的结果也提示FAK在肿瘤细胞迁移和侵袭中发挥作用。
总之,本研究结果表明,EGFR及其下游效应器FAK蛋白高表达,与PTC淋巴扩散和肿瘤浸润相关,这表明EGFR和FAK均参与了PTC进展。因而EGFR和FAK两种分子可能用于预测PTC的侵袭性。此外,评估组织样本中EGFR和FAK表达可能有助于PTC患者术前的危险分级。
