不同环境因素对H62铜合金极化曲线的影响分析
2019-08-11王泗环郁大照
王泗环,郁大照,王 腾
(海军航空大学,山东 烟台264000)
H62铜合金具有良好的力学、导电性能,冷热状态下塑性均优良,切削性好,此外价格便宜,广泛应用于各类导电设备[1-3]。电连接器作为最常使用的电信号传输设备,其实现功能的接触件就是以铜为基体材料外加镀层制造的[4-6]。飞机大量使用电连接器,在高温、高湿、高盐雾及强辐射的沿海热带地区容易受到腐蚀的影响[7-8]。而H62铜合金耐蚀性一般[9],在镀层破损及人为环境因素下极易产生腐蚀现象,因此研究H62铜合金的腐蚀具有一定的实际应用价值。极化曲线是表示极化电位与极化电流之间的关系曲线,是研究腐蚀的基础数据,可用于判定腐蚀在特定环境下的电极过程机理及影响因素,同时也是腐蚀数值计算的基础参数[10]。
目前诸多学者对极化曲线在腐蚀机理上的应用进行了大量研究。姜应律[11]等通过极化曲线研究钛合金在水、醇中的腐蚀机理,指出在醇溶液中发生的氧化反应主要是醇被催化为醛又进一步氧化为羧酸,并提出根据阴极弱极化区求得自腐蚀电流的方法;覃奇贤[12]等系统的总结了当前测量极化曲线的方法及选材原则;陈珊[13]等对5083铝合金在不同pH值NaCl溶液中的腐蚀进行研究,结果表明,点蚀电位基本接近,自腐蚀电位存在差异,在强酸、强碱溶液中发生均匀腐蚀,而在弱酸、弱碱溶液中发生局部点蚀;蒋华麟[14]等研究了不同表面活化剂对碳钢电极极化曲线的影响;朱晓峰[15]等研究了温度和应力对管道钢材料腐蚀现象;王晨光[16]在对7B04铝合金进行腐蚀研究时,也分析了各因素对溶液及液膜下极化曲线的影响。
但是特定材料有不同的腐蚀表现形式,对于专门研究材料极化曲线见诸较少,而研究H62铜合金极化曲线目前还没有相关文献。因此,本文对H62铜合金的极化曲线进行研究,以期对H62铜合金的腐蚀机理提供基础理论支撑。
1 试验设计
1.1 正交试验设计
试验件材料为沈阳兴华航空公司提供的H62型铜合金,其主要成分如表1所示。

表1 H62铜合金成分(质量分数)Tab.1 H62 copper alloy composition(mass fraction) %
将H62铜合金切割成10mm×10mm×10mm的立方体试验件若干,用直径2cm的PVC管固定,留有一测试面,其余面均用环氧树脂密封固化,利用万用表检测试验件导电性,待合格后将测试面打磨抛光,用无水乙醇冲洗后再用吹风机吹干,放入干燥箱内备用,试验件制备如图1所示。
电化学测量装置采用传统的三电极体系,参比电极采用饱和甘汞电极,对电极为铂电极。工作电极与参比电极构成的回路用于测量电极电位,工作电极与对电极构成的回路用于测量极化电流。安装时,三电极要在同一高度,为减少溶液IR降的影响,距离不可过大,安装示意图如图2所示。

图1 试验件Fig.1 Test piece

图2 三电极测量体系安装示意图Fig.2 Installation diagram of three-electrode measurement system
电化学测试设备为武汉科斯特生产的CS电化学工作站,见图3。温度通过水浴箱水浴加热控制,溶液pH通过添加HCl、NaOH调节,利用去离子水和纯Na-Cl颗粒配置不同质量分数的NaCl溶液。为消除外界环境影响,将设备置于法拉第屏蔽箱中测试,待开路电位稳定后测量动电位极化曲线,电位范围-1.2~1.2 V,扫描速率2 mV/s,采样频率4Hz。每次测量后仍将试验件按最初步骤处理,保证每次测试面状态一致。

图3 电化学工作站Fig.3 Electrochemical workstation
按L9(34)正交试验表设计正交试验[17],温度、NaCl质量分数、pH值分别设定3个水平梯度,试验表如表2所示。
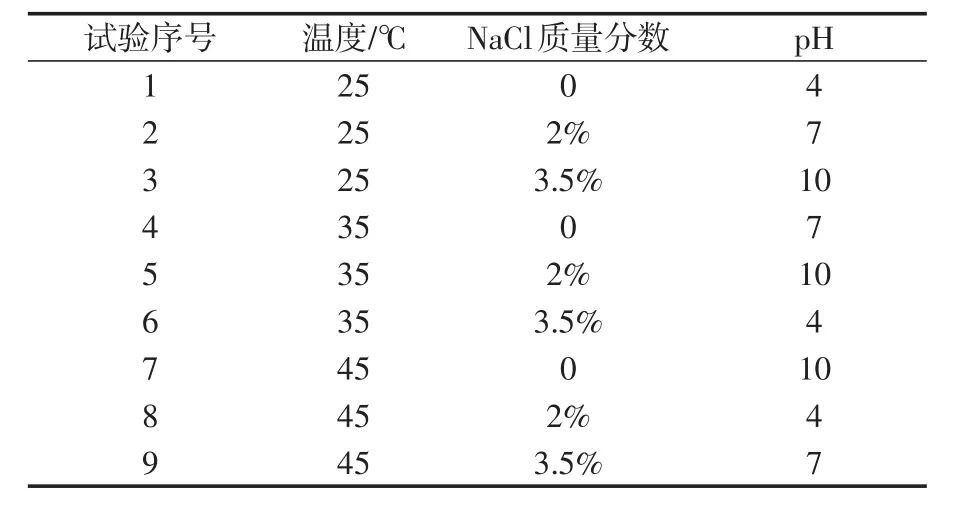
表2 正交试验设计Tab.2 Orthogonal design
1.2 单一因素影响试验设计
正交试验用于分析各因素对腐蚀的影响程度,若要考虑单一因素的影响,还要再进行控制变量的试验。试验设备及步骤不变,分别改变温度、NaCl质量分数、pH值,对于其他2个不变量温度为25℃、NaCl质量分数为0、pH为7,试验设计如表3所示。

表3 单一因素影响试验设计Tab.3 Single factor impact test design
2组试验共需进行13次测量,为减少工作量,可按照NaCl质量分数和pH值的先后改变顺序配置溶液,这样仅需进行4次配置。
1.3 测量数据处理
由极化曲线可以判定金属电极反应特性及控制步骤,得到金属在给定电位情况下的腐蚀速率[18]。电极反应由Bulter-Volmer公式表示:

式(1)中:i为电流密度/(A/cm2);i0为交换电流密度/(A/cm2);α、β分别为阳极、阴极反应传递系数;n为反应涉及电子数;F=96 485 C/mol为法拉第常数;η为过电位/V;R=8.314 J/(mol⋅K)为气体常数;T为绝对温度/K。
试验件表面同时进行着金属阳极腐蚀反应和O2、H+的阴极还原反应,测得极化曲线是整个腐蚀体系的实测极化曲线,是阴阳极反应的综合表现形式,表达式为:

式(2)中:I为腐蚀体系极化电流密度(/A/cm2);Icorr为自腐蚀电流密度(/A/cm2);ΔE为腐蚀体系的外加极化值/V;ΔE>0,外加电流为阳极电流,ΔE<0,外加电流为阴极电流;βa、βc分别为阳极、阴极反应Tafel斜率/V。
对微极化区(| ΔE|约为20~70 mV),阴阳极反应均不可忽略,电位与电流密度关系仍由式(2)表示。
对强极化区(| ΔE|约为100~250 mV),式(2)中的负指数项可忽略不计,电位与电流简化为Tafel式,

自腐蚀电位可直接读出,自腐蚀电流密度常常采用Tafel直线段外延法,若阴阳极难以同时得到理想Tafel区,则可由一条实测阳(阴)极极化曲线结合自腐蚀电位求得。
2 结果与分析
2.1 正交试验结果与分析
图4为正交试验的9组极化曲线。从图4中可看出,不同溶液环境下的极化曲线差异较大,既有符合理论的规则曲线,又有变化形式复杂的曲线,但对极化曲线,最重要的2个参数是自腐蚀电位(Ecorr)和自腐蚀电流(Icorr)。因此,以这2个参数作为判断曲线变化的依据。

图4 正交试验极化曲线Fig.4 Orthogonal test polarization curve
表4、5列出正交试验的Ecorr、Icorr及其极差分析处理数据,由表中可看出Ecorr和Icorr在各种环境下相差巨大,其最大最小值相差达20倍以上,因此溶液条件的改变可对极化曲线产生显著影响。对于自腐蚀电位,其极差值由大到小为RE2>RE3>RE1,因此对自腐蚀电位影响最大的是NaCl质量分数,其次为pH值,而温度影响最小,且由于RE2与RE1差值较大,其对应影响作用也有较大差异。对于自腐蚀电流,其极差值由大到小为RI1>RI2>RI3,因此对自腐蚀电流影响大小顺序为温度>NaCl质量分数>pH。由于各极差值相差较小,因此各因素对于自腐蚀电流影响程度也相差较小。根据以上分析,考虑综合作用,对于极化曲线,各因素影响大小顺序为NaCl质量分数>pH>温度。
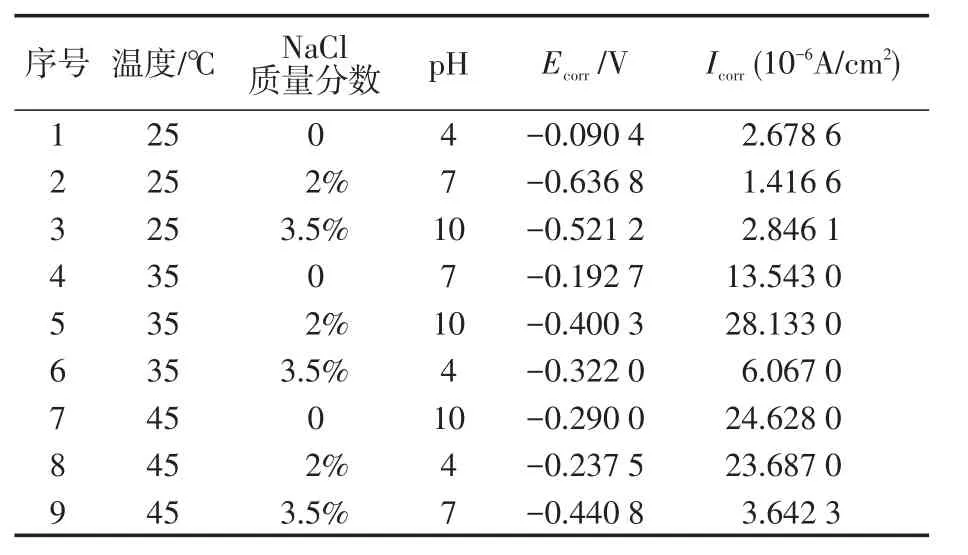
表4 正交试验结果Tab.4 Orthogonal test results
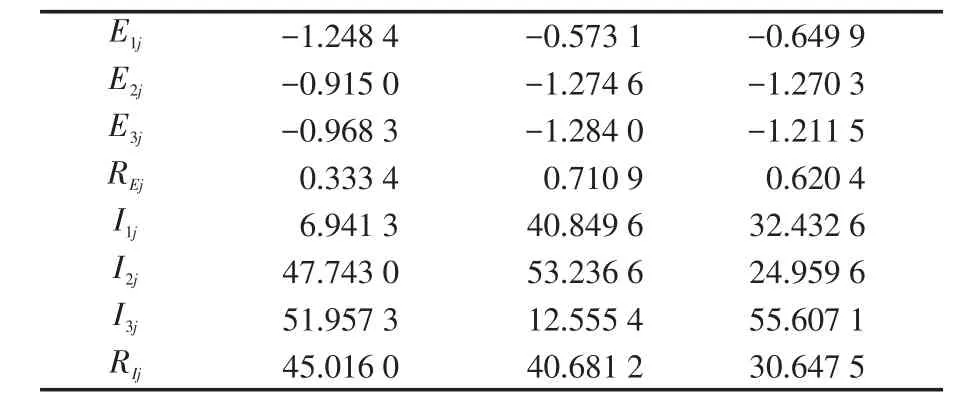
表5 正交试验结果极差分析Tab.5 Range analysis of orthogonal test results
2.2 单一因素影响试验结果与分析
2.2.1 温度的影响
图5为不含NaCl中 性溶液中,H62铜合金在不同温度下的极化曲线。在25℃的常温环境下,自腐蚀电位为-0.200 06 V。随着温度的升高,自腐蚀电位没有明显的变化,自腐蚀电流密度呈微弱上升趋势。温度升高一方面会使反应固有速率增大,另一方面会使溶液中O2扩散速率增大,这两因素均导致腐蚀电流密度增大。但温度升高也会使溶液中O2溶解度降低。因此,腐蚀电流密度在40℃以下受O2扩散速率影响较大,但不会一直增大下去。文献[16]即证实7B04铝合金在40℃以上自腐蚀电流密度将出现下降趋势,因而H62铜合金也将会有此趋势。阴极极化曲线在-0.4 V即已达到O2还原极限电流密度值,在-1.3 V处由于H+参与反应,电流密度随着极化的增大而增大。图6为3.5%中性NaCl溶液在25℃、45℃下的极化曲线,对比图5、6可看出在NaCl溶液中温度对极化曲线有显著影响,一方面腐蚀电流密度增大,另一方面极化曲线出现波动,变化趋势有所改变。因此,Cl-在温度对于极化曲线的影响中有着重要作用。

图5 不同温度下H62铜合金极化曲线Fig.5 Polarization curves of H62 copper alloy at different temperatures

图63 .5%NaCl溶液中的极化曲线Fig.6 Polarization curve in3.5%NaCl solution
2.2.2 NaCl质量分数的影响
图7为25℃中性溶液中,H62铜合金在不同NaCl质量分数下的极化曲线。
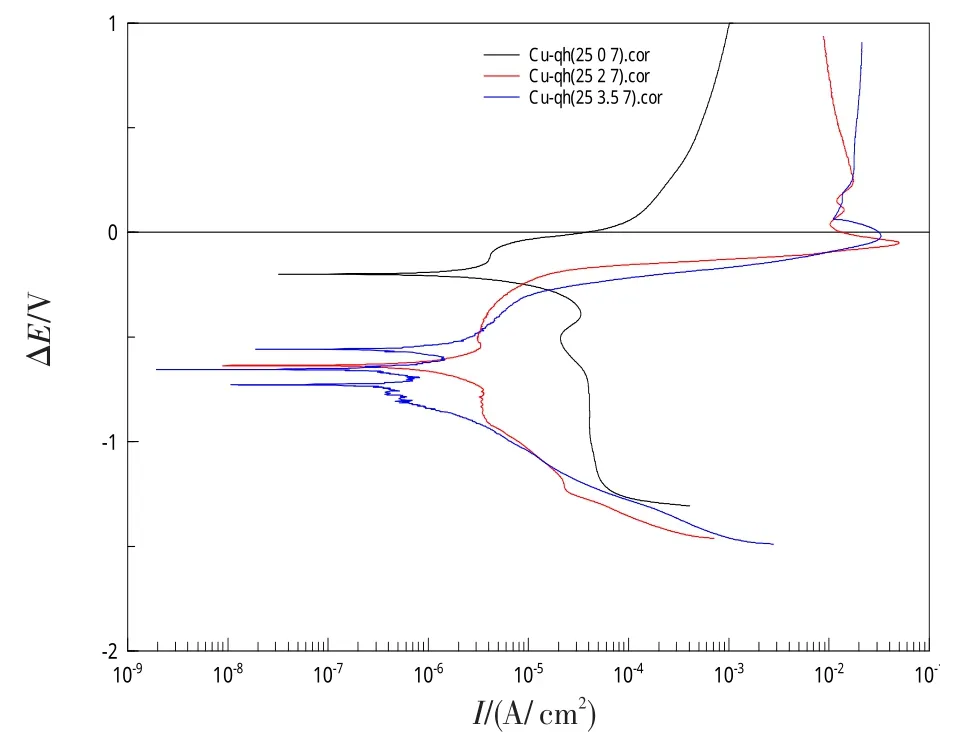
图7 不同NaCl质量分数下H62铜合金极化曲线Fig.7 Polarization curve of H62 copper alloy under different NaCl concentrations
从图7中可以看出,不含NaCl的纯溶液自腐蚀电位明显高于NaCl溶液的自腐蚀电位,自腐蚀电流密度却随着NaCl质量分数的增大而减小,但相同电位下NaCl质量分数越高腐蚀电流密度越大。NaCl溶液的阳极极化曲线存在电流急剧增大的点蚀现象,阳极电流密度远远大于不含NaCl的纯溶液,阳极极化在0 V左右即已达到极限电流密度值,表明Cl-的存在极大的加速金属腐蚀。质量分数分别为2%和3.5%的Na-Cl溶液其极化曲线相差不大,说明当Cl-质量分数达到一定时,腐蚀速率基本保持不变。NaCl质量分数的阴极极化曲线呈逐渐增大趋势,没有达到极限电流密度值,且电流密度先小于后又逐渐大于不含NaCl溶液的电流密度,表明NaCl的存在使得O2还原反应难以进行,O2还原反应处于阴极极化控制,不同于质量分数为0下的浓度极化控制,当极化电位进一步增大后H+的还原反应又参与其中,因而电流密度随着极化电位的增大一直处于增大状态。图8为3.5%NaCl溶液中的腐蚀表面,可看出表面大致发生均匀腐蚀,但也存在少部区域点蚀现象。

图8 NaCl溶液中腐蚀表面Fig.8 Corrosion surface in NaCl solution
2.2.3 pH值的影响
图9为25℃不含NaCl溶液中,H62铜合金在不同pH值下的极化曲线。从图中可以看出,随着pH值的增大自腐蚀电位逐渐降低,自腐蚀电流密度大致相等,表明碱性溶液增大了腐蚀倾向,但腐蚀速率却并没有增加。中性与酸性溶液有着相似的阳极极化曲线,其形状和数值明显不同于碱性溶液。碱性溶液阳极极化生成的Cu2+与OH-反应生成Cu(OH)2钝化膜使得反应受阻,而钝化膜又会在Cl-的作用下导致点蚀发生(碱性溶液通过酸性溶液配制而来,所以含有少量Cl-)。试验中可以看到,在碱性条件下溶液会出现悬浮物,如图10所示。阴极极化曲线受酸碱度影响较小,变化趋势大致相同,均有明显的O2还原和H+还原阶段。

图9 不同pH值下H62铜合金极化曲线Fig.9 Polarization curves of H62 copper alloy at different pH values

图10 碱性溶液中腐蚀现象Fig.10 Corrosion in alkaline solution
从以上对3种单一因素影响的分析中可看出,无论是在温度下的影响还是在其自身质量分数下的影响,NaCl均对极化曲线产生重要影响,且pH值的影响相比温度也更加明显,这些均与正交试验的结果相吻合。
3 结论
本文基于不同环境因素的变化,设计正交试验及单一因素影响试验探讨环境因素对H62铜合金极化曲线的影响,主要工作及结论如下:
1)设计正交试验对各因素影响大小进行判定。以自腐蚀电位、自腐蚀电流为判断依据,采用极差分析法,得出对自腐蚀电位影响大小顺序为NaCl质量分数>pH>温度,对自腐蚀电流影响大小顺序为温度>NaCl质量分数>pH。
2)对单因素影响进行讨论。Cl-是温度对极化曲线影响的重要因素,在NaCl质量分数为0时温度的影响十分微弱;NaCl质量分数增大会使自腐蚀电位降低,引起点蚀现象,且改变阴极极化曲线形式;酸性与中性溶液极化曲线相似,碱性溶液由于生成氢氧化物钝化膜,改变了阳极极化曲线。
3)单一因素影响的分析结果与正交试验的结果完全符合,均表明NaCl质量分数是影响极化曲线的重要因素,因此在材料的实际使用中尤其要注意NaCl盐雾沉积的定期清除。
