山东地区鸡源致病性大肠杆菌的相关基因检测及药敏试验
2019-08-08张子越赵鲁赵巧雅王雷齐霖彭燕商敏许蔷路晓吴静
张子越 赵鲁 赵巧雅 王雷 齐霖 彭燕 商敏 许蔷 路晓 吴静

摘 要:为了解近年山东省禽源大肠杆菌的毒力因子及耐药情况,分析潜在的公共安全问题,特将本实验室保存的大肠杆菌标准株与送检的发病(死)鸡中分离的菌株同时进行毒力基因的PCR检测及药敏试验。结果显示:16种常见抗生素中,青霉素G和万古霉素对20株大肠杆菌均无抑制作用,而抑菌效果较好的抗生素主要有阿米卡星、庆大霉素等;其中两株大肠杆菌分离株对上述16种抗生素均不敏感,17株大肠杆菌对超过5种以上抗生素耐药;13株含有5种以上毒力因子基因,占比65%;4株同时含有7种毒力因子基因,占比20%;仅1株不含被检毒力基因。上述结果表明,大肠杆菌耐药形势异常严峻,并且部分菌株具有较强的致病力。本次试验结果同样对保障公共健康、防止耐药菌株通过食物链进入人体造成危害具有借鉴意义。
关键词:鸡源大肠杆菌;毒力因子;耐药性;药敏试验
中图分类号:S858.314.4+3 文献标识码:B 文章编号:1673-1085(2019)06-0012-05
鸡大肠杆菌病是由致病性大肠埃希氏菌 (Escherichia coli)引起的一種以肝周炎、腹膜炎、心包(肌)炎、败血症为主要特征的传染病。各品种、日龄鸡均易感发病, 但肉仔鸡发病率最高[1]。20世纪40年代,有学者发现某些特殊血清型大肠杆菌对人和动物均有致病性[2]。鸡大肠杆菌血清型众多、分型过程复杂,并且具有时间和地域性差异[3]。据报道,大肠杆菌的毒力因子在其致病过程中发挥重要作用[4,5]。大肠杆菌的毒力因子主要包括温度敏感血凝素、铁离子摄取系统、黏附素、耶尔森强毒力岛、侵袭因子、血清抗性蛋白、毒素等[6-9]。各种因素作用下,大肠杆菌易产生耐药性,这也是防治大肠杆菌病的主要难点[1,3]。本研究对近年山东省各地养殖场送检的发病(死)鸡体内分离到的大肠杆菌和本实验室保存的标准株同时进行相关基因的PCR检测及药敏试验,以了解大肠杆菌毒力基因的携带情况与耐药性的关系,为防止人兽共患病原菌间耐药性的传递及临床用药提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株 大肠杆菌标准株(CAU0751)购自中国兽药监察所;19株大肠杆菌分离自近年山东省内各养殖场送检的发病(死)鸡,分离时临床症状明显。以上菌株由山东省农业科学院家禽研究所山东省禽病诊断与免疫重点实验室保存活化。
1.1.2 药敏片及规格 16种药敏片(英国Oxoid公司生产)均购自北京兰伯瑞生物技术有限公司。相关药敏片信息见表1。
1.1.3 主要试剂、仪器 LB固体培养基(含5%血清),麦康凯培养基、营养肉汤和大肠杆菌显色培养基均购自海博生物技术有限公司;2×One Step PCR Mix试剂盒、2×Taq PCR Star Mix、核酸染料、DL-2000Marker购自北京康润诚业生物科技有限公司;琼脂糖购自生工生物工程(上海)股份有限公司;PCR仪、电泳仪购自杭州博日科技有限公司;紫外凝胶成像仪(Alpha Imager HP)购自美国Protein Simple公司;自动核酸提取仪购自西安天隆科技有限公司;数显游标卡尺。
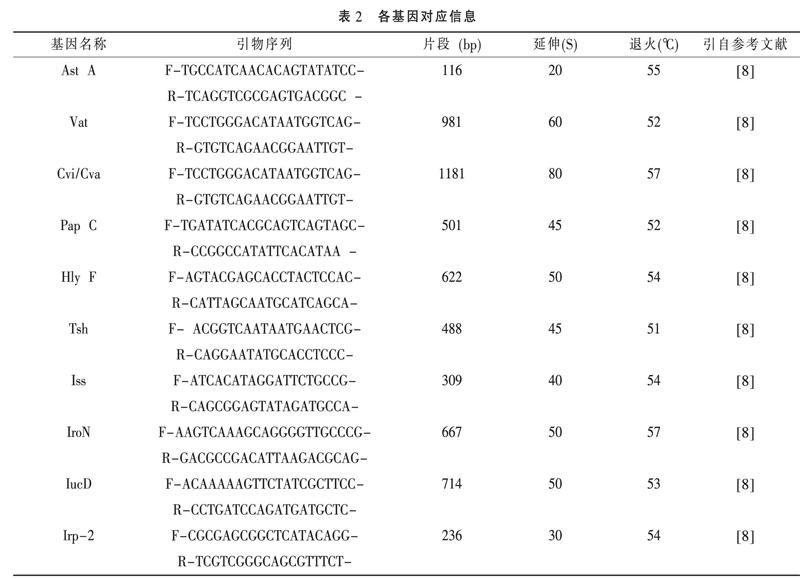
1.1.4 引物设计 此次共设计了10对用于检测大肠杆菌相关基因的引物,包括:毒素基因(Ast A、Vat);血清抗性蛋白基因(Cvi/Cva);黏附素基因(Pap C);溶血素基因(Hly F);温度敏感血凝素基因(Tsh);铁离子摄取系统基因(Iss、Iro N、Iuc D);耶尔森强毒力岛基因(Irp-2)。
1.2 试验方法
1.2.1 大肠杆菌的分离纯化、鉴别 大肠杆菌的分离纯化试验流程参照任丽、张俊丰、张青娴等人发表的文献[1,2,10]。采用麦康凯和大肠杆菌显色培养基对分离的菌株进行鉴别,革兰氏染色后镜检。将判定为大肠杆菌的菌株标记相关信息后冻存在-80℃。
1.2.2 大肠杆菌的活化与药敏试验 采用平板划线法将冻存的大肠杆菌活化;挑取单菌落并在营养肉汤培养基中增殖培养;采用涂布平板法将增殖后的大肠杆菌涂布在LB固体培养基上,按照常规药敏试验流程进行大肠杆菌药敏试验,并测量各药敏片的抑菌圈直径。
1.2.3 大肠杆菌相关基因的检测 按照自动核酸提取仪的操作说明提取大肠杆菌核酸,并将提取的核酸按照DNA扩增试剂盒的说明配制反应体系:Mix 10μl,Taq 酶1μl,上、下游引物各1μl(10pmol),模板3μl,用ddH2O补至20μl;PCR扩增条件:预变性95℃ 2min,变性95℃ 30s,退火30s(退火温度见表2),延伸72℃(延伸时间见表2),重延伸10min。将PCR扩增后的产物进行琼脂糖凝胶电泳。
2 结果与分析
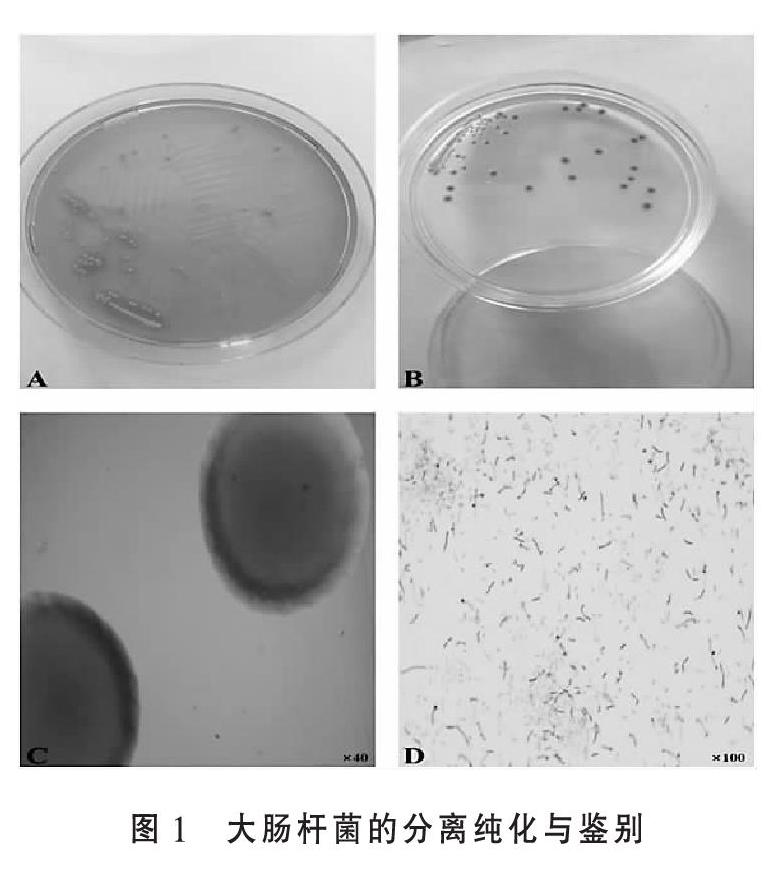
2.1 细菌分离鉴定结果 对发病(死)鸡的组织处理后,无菌条件下分离纯化细菌,并对分离得到的细菌进行鉴别。首先在LB固体培养基上可观察到中间凸起、圆形、光滑湿润、边缘整齐的黄色菌落(图1A);在显色培养基上可观察到绿色凸起、光滑湿润的菌落(图1B);光学显微镜下,麦康凯培养基上的菌落呈圆形,边缘整齐,略呈玫瑰红色(图1C);镜检经革兰氏染色处理后的大肠杆菌可见视野内大小不一的革兰氏阴性菌,呈杆状或粗杆状(图1D)。
2.2 药敏试验结果 按照常规药敏试验流程,对包括标准大肠杆菌菌株在内的20株大肠杆菌进行药敏试验,根据抑菌圈大小,分为耐药、中度敏感和高度敏感。该次试验结果表明,青霉素G和万古霉素对20株大肠杆菌均无抑制作用,而抑菌效果较好的抗生素主要有阿米卡星、庆大霉素。有两株大肠杆菌分离株对上述16种抗生素均有耐药性。17株大肠杆菌对超过5种以上抗生素具有耐药性。总体而言,本次所使用的16中抗生素无一能抑制所有被检菌株。结果如图2所示:
2.3 相关基因检测结果 根据大肠杆菌相关基因检测情况,并进行统计分析;其中13株含有5种以上毒力因子相关基因,占比65%;4株同时含有7种毒力因子相关基因,占比20%;仅1株不含
上述基因。结果如图3所示:
3 讨论
禽大肠杆菌病是一种多发性疾病,尤其在规模化养殖环境中易出现拥挤、潮湿、通风不良等有利于诱发大肠杆菌病的因素[3,5]。众所周知,抗生素的不合理使用是产生耐药菌的主要原因,而耐药菌的毒力基因和耐药基因产生是其致病力和自我保护的适应性变化[5,8,9]。Ast A基因与铁离子摄取与转运系统有关,cvi基因与大肠杆菌素有关, 这两个基因都常存在于大肠杆菌质粒中,二者均为大肠杆菌的毒力基因中的主要成员[4,8]。黏附素与大肠杆菌粘附在宿主的肠绒毛上有关,可引起宿主腹泻、脱水[6]。血清抗性蛋白可明显增强大肠杆菌对血清的抗性,利于大肠杆菌迅速增殖扩散[6]。温度敏感血凝素与细菌早期定殖有关,可引起家禽气囊炎[5,6]。铁离子摄取系统与宿主深部组织损伤关系密切[6]。溶血素与细菌吸附红细胞和产生炎症等过程有关[5,6,11]。大肠杆菌质粒编码的 TEM、CTX-M和SHV型β-内酰胺酶(ESBLs),染色体编码的OXA型ESBLs、质粒介导的Amp C 酶、16S甲基化酶、氨基糖苷类-N-乙酰化酶(AACs)等是其对β-内酰胺类、四环素类、磺胺类及氨基糖苷类抗生素耐药的原因[5]。
由本次试验结果可知,此次所检测的20株大肠杆菌中含有5种毒力因子基因的大肠杆菌占比65%,这也表明对应菌株具有较强的致病力;绝大多数菌株对5种以上常用抗生素具有耐药性,这间接表明了大肠杆菌耐药的严峻形势。建议避免使用细菌明显具有耐药性的药物,如青霉素G、万古霉素、恩诺沙星和链霉素等。只有合理使用抗生素和搞好环境卫生,加强饲养管理才能降低大肠杆菌病的发病率,将损失降至最低。以上试验结果同样对保障公共健康、以防耐药菌株通过食物链进入人体造成危害具有参考价值。
参考文献:
[1] 任丽,徐睿,唐强,等.鸡源致病性大肠杆菌的分离鉴定及药敏试验[J].西昌学院学报(自然科学版), 2019,(01):22-27.
[2] 张俊丰,黄东璋,陈琳,等.鸡肠道大肠杆菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2013,40(11): 179-184.
[3] 于阿芳.鸡致病性大肠杆菌的药敏试验、血清型鉴定及耐药基因的PCR检测[D].泰安:山东农业大学,2009.
[4] 刘璨颖,李建宏,梅启定,等.禽源致病性大肠杆菌的耐药性和毒力基因研究[J].中国家禽,2018,40(13): 21-25.
[5] 王利勤.鸡源致病性大肠埃希菌耐药基因及毒力基因检测研究[D].杨凌:西北农林科技大学,2012.
[6] 刘红玉,王君玮,王娟,等.禽大肠杆菌毒力因子的研究进展[J].中国动物检疫,2013,30(10):25-29.
[7] CHRISTA E,TRAUTE J,SABINE K,et al.Rapid detection of virulence-associated genes in avian pathogenic Escherichia coli by multiplex polymerase chain reaction[J].Avian Diseases,2005,49(2):269-273.
[8] ZHAO L,GAO S, HUAN H,et al.Comparison of virulence factors and expression of specific genes between uropathogenic Escherichia coli and avian pathogenic E.coli in a murine urinary tract infection model and a chicken challenge model[J]. Microbiology,2009,155(5):1634-1644.
[9] EWERS C,JANSSEN T,KIESSLING S,et al. Rapid detection of virulence-associated genes in avian pathogenic Escherichia coli by multiplex polymerase chain reaction[J].Avian Dis, 2005, 49(2): 269-273.
[10] 張青娴,徐引弟,王治方,等.猪源肠外大肠杆菌的分离鉴定及耐药性分析[J].上海畜牧兽医通讯,2017, (06):6-9.
[11] 赫鸣睿.大肠杆菌毒力因子及耐药机制研究进展[J].现代畜牧科技,2018,(09):4-5.
Abstract:To understand the virulence factors and drug resistance of poultry Escherichia Coli in Shandong province in recent years, to analyze potential public safety issues, In this study, PCR detection and drug susceptibility test of virulence gene were performed simultaneously for the standard strain of Escherichia Coli preserved in our laboratory and the strain isolated from the diseased (dead) chickens. The results showed that among the 16 kinds of common antibiotics, penicillin G and vancomycin had no inhibitory effect on 20 strains of Escherichia Coli. Two strains of Escherichia coli isolates were not sensitive to the above 16 kinds of antibiotics, and 17 strains of Escherichia coli were resistant to more than 5 kinds of antibiotics.The 13 strains contained more than 5 virulence factor genes, accounting for 65%.The 4 strains contained 7 virulence factor genes at the same time, accounting for 20%.Only 1 strain did not contain the tested virulence gene. The above results show that the situation of Escherichia coli drug resistance is very serious, and some strains have strong pathogenicity. The results of this experiment also have reference significance for public health protection and preventing drug-resistant strains from entering the human body through the food chain and causing harm.
Key Words:Chicken-derived Escherichia Col;Virulence factor;Drug resistance;Drug sensitive test
