脂多糖(LPS)对小鼠Raw 264.7细胞Irak1bp1表达的影响
2019-08-08谈志丽王迎迎施青青徐国荣刘亮明
谈志丽 王迎迎 何 玉 钟 欢 施青青 杨 雪 徐国荣 刘亮明
(上海市松江区中心医院感染科 上海 201600)
巨噬细胞是体内重要的免疫细胞之一,在机体免疫炎症反应中发挥重要的作用,其表面的模式识别受体(pattern recognition receptor,PRR)如Toll样受体4(toll-like receptor 4,TLR4)可被外来病原体或内毒素激活,启动炎症信号通路,促进促炎细胞因子的表达与分泌[如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6和IL-1β等],产生损伤性炎症反应[1]。IL-1受体相关激酶1结合蛋白1(IL-1 receptor associated kinase 1 binding protein 1,Irak1bp1)的编码基因位于6q14.1,全长79 356 bp[2],是Irak1蛋白质的结合蛋白。Irak1蛋白质在TLR4介导的MyD88依赖的信号通路中,被接头蛋白MyD88磷酸化后激活TNF受体相关因子6(TNF receptor associated factor 6,TRAF6)并使之泛素化,泛素化的TRAF6分子招募转化生长因子-β活化激酶 1(TGF-β activated kinase-1,TAK1),TAK1 能够磷酸化激活IkB蛋白激酶(IkB kinase,IKK),进而促进NF-κB释放入核,激活NF-κB炎症通路[3]。目前研究表明Irak1bp1蛋白质与炎症关系密切,但是对于炎症反应的具体调控作用及调控机制仍存在不同的观点[4-5],Conner等[6]研究发现Irak1bp1能够抑制IL-6分泌而促进IL-10分泌,发挥抑炎作用;而Benson等[7]却发现Irak1bp1能够促进IL-6及IL-8分泌。为进一步了解Irak1bp1蛋白质与炎症反应的关系,本研究采用脂多糖(lipopolysaccharide,LPS)刺激小鼠Raw 264.7细胞,研究核内外Irak1bp1蛋白质的表达情况。
材 料 和 方 法
主要试剂和材料单核细胞系Raw 264.7细胞购自中国科学院上海细胞库;胎牛血清购自美国Gibco公司;LPS购自美国Sigma公司;Trizol试剂购自美国Invitrogen公司;PCR相关试剂购自日本Takara公司;ELISA相关试剂购自美国Ebioscience公司;Western blot相关试剂购自上海碧云天生物技术有限公司;Irak1bp1兔多克隆抗体购自美国Abcam公司;β-actin及Lamin B1兔单克隆抗体购自美国Cell Signaling公司。
细胞培养采用RPMI 1640细胞培养基(含90% RPMI 1640培养液、10% FBS和100 U/mL青链霉素混合液),于37 ℃、5% CO2培养箱中培养小鼠Raw 264.7细胞。采用锥虫蓝染色检测细胞活力。
细胞分组和处理细胞接种于6孔板,每孔细胞数为5×105个。培养24 h待其稳定贴壁后,将细胞随机分成2组:A组为正常对照组,B组为LPS刺激组。LPS以RPMI 1640培养液配置,终浓度为20 μg/mL,剂量及用法见参考文献[8],于37 ℃、5% CO2培养箱中培养。LPS刺激6 h后分别收集细胞和上清液用于后续实验,实验重复6次。
总RNA的提取和质量检测采用Trizol试剂提取总RNA,具体操作按照说明书进行。采用吸光度比值(D260/280)及琼脂糖凝胶电泳鉴定RNA纯度及完整性:纯度良好(1.8~2.0)、RNA条带完整(28S和18S条带明亮清晰,28S的亮度是18S的2倍以上)者进行下一步实验。
逆转录和实时荧光定量PCR取1 μg RNA作为模板用于第一链cDNA的合成,具体流程按照逆转录试剂盒说明书进行。引物的设计与合成由上海生工生物技术有限公司完成,目的基因和内参引物序列见表1。实时荧光定量PCR反应体系(20 μL):2×SYBR Premix Ex Taq (Tli RNaseH Plus)10 μL、上游引物(10 μmol/L) 0.4 μL、下游引物(10 μmol/L) 0.4 μL、50×ROX参比染料Ⅱ 0.4 μL、DNA 模板2 μL、dH2O(灭菌蒸馏水) 6.8 μL。采用两步法进行扩增,第1步:95 ℃、30 s,1个循环;第2步:95 ℃、5 s,60 ℃、34 s,40个循环。GAPDH为内参基因,采用2-ΔΔCT方法对数据进行相对定量分析。
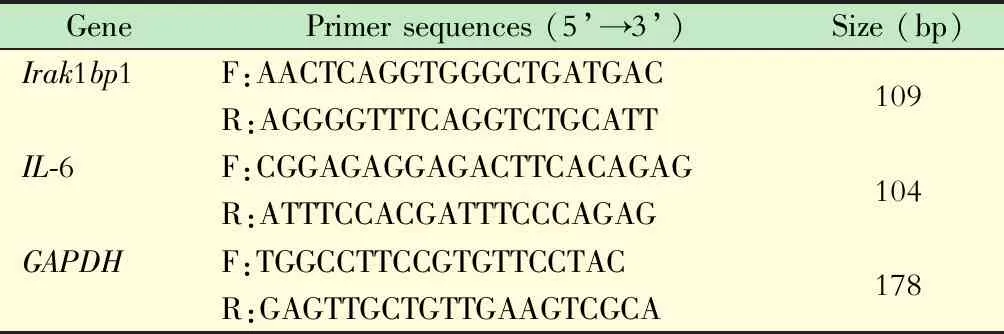
表1 基因扩增引物序列和产物长度Tab 1 Primer sequences and product length of gene amplication
ELISA检测采用双抗体夹心酶联免疫技术检测细胞上清液中 IL-6的水平,按照试剂盒说明书进行操作。每份标本设2个复孔,取均值。实验重复6 次。
Western blot检测按照Western blot及IP裂解液说明书进行总蛋白提取,浆蛋白及核蛋白提取按照碧云天核蛋白和浆蛋白抽提试剂盒说明书进行。采用BCA法检测蛋白质浓度,变性、分装后于-70 ℃冻存。取30 μg总蛋白、浆蛋白及核蛋白进行10 % SDS-PAGE,电泳后将蛋白质转移至NC膜,室温牛奶封闭2 h,兔抗鼠一抗(1∶1 000稀释) 4 ℃过夜,TBST漂洗,加入辣根过氧化酶标记的山羊抗兔二抗,室温反应1 h。 漂洗后置于显色液中显色,通过伯乐分子成像系统成像并观察,采用image J软件进行灰度值分析。

结 果
LPS促进Raw 264.7细胞IL-6 mRNA表达A、B组Raw 264.7细胞IL-6 mRNA相对水平分别为1.00±0.06(n=6)和8.13±0.50(n=6),B组较A组显著升高(P<0.01,图1),提示LPS促进Raw 264.7细胞IL-6 mRNA的表达。

A:Control group;B:LPS stimulation group.
图1 LPS刺激的Raw 264.7细胞IL-6 mRNA相对水平
Fig 1 Relative level of IL-6 mRNA in Raw 264.7cells stimulated by LPS
LPS促进Raw 264.7细胞IL-6 蛋白质表达B组IL-6 蛋白质相对水平较A组显著升高(444.89±103.43vs.162.08±51.78,P<0.01),提示LPS能够促进Raw 264.7细胞IL-6 蛋白质表达(图2)。
LPS促进Raw 264.7细胞Irak1bp1 mRNA表达B组Irak1bp1 mRNA 相对水平较A组升高(1.21±0.10vs.1.00±0.06,P<0.01),提示LPS促进Raw 264.7细胞Irak1bp1 mRNA的表达(图3)。
A:Control group;B:LPS stimulation group.
图2 LPS刺激的Raw 264.7细胞上清IL-6蛋白质相对水平
Fig 2 Relative level of IL-6 protein in the supernatant ofRaw 264.7 cells stimulated by LPS

A:Control group;B:LPS stimulation group.
图3 LPS刺激的Raw 264.7细胞Irak1bp1 mRNA相对水平
Fig 3 Relatvie level of Irak1bp1 mRNA in Raw 264.7cells stimulated by LPS
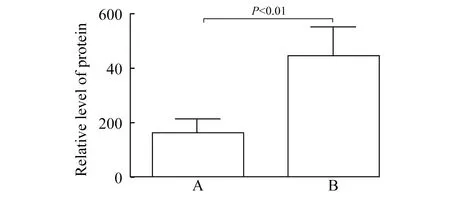
LPS促进Raw 264.7细胞Irak1bp1蛋白质表达B组Irak1bp1总蛋白水平较A组显著增高(1.36±0.20vs.1.00±0.00,P<0.05),提示LPS促进Raw 264.7细胞Irak1bp1总蛋白的表达(图4)。
A:Control group;B:LPS stimulation group.
图4 LPS刺激的Raw 264.7细胞Irak1bp1总蛋白相对水平
Fig 4 Relative level of total Irak1bp1 protein inRaw 264.7 cells stimulated by LPS
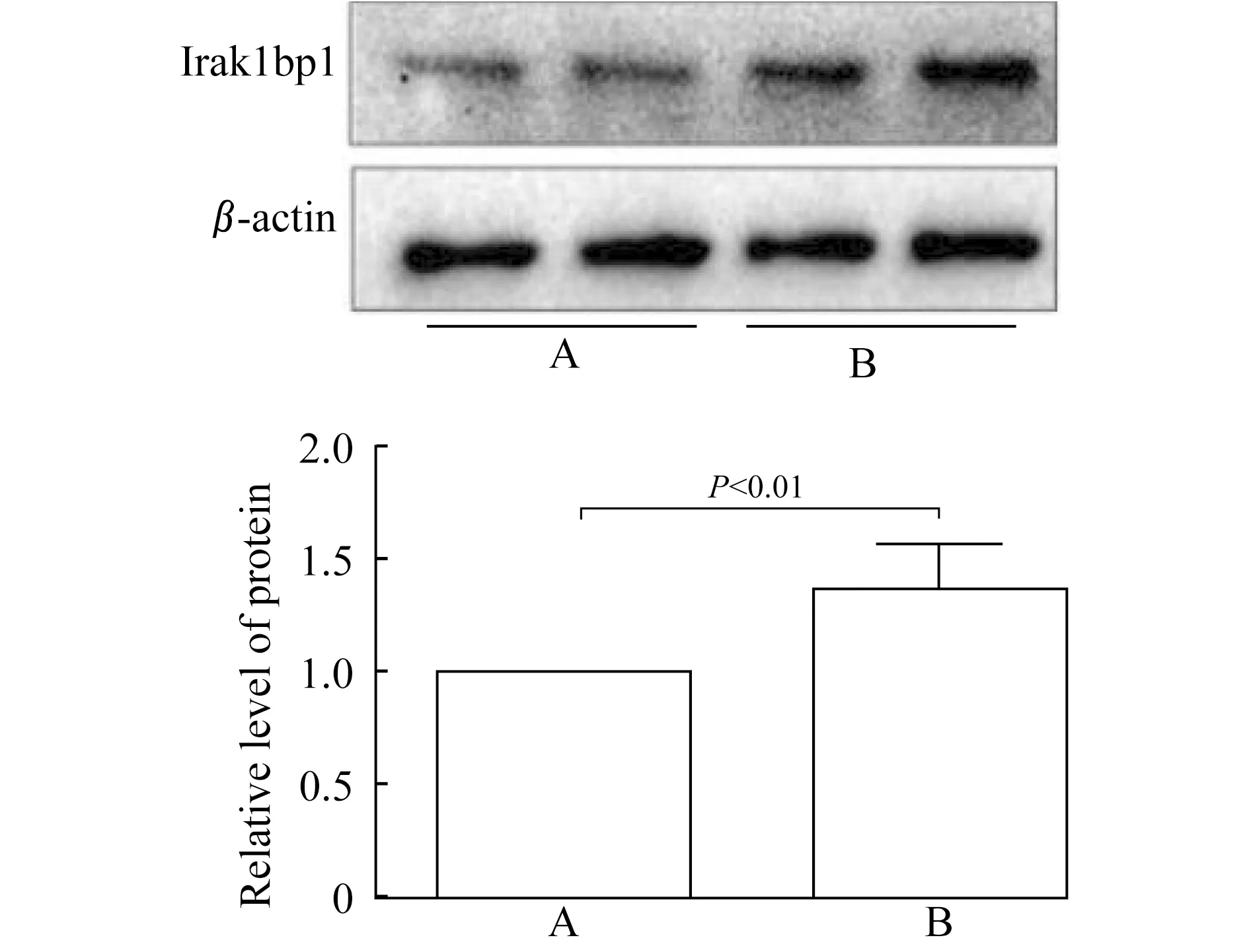
LPS单独处理不影响胞质内Irak1bp1蛋白质表达B组Raw 264.7细胞胞质内Irak1bp1蛋白质相对水平与A组相比差异无统计学意义(1.12±0.27vs.1.00±0.00),提示 LPS单独处理并不影响胞质内Irak1bp1蛋白质表达(图5)。
A:Control group;B:LPS stimulation group.
图5 LPS刺激的Raw 264.7细胞胞质Irak1bp1
蛋白质相对水平
Fig 5 The relative level of cytoplasmic Irak1bp1 protein inRaw 264.7 cells stimulated by LPS
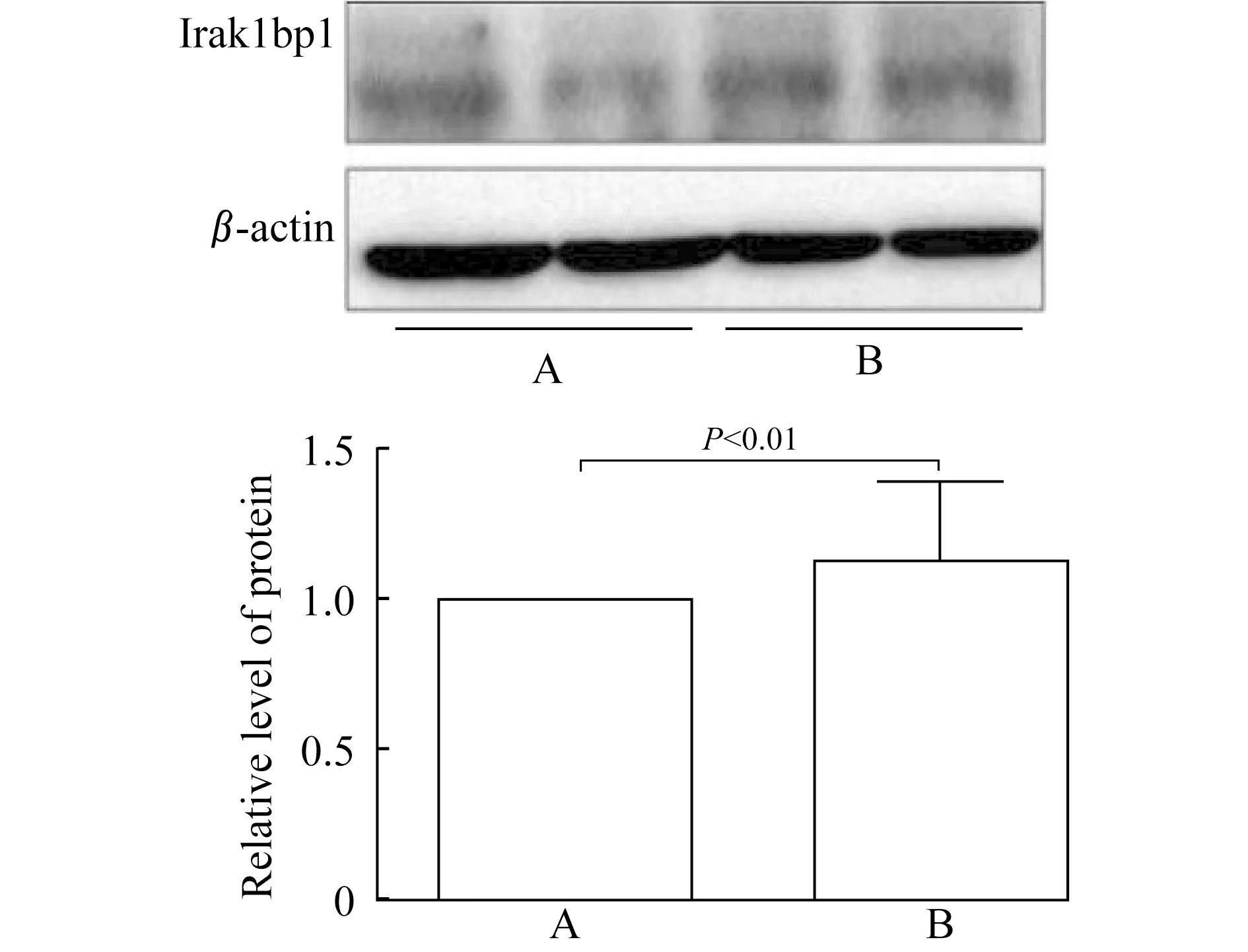
LPS促进核内Irak1bp1蛋白质表达B组Raw 264.7细胞Irak1bp1浆蛋白相对表达水平较A组显著增高(1.61±0.45vs.1.00±0.00,P<0.01),提示LPS促进核内Irak1bp1蛋白质表达(图6)。

FigA:Western blot result;Fig B:Relative expression level.A:Control group;B:LPS stimulation group.
图6 LPS 刺激的Raw 264.7细胞胞核内Irak1bp1
蛋白质相对水平
Fig 6 The relative level of nuclear Irak1bp1 protein inRaw 264.7 cells stimulated by LPS
讨 论
作为重要的免疫细胞之一,巨噬细胞可以依靠其表面的CD14分子和TLR被LPS激活,进而启动MyD88依赖和TRIF依赖的信号通路[9],诱导促炎因子释放[10],在急性肝衰竭[11-12]、急性胰腺炎[13]等多种免疫损伤性疾病的发生发展中发挥作用。
Irak1bp1是Irak1蛋白质的结合蛋白,目前对于其功能的研究十分缺乏,仅有的研究显示Irak1bp1与炎症关系密切,但是对于炎症反应的具体调控作用及机制仍存在不同的观点[4-5]。Harrington团队研究发现Irak1bp1能够促进炎症反应,过表达Irak1bp1能够促进IL-6及IL-8的分泌,而且能够增强TNF-α诱导的NF-κB激活[5,7]。进一步研究发现,Irak1bp1功能发挥可经历以下步骤:(1)磷酸化 Irak1bp1是Irak1蛋白的结合蛋白,也是Irak1的磷酸化底物[14],在TNF-α诱导的NF-κB激活过程中,Irak1首先被TNF-α作用而磷酸化[15],继而磷酸化Irak1bp1并促使其入核[14]。Irak1催化活性缺失可抑制Irak1bp1入核,也能阻断TNF-α诱导的NF-κB的激活[14],Irak1bp1的磷酸化是其功能发挥的首要步骤。(2)核转位Irak1bp1序列中存在与p65、p50等入核基因相似的核定位序列,Irak1bp1磷酸化后进入细胞核,能够增强NF-κB p65亚基的转录激活能力,核定位序列缺失将削弱上述作用[16],核转位是Irak1bp1功能发挥的基础。(3) p65/MED1/Irak1bp1复合体形成:MED1是核受体协同刺激因子,p65/MED1/Irak1bp1复合体的形成有助于p65转录激活作用的增强[17]。然而,Conner团队却有不同的发现,Irak1bp1在缺失核定位序列时仍然能够调控炎症反应,并且主要起抑制炎症的作用,Irak1bp1在胞质中与p105结合,通过某种途径(目前尚不明确)促使NF-κB抑制性亚基p50/p50入核比例增高[4],p50及其前体蛋白p105又称NF-κB1,属于NF-кB家族成员,具有DNA结合的能力,但无基因转录激活能力[18-19]。p50/p50入核增多,与P65/P50竞争炎症因子结合位点,进而抑制IL-6分泌及其抑炎作用[4]。
为进一步了解Irak1bp1蛋白质与炎症反应的关系,本研究采用LPS刺激Raw 264.7细胞,并研究Irak1bp1的表达情况。我们发现LPS刺激诱导Raw 264.7细胞IL-6 mRNA及蛋白质表达的同时促进Irak1bp1 mRNA的表达,通过Western blot也发现LPS刺激促进Raw 264.7细胞分泌Irak1bp1蛋白质,提示Irak1bp1蛋白质与TLR介导的炎症反应关系密切,这与Conner等[6]的研究结果一致。进一步研究显示LPS主要使核内Irak1bp1蛋白质水平增加,而对胞质内Irak1bp1蛋白质水平没有影响,提示LPS能够促进Irak1bp1进入细胞核,多项研究显示LPS能够通过激活TLR4-MyD88信号通路激活IRAK1蛋白质[3],这与既往研究结果类似[14-16],即IRAK1磷酸化Irak1bp1蛋白质入核并发挥作用。Irak1bp1对于炎症反应具体的调控作用目前仍不明确,不同研究团队得出的不同观点可能与其研究对象不同、刺激因素及研究的侧重点不同有关,Irak1bp1的炎症调控作用及调控机制仍然需要进一步研究。
