紫薯花色苷的抗氧化活性及其稳定性研究
2019-08-08曾繁森叶妍琦张美清郑诗钰
曾繁森, 叶妍琦, 张美清, 郑诗钰, 李 洁, 费 鹏*
(闽南师范大学生物科学技术学院,福建漳州363000)
紫薯(Purple Potato),又名黑薯、苕薯,是旋花科(Convolvulaceae)番薯属(Ipomoea).除具有普通红薯的营养成分以外,还富含硒元素和花色苷,是提取制备花色苷的主要原料之一,在日本国家蔬菜癌症研究中心公布的抗癌蔬菜中名列榜首.紫薯色泽美观,营养丰富,从茎尖嫩叶到薯块都有一定的保健功能.不仅如此,紫薯还含有丰富的花色苷.花色苷是自然界最重要的水溶性的色素之一,其是通过糖苷键将花青素与糖苷连接起来的黄酮类化合物,广泛存在于植物体的根、茎、叶、花、果实之中,具有抗氧化、清除体内自由基、抗炎、抗肿瘤、抑制肥胖、调节血脂平衡、抑制胆固醇等多种生物活性[1].
天然植物中的花色苷种类有很多,形貌、性质等各有不同,但大多数花色苷均可以根据环境中的酸碱情况形成不同的构型,发生不同的显色反应.食品的腐坏变质会伴随胺、氨等挥发性含氮化合物的产生,从而造成pH 环境的改变[2].因此,根据花色苷颜色随着环境pH 值变化而变化这一特性,可将其作为食品保鲜膜的气敏材料,反映食品的新鲜程度.另外,花色苷存在广泛,提取容易,是理想的抗氧化、抑菌添加剂[3].作为天然的抗氧化添加剂,不像合成的抗氧化剂那样受到人们的质疑.将其添加到食品保鲜膜中,会从保鲜膜中缓慢扩散到所包裹食品的表面甚至是内部,阻止食品内营养物质的氧化,延长食品的保质期.
实验采用浸提法提取紫薯中的花色苷, 研究其对pH 值的响应; 以Vc 为对照, 研究紫薯花色苷对DPPH、OH 自由基的清除效果;以及温度、pH 值、光照对紫薯花色苷稳定性的影响.通过这几项测试结果能够分析紫薯花色苷作为添加剂加入气敏性食品保鲜膜的可行性,为紫薯花色苷在气敏性食品保鲜膜的应用和开发提供参考和借鉴.
1 材料与方法
1.1 材料与试剂
材料与试剂见表1.
表1 实验所用主要试剂Tab.1 Reagents used in the experiment
1.2 设备与仪器
设备与仪器见表2.

表2 实验所用主要仪器设备Tab.2 Instruments and equipment used in the experiment
1.3 实验方法
1.3.1 紫薯花色苷的提取
将紫薯烘干、粉碎后,过40 目筛得到干粉状原料,置于棕色瓶避光保存.将2% (w/v)的乙酸水溶液和无水乙醇以体积比1∶1 混合作为浸提剂,并与原料按照料液比1∶15 g/mL 混合,超声处理30 min,再于水浴锅中在50 ℃条件下浸提90 min, 取出后经过抽滤得到色素浸提液.再将色素浸提液置于旋转蒸发仪中,50 ℃下旋转蒸发浓缩,再将浓缩液经冷冻干燥去除浸提剂,得到花色苷粉末并冷藏避光保存备用.
1.3.2 花色苷含量测定
使用pH 示差法测定花色苷含量,参照国标GB1886.244-2016.
按照公式(1)计算花青素含量.

吸光度值,A=(A526nm-A700nm)pH1.0-(A526nm-A700nm)pH4.5;MW 为矢车菊色素-3-葡萄糖苷 (Cyanidin-3-O-glucoside)的相对分子量(449.2 g/mol);ε 为摩尔消光系数(26 900 L·mol-1·cm-1), DF 为稀释因子(V/Wt).
1.3.3 紫薯花色苷对pH 值的响应
分别配制pH 值为1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0 ,11.0 ,12.0,13.0 的缓冲溶液;取13 份4 mL 花色苷浓缩液,用上述缓冲溶液分别定容至25 mL,并通过全波长酶标仪作全波长扫描,探讨花色苷提取物的吸光特性对pH 值响应;
1.3.4 花色苷的抗氧化性测定
1)DPPH 自由基清除率测定
配制0.25 mmol/L DPPH 溶液和50 mg/L 维生素C 溶液, 然后取10 mL 花色苷浓缩液, 定容至100 mL;分别取 0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 和 1.0 mL 的花色苷浓缩液及维生素 C 溶液,分别加入到 4 mL DPPH 溶液中, 黑暗中静置 30 min, 以相应浓度的花色苷浓缩液和维生素C 溶液为空白对照,测试紫外-可见全扫描光谱,按公式(2)计算DPPH 自由基清除率.
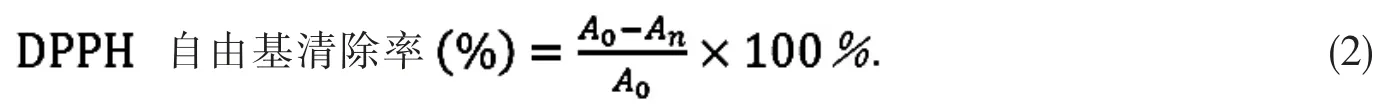
其中,An为样品测得的最大吸光度,A0为参照测得的相应吸光度.
2)羟基自由基清除率测定
分别配制2 mmol/L 的FeSO4,2 mmol/L 的H2O2溶液,2 mmol/L 的水杨酸乙醇溶液和1 g/L 维生素C溶液;取10 ml 花色苷浓缩液,定容至100 mL;分别取3 mL FeSO4和 3 mL 水杨酸加入到10 mL 离心管中,混合均匀;分别取 0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 和 1.0 mL 的花色苷浓缩液加入到上述离心管中;将离心管置于37 ℃水浴中加热30 min,以相应浓度的花色苷浓缩液和维生素C 溶液为空白对照,测试紫外-可见全扫描光谱,按公式(3)计算OH 自由基清除率.
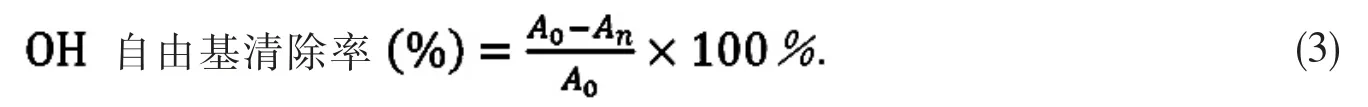
其中,An为样品测得的最大吸光度,A0为参照测得的相应吸光度.
1.3.5 紫薯花色苷的稳定性研究
取9 份 5 mL 花色苷浓缩液,稀释至 25 mL,分别将其置于不同温度下(4 ℃、25 ℃、40 ℃),不同 pH(4、7、10)以及不同光照环境(紫外光、光照、黑暗)下储藏5 d,每天对其作紫外可见全扫描,分析其在不同环境下的降解状况.
1.3.6 花青素提取物的分子基团及表观形貌分析
通过IS10 型全反射红外光谱(ATR-FTIR)表征紫薯花色苷的表面基团,波数范围4 000-400 cm-1,扫描次数64 次,分辨率4 cm-1;使用扫描电镜(SEM)在合适视野中采集紫薯花色苷粗提物的微观图像,研究其表观形貌,加速电压为10 kV.
2 结果与讨论
2.1 紫薯花色苷的含量
本次实验采用pH 示差法检测了样品中总花色苷的含量,检测结果如图1 所示,代入公式(1)可得此次所得花色苷浓缩液中花色苷含量为25.64 mg/L,通过冷冻干燥将花色苷浓缩液干燥成粉末样,其粗提物中花色苷含量为0.29 mg/g.
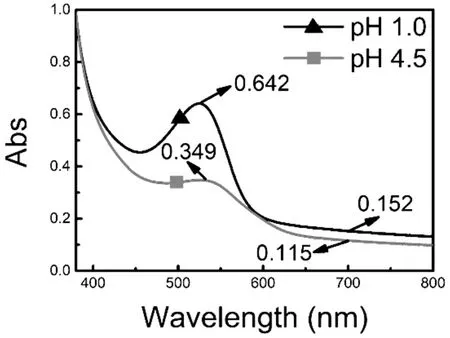
图1 紫薯花色苷在pH 1.0 及pH 4.5 时可见光区全波段光谱图Fig.1 UV-Vis absorption spectra of purple potato anthocyanin at pH 1.0 and pH 4.5
2.2 紫薯花色苷颜色对pH 值的响应
如图2 所示,图中吸收峰波长发生了四次明显变化,分别对应了不同pH 下花色苷四种结构的转变:从pH1.0-4.0 时,最大吸收峰位置出现在520 nm 左右,这是由于花色苷以红色的花色烊阳离子形式存在导致的;随着pH 值的不断增大,其在520 nm 处的吸收峰强度逐渐降低,这是由于花色烊阳离子结构的减少且逐渐转化为无色的甲醇假碱和查尔酮假碱导致的;当pH 值上升至7.0 时,花色烊阳离子结构几乎完全消失,花色苷最大吸收波长发生红移(图2B);当pH 达到8.0 时,溶液成明显的蓝绿色,花色苷最大吸收波长为618 nm,这是由于花色苷结构开始转变为蓝色醌式结构造成的,且随着pH 值继续上升,蓝绿色不断加深,最大吸光度随之上升(图2C);当pH 值继续上升至11.0-13.0 时,溶液逐渐转变为黄绿色,最大吸收波长仍然在618 nm 处,但吸光度逐渐降低,这是由于在强碱环境下,花色苷的蓝色醌式结构不稳定,形成共振稳定的醌式阴离子造成的[4].
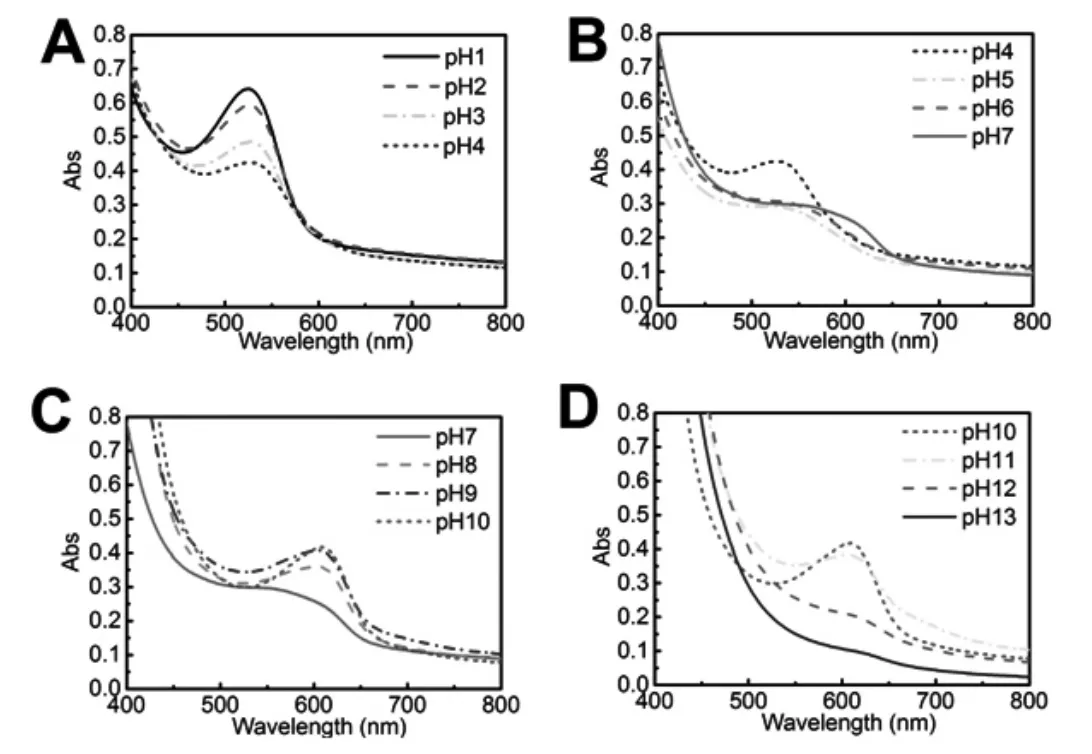
图2 不同pH 值下紫薯花色苷的可见光区全波段光谱图Fig.2 UV-Vis absorption spectra of purple potato anthocyanin at different pH value
2.3 紫薯花色苷的自由基清除能力
在食品中,过多的自由基会削弱细胞的抵抗力,产生破坏细胞的化学物质.这会使细胞膜丧失保护细胞的功能,导致食品更易受到微生物的感染,使食品更易腐败,产生对人体有害的物质[5].而紫薯花色苷具有较强的还原性,可以清除环境中氧自由基[6].
2.3.1 紫薯花色苷的DPPH 自由基清除率
在该实验中所采用的紫薯花色苷和Vc 浓度分别为2.56 mg/L、50.00 mg/L, 不同添加量紫薯花色苷和Vc 溶液对DPPH·的清除能力如图3 所示.实验发现,在清除剂加入的1 min 内,溶液颜色即随清除剂添加量增加而逐渐变浅.由图3 可知,DPPH 自由基清除率随着紫薯花色苷和Vc 溶液添加量的增加而增加, 计算可得紫薯花色苷和Vc 对DPPH 自由基清除率的IC50值分别是0.23 mg/L 和6.07 mg/L.由此可知,紫薯花色苷的DPPH·清除能力远高于Vc,且在所选添加量范围内,随着花色苷浓度增加,清除能力能够继续提高到80 %以上.
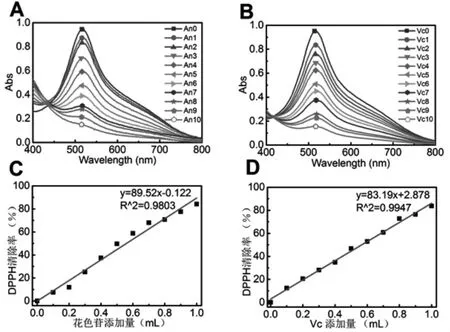
图3 紫薯花色苷(A, C)与Vc (B, D)的DPPH 自由基清除率Fig.3 DPPH free radical scavenging rate of purple potato anthocyanin (A, C) and Vc (B, D)
2.3.2 紫薯花色苷的羟基自由基清除率
在该实验中所采用的紫薯花色苷和Vc 浓度分别为2.56 mg/L、1 g/L.不同添加量的紫薯花色苷溶液和Vc 溶液对OH 自由基清除率如图4 所示.实验发现,在清除剂加入的1 min 内,溶液颜色即随清除剂添加量的增加而逐渐变浅.由图可知,·OH 清除率随着紫薯花色苷溶液和Vc 溶液添加量的增加而增加,通过计算可得紫薯花色苷和Vc 对·OH 清除率的IC50 值分别是0.384 mg/L 和106.3 mg/L.因此可知,紫薯花色苷溶液的·OH 清除能力远高于Vc.
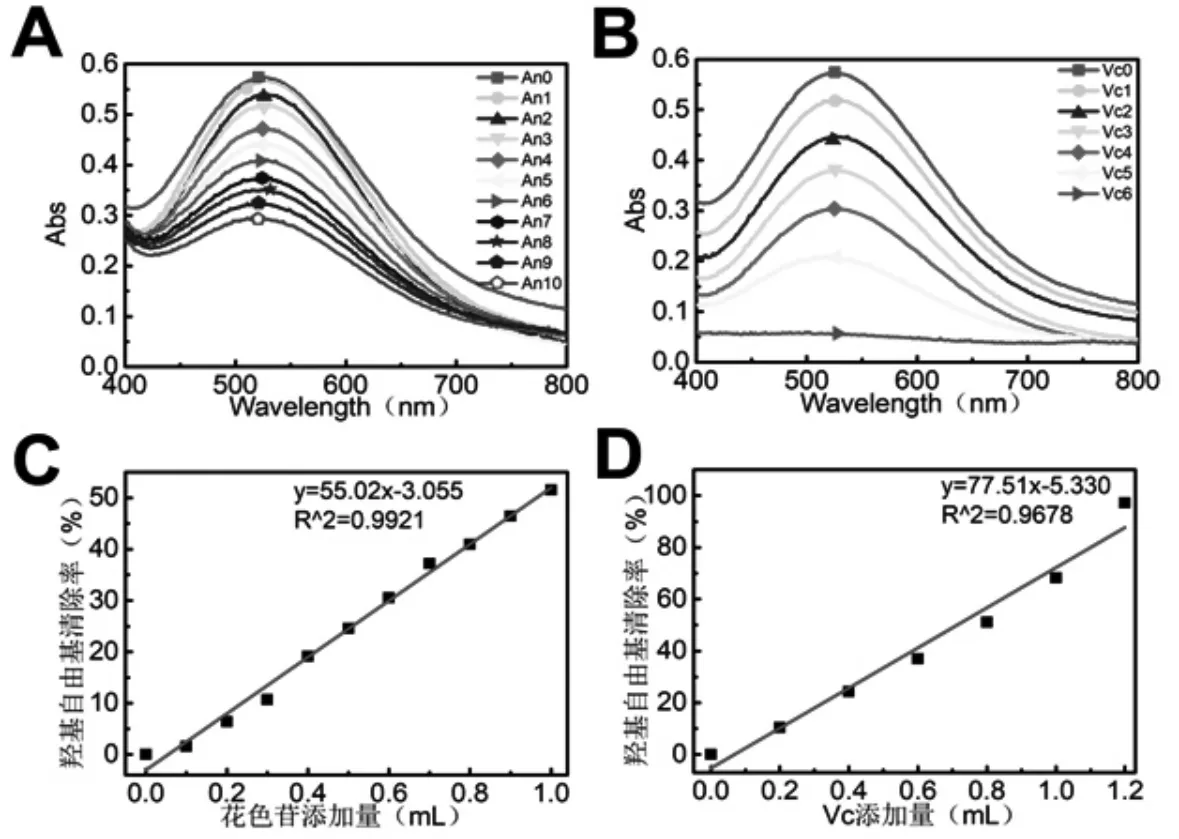
图4 紫薯花色苷(A, C)与Vc (B, D)的·OH 自由基清除率Fig.4·OH radical scavenging rate of purple potato anthocyanin (A, C) and Vc (B, D)
2.4 不同贮藏条件下紫薯花色苷的稳定性
由上文可知,紫薯花色苷有很强的还原能力,暴露在空气中易发生氧化降解.而若要作为食品保鲜膜的成分,必须有一定耐储能力.因此有必要对紫薯花色苷的稳定性进行评价.
分别选取了不同温度、pH 值、光照条件为测试条件,对紫薯花色苷的稳定性进行评价。
如图5A 所示,相同浓度、pH 值的紫薯花色苷溶液在不同温度下随保存时间的增加,发生了不同程度的降解.同时,温度越高,其降解越快.但是总体来说,紫薯花色苷的稳定性较好,在4 ℃下储藏5 天,其降解率仅为3.1 %,即便储藏温度上升至40 ℃,紫薯花色苷的5 天降解率也仅为7.9 %.
如图5B 所示,紫薯花色苷在pH 4 下储存时,其降解率最低,仅为2.03 %(5 天).当pH 值增大时,其降解率不断升高:在pH 10 下储藏5 天时,紫薯花色苷降解率达到7.95 %.这是由于在碱性条件下,紫薯花色苷主要以醌式结构存在,而醌式结构不稳定,会形成共振稳定的醌式阴离子.由此可知,紫薯花色苷在酸性条件下稳定性较差.
由图5C 可以看出紫薯花色苷溶液在紫外光照条件下, 花色苷降解率较大, 在第5 天时降解率达到15.92 %.而在有光照和避光条件下,花色苷降解率较紫外光照射下变化不显著,降解率分别为6.25 %和4.79 %.光是植物合成花色苷的条件之一,但光同时也会加快花色苷的降解[7].强光使花色苷2、4 位碳原子活性增强,更易受到亲水攻击而加快降解速率[8].
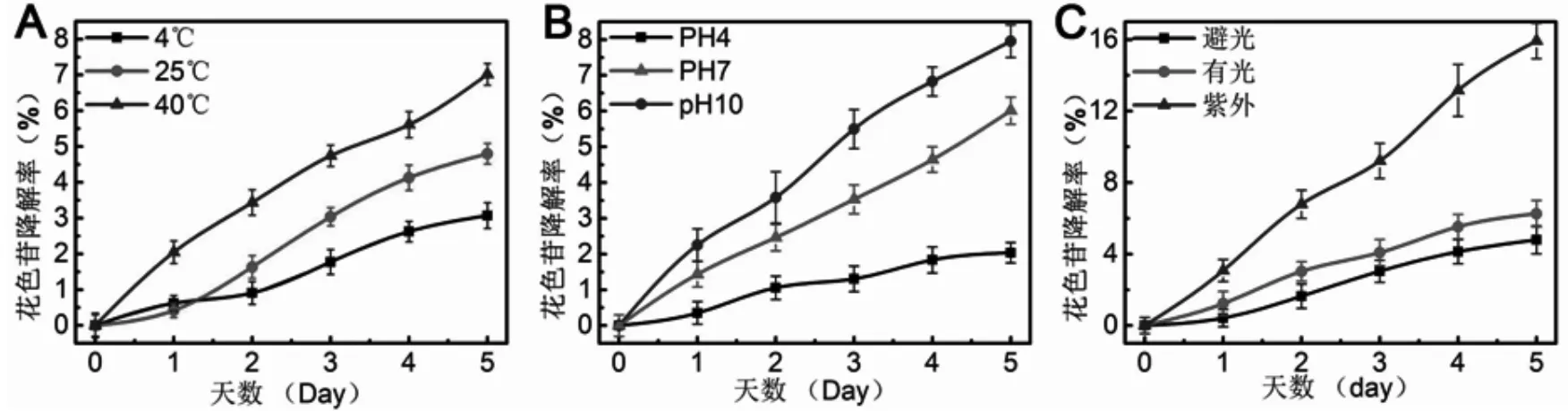
图5 不同条件下花色苷降解率变化(A:温度,B:pH 值,C:光照)Fig.5 Changes of purple potato anthocyanin degradation rate under Different Conditions(A:temperature,B:pH value,C: light levels)
2.5 紫薯花色苷粗提物的分子基团及表观形貌
如图6A 所示紫薯花色苷的红外谱图在3 306 cm-1处有宽而强的吸收峰, 这正是由于紫薯花色苷结构中的芳环与其环上多个糖基上的众多羟基的伸缩振动导致的;在2 983 cm-1处有一吸收峰,是由于与糖基相连的甲基、 亚甲基的伸缩振动引起的.紫薯花色苷在1 644 cm-1处的弱峰为酰胺的伸缩振动特征峰,有研究表明酰胺化程度越高,花色苷越稳定[9].而1 459,1 414 cm-1处则对应了花色苷苯并吡楠的芳环和杂环的骨架振动.1 383,1 279,1 083 cm-1处的一系列吸收峰对应了紫薯花色苷糖环上碳氧键的伸缩振动.因此,初步判断紫薯花色苷由于其结构的酰胺化,而增强了其稳定性,所以其能在不同条件下稳定保存.由图6B 可以看出,当紫薯花色苷粗提物干燥成粉末时,呈现粗糙不平的蜂窝状结构,这可能是由于紫薯花色苷粗提物中富含的大量多糖交联形成的,这种结构能够保护花色素分子,阻止其分子的分解,进一步提高花色苷的稳定性[10].
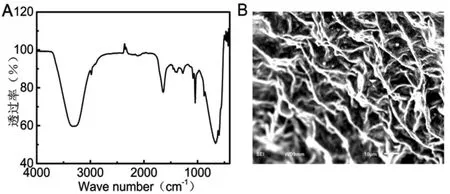
图6 紫薯花色苷粗提物的红外光谱及其表观形貌Fig.6 Infrared spectra and apparent morphology of purple potato anthocyanin
3 结论
本实验以浸提法提取紫薯花色苷,其粗提物的花色苷含量为0.29 g /g;对紫薯花色苷进行自由基清除能力实验,以Vc 为对照,通过比较试样的吸光度,发现花色苷清除DPPH 及·OH 自由基能力均强于同质量浓度的Vc,证明其具有较好的抗氧化性能;以温度、pH 值、光照为条件对紫薯花色苷进行了稳定性的测试,发现紫薯花色苷对光热敏感,在酸性条件下稳定性较高;实验最后通过红外光谱和扫描电镜对紫薯花色苷进行结构组成和表观形貌分析,发现紫薯花色苷有一定的酰胺化及多糖交联结构,这两种结构共同起到保护紫薯花色苷,阻止其分解的作用,增强其稳定性.
因此,紫薯花色苷作为天然色素,来源丰富,安全性系数高,拥有较好的抗氧化能力.能够起到防止食品腐败变质,延长其保质期的作用.同时,紫薯花色苷能够根据外界pH 值变化而改变颜色,其处于日常生活条件下的稳定性也较好,是气敏性食品保鲜膜的理想原料.有望将其应用于气敏性食品保鲜膜中,起到食品保鲜和新鲜度检测的作用,在食品行业中得到广泛应用.
