广东紫菜Hsp70基因cDNA克隆与表达分析*
2019-08-05陈伟洲陈泽攀刘浩然
曾 俊 陈伟洲 陈泽攀 刘浩然
广东紫菜基因cDNA克隆与表达分析*
曾 俊 陈伟洲①陈泽攀 刘浩然
(汕头大学 广东省海洋生物技术重点实验室 汕头 515063)
为探索广东紫菜()叶状体基因在温度刺激下机体耐温相关分子机制,为广东紫菜的栽培生产提供技术参考,本研究利用RACE技术获得了广东紫菜基因()全长序列,并在此基础上采用实时荧光定量PCR技术,研究广东紫菜叶状体分别在不同温度(22℃、27℃和31℃)条件下处理0、1/6、1/2、1、6、12、24和36 h后基因的差异表达。结果显示,基因序列长2004 bp,包含一个1866 bp的开放阅读框,可编码621个氨基酸,预测分子量为67.7 kDa,理论等电点为4.87。基因表达水平定量分析表明,温度对基因表达水平有显著影响,基因在不同温度的表达水平变化趋势基本一致,均呈现先上调后下降的趋势,且均于1 h表达量到达最高水平,其中,在31℃ 1 h表达量最高,为未经高温处理组的11倍,说明基因在应答高温胁迫中发挥着重要的作用。
广东紫菜;高温胁迫;;cDNA末端快速扩增技术(RACE);qRT-PCR
生物有机体受到外界有害因素刺激时,很多基因表达会受到抑制,而热休克基因在刺激下表达增强,产生的蛋白称热休克蛋白或热激蛋白(Hsp)(王宇萍等, 2010)。Hsp在果蝇()中首次发现(Ritossa, 1962)。Tisserers等(1974)从果蝇幼体中分离出6种新的蛋白质,命名为热激蛋白。至今,大量研究证明,主要的热激蛋白都有分子伴侣的功能。而Hsp70是Hsp家族中进化上最保守和研究最多的一类热激蛋白,按表达情况可将Hsp70蛋白分为结构型热激蛋白Hsc70和诱导型热激蛋白Hsp70两大类;按定位情况可将Hsp70蛋白分为定位于细胞质、内质网、线粒体和质体的4个亚家族(Guy, 1998)。Hsp70蛋白的功能十分广泛,具有多种生物学功能,例如,Hsp70是主要分子伴侣蛋白之一(Bukau, 2013; Mayer, 2013),与肿瘤的发生相关,具有调控细胞增殖的功能(Zhang, 2002),参与细胞保护、提高细胞应激耐受性(Mayer, 2005),抗细胞凋亡(Snoeckx, 2001)等。目前,对紫菜属海藻基因的研究工作主要集中在栽培种类坛紫菜() (赖晓娟等, 2014)和条斑紫菜()(周向红等, 2011)以及非传统栽培种长紫菜()、皱紫菜() (郑红妍, 2017)和列紫菜() (San, 2015),为深入研究紫菜基因的功能奠定了基础,而对广东紫菜()基因的研究尚未见相关报道。
广东紫菜属红藻门(Phodophyta)、红藻纲(Rhodophyceae)、红毛菜亚纲(Bangiophycidae)、红毛菜目(Bangiales)、红毛菜科(Bangiaceae)、紫菜属(),主要分布于广东等沿岸海区(郑宝福等, 2009; Tseng, 1978)。在自然环境中,影响紫菜生长的环境因素很多,如高温、盐胁迫的、干出失水等(李晓蕾等, 2017)。其中,温度是影响紫菜生长的最重要的环境因子,直接影响紫菜的生长状态以及品质(李兵等, 2013)。广东紫菜有一定的高温适应性(王永川等, 1978、1982),而大量证据表明,Hsp70蛋白家族在藻类适应环境的过程中起重要的作用,例如,坛紫菜在29℃高温胁迫3 h后,5条基因的表达水平都显著升高;在极度干燥的条件下,坛紫菜基因表达水平显著上升,表现出适应高温胁迫和干燥胁迫的作用(Ji, 2015)。Hsp70蛋白家族与广东紫菜的高温适应性也直接相关,因此,研究广东紫菜()基因具有重要意义。本研究开展基因的全长克隆,并在此基础上,研究分析其在不同温度胁迫过程中的差异表达,以期从基因表达水平初步揭示广东紫菜对高温胁迫的响应特点,为广东紫菜的栽培生产提供科学依据。
1 材料与方法
1.1 实验材料预培养与胁迫处理
广东紫菜于2016年11月采集于广东省汕头市南澳县深澳湾海区(23°28ʹ52ʺN, 117°06ʹ35ʺE)的人工栽培网帘,快速运回实验室,挑选健康、长度一致(约为10~15 cm)的藻体进行灭菌海水清洗处理,在温度20℃和光照强度约90 μmol photons/(m2·s)的条件下用砂滤后抽滤的自然海水(盐度30)暂养2 d。
取1组广东紫菜用滤纸吸干,液氮迅速预冷,保存至–80℃冰箱,用于基因的全长克隆。另取一组广东紫菜在智能光照培养箱内进行高温胁迫实验,用于基因表达水平的实时荧光定量PCR分析。参照南澳岛海区广东紫菜自然生长的特性,以22℃为对照组,海水盐度为30,光照强度为90 μmol photons/(m2·s),设置2个高温组:27℃和31℃,在智能光照培养箱中进行高温胁迫处理0、1/6、1/2、1、6、12、24和36 h后分别取样,液氮迅速保存后至–80℃冰箱,每个处理设置3个平行。
1.2 实验方法
1.2.1 引物及序列 同源扩增、RACE扩增、阳性克隆筛选以及荧光定量PCR分析所采用的引物用Primer Premier 5软件设计,由北京六合华大基因科技有限公司合成,引物序列见表1。200 μl UPM:Long UPM (10 μmol/L)8 μl,Short UPM (10 μmol/L)40 μl,ddH2O 152 μl。
1.2.2 广东紫菜总RNA的提取及cDNA第一链的合成 用于全长克隆的总RNA提取按照RNAiso Plus Total RNA(TaKaRa)提取试剂说明书(Raha, 1990)进行操作,提取的RNA经琼脂糖凝胶电泳检查完整性,并利用NanoDrop2000超微量分光光度计测定RNA浓度及纯度,判断核酸和蛋白质的污染情况。选取质量良好的RNA按照PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit(TaKaRa)和SMARTer RACE 5ʹ/3ʹ cDNA Kit Components(TaKaRa)的操作说明书(Tian, 2013; Tang, 2013; Freeman, 2013)进行反转录,分别得到cDNA、5ʹRACE cDNA及3ʹRACE cDNA,保存至-20℃冰箱,分别用于基因中间片段的克隆以及5ʹRACE和3ʹRACE扩增。
表1 实验中引物的名称和序列

Tab.1 Name and sequence of primers used in the experiment
用于荧光定量检测的总RNA提取按照RNAfast200-总RNA极速抽提试剂盒(上海飞捷生物技术有限公司)的说明书(武荣等, 2011)进行操作,利用NanoDrop2000超微量分光光度计测定RNA浓度及260 nm/280 nm值,选取质量良好的RNA根据PrimeScript®RT Reagent Kit with gDNA Eraser (Perfect Real Time)(TaKaRa)的说明书(Zhang, 2013)进行反转录(以RNA 900 ng为基准),所得的cDNA用UBC引物进行检验,保存至–20℃冰箱备用。
1.2.3基因的全长克隆 从NCBI中搜索条斑紫菜(GenBank No.: DQ497595.1),坛紫菜(GenBank No.: DQ480726)的基因的核酸序列,进行序列比对并找出保守区域,设计引物PF和PR (表1)。以cDNA为模板进行PCR扩增,扩增产物经1%的琼脂糖凝胶电泳检测,并用凝胶回收试剂盒回收,利用T-A克隆方法克隆到pMD19-T载体上,转化至DH5α感受态细胞中,用含Amp的LA固体培养基进行37℃过夜培养,挑取单菌落于1 ml LA培养液中37℃ 200 r/min震荡培养6 h,进行菌液PCR检测,挑取阳性克隆。将含有目的片段的阳性菌落交由北京六合华大基因科技有限公司进行测序。测序结果与NCBI上其他物种的基因进行比对和同源性分析,确定为基因中间片段。
根据克隆得到的基因片段序列,分别设计5ʹRACE和3ʹRACE的特异性扩增引物(表1)。分别以5ʹcDNA和3ʹcDNA模板进行5ʹRACE和3ʹRACE扩增,将RACE扩增的目的片段切胶回收、连接、转化、阳性克隆筛选、送样测序。
根据基因测序获得的基因5ʹ和3ʹ及中间片段序列,利用DNAman V6.0软件进行拼接,获得基因全长序列。
1.2.4基因的生物信息学分析 采用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析获得的基因的开放阅读框和所编码氨基酸序列;利用在线工具(http://web.expasy.org/ compute_pi/)预测该基因氨基酸序列的分子量和等电点;用在线软件(http://smart.embl-heidelberg.de/)预测该基因氨基酸序列功能结构域;利用InterProScan (http://www.ebi. ac.uk/interpro/)和PROSITE (https://prosite.expasy.org/)在线软件分析该基因编码的氨基酸序列保守位点及特征序列;利用PrediSi (http://www.Predisi.de)预测所得蛋白是否含有信号肽;利用NCBI网站上BLAST序列分析工具(http://www.ncbi.nlm.nih.gov)搜索用于同源性比对分析与系统进化树构建的氨基酸序列;采用DNAman 6.0进行氨基酸多重序列比对;通过MEGA 5.1软件,构建NJ系统进化树。
1.2.5 高温胁迫下基因的表达分析 根据基因全长序列设计qRT-PCR正反向引物QF和QR,并以作为内参基因(表1)。以广东紫菜叶状体在不同高温胁迫条件下各时间的cDNA为模板,在Roche light Cycler 480Ⅱ仪器进行实时荧光定量PCR(qRT-PCR)。20 μl反应体系:Tip Green 10 μl,Q1F 0.8 μl,Q1R 0.8 μl,cDNA 2 μl,ddH2O 6.4 μl。每次反应均设阴性对照和无模板对照,每个反应设 3个重复。扩增程序:95℃预变性30 s;95℃ 5 s,60℃ 20 s,40个循环;循环结束后从60℃缓慢升温至95℃;40℃冷却30 s。所得实验数据采用相对CT法(2–DD)进行基因mRNA的表达量计算。
1.3 数据处理
应用Excel和SPSS 13.0软件对实验数据进行处理与统计分析,并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异,<0.05表示有显著性差异。
2 结果
2.1 PgHsp70基因的克隆及序列分析
以广东紫菜cDNA为模板,用引物PF/PR进行普通PCR扩增,1%的琼脂糖凝胶电泳扩增产物,观察到1条扩增条带,约为1100 bp(图1a),将其切胶回收,克隆并送去测序,得到一段1061 bp的基因序列。进行BLAST比对发现,其与(GenBank No.: DQ480726)的基因核酸序列同源性达99%,与(GenBank No.: DQ497595.1)的基因核酸序列同源性达到90%,进而推断该片段为的基因片段。
广东紫菜通过RACE技术扩增并测序,分别获得长为337 bp的5ʹ序列和606 bp的3ʹ序列(图1b、c)。将2条序列与之前克隆得到的基因部分序列进行拼接,获得长为2004 bp的基因全长序列。经过Blast比对,确认其为广东紫菜的基因,命名为。通过ORF Finder软件分析发现,广东紫菜基因开放阅读框为1866 bp,以ATG为起始密码子,TAA为终止子,可编码621个氨基酸,预测分子量约为67.7 kDa,理论等电点为4.87。5ʹ非编码区(5ʹ TR)7 bp,3ʹ非编码区(3ʹ UTR)131 bp(图2)。利用InterProScan软件分析克隆得到的基因氨基酸序列,378~534位点是多肽结合域(Peptide- binding domain),527~595位点是C末端结构域(C-terminal domain)(图2)。使用Prosite在线软件分析发现,该基因编码的氨基酸序列有家族的3条特征性序列:IDLGTTNS,VFDLGGGTFDVSVL,VVLVGGSTRIPAIQQ(图2)。PrediSi预测软件并未在该基因中发现信号肽序列。

图1 PgHsp70基因克隆产物凝胶电泳
a:基因的中间片段扩增产物; b:基因的5ʹRACE扩增产物(箭头); c:基因的3ʹRACE扩增产物(箭头). M: DNA marker DL 2000; C: 对照
a: Core fragment amplification product ofgenes;b: 5ʹRACE amplification products of(arrow); c: 3ʹRACE amplification products of(arrow);M: DNA marker DL 2000; C: Control
2.2 PgHsp70基因多序列比对及系统进化树分析
广东紫菜基因编码的氨基酸序列经BLAST比对发现,与其他物种的基因有较高同源性。利用DNAman 6.0进行氨基酸多重序列比对分析结果显示,不同物种间的序列非常保守,其中,氨基酸序列与坛紫菜氨基酸序列相似性最高(99%),其次分别与条斑紫菜氨基酸序列相似性达98%,与的氨基酸序列相似性达97%,与脐形紫菜() Hsp70氨基酸序列相似性达94%,与细基江蓠繁枝变种()Hsp70氨基酸序列相似性达78%(图3)。

图2 广东紫菜Hsp70基因的核苷酸序列和氨基酸序列
蓝色方框区域表示Hsp70蛋白家族的序列特征; 黄色方框区域表示C末端结构域,红色“—”表示多肽结合域; 方框所示为起始密码子(ATG)和终止密码子(TAA)
Blue boxes represent sequences of HSP70 protein family, Yellow boxes represent C-terminal domain, Polypeptide binding domain is underlined with red “—”, Start codon(ATG) and termination codon(TAA) are shown in the box

图3 Hsp70的氨基酸序列多重序列比对
黑色区域:相似性100%;粉红区域:相似性≥75%;蓝色区域:≥50%
Black area: Similarity is 100%; Pink area: Similarity is greater than or equal to 75%; Blue area: Similarity is greater than or equal to 50%
为了确定的系统进化关系,通过MEGA 5.1软件,采用Neighbor-Joining法构建了及选取的17条代表性的氨基酸序列系统进化树。进化树结果显示(图4),红藻和蓝藻亲缘关系较近且聚类于叶绿体定位的Hsp70蛋白,绿藻、褐藻和陆生植物则聚类于细胞质定位的Hsp70蛋白。其中,PgHsp70蛋白聚类于叶绿体定位的Hsp70蛋白,与坛紫菜亲缘关系最近,与同属红藻门的其他物种亲缘关系较近,与蓝藻亲缘关系次之,而其他藻类及陆生植物则明显地被区分开来。
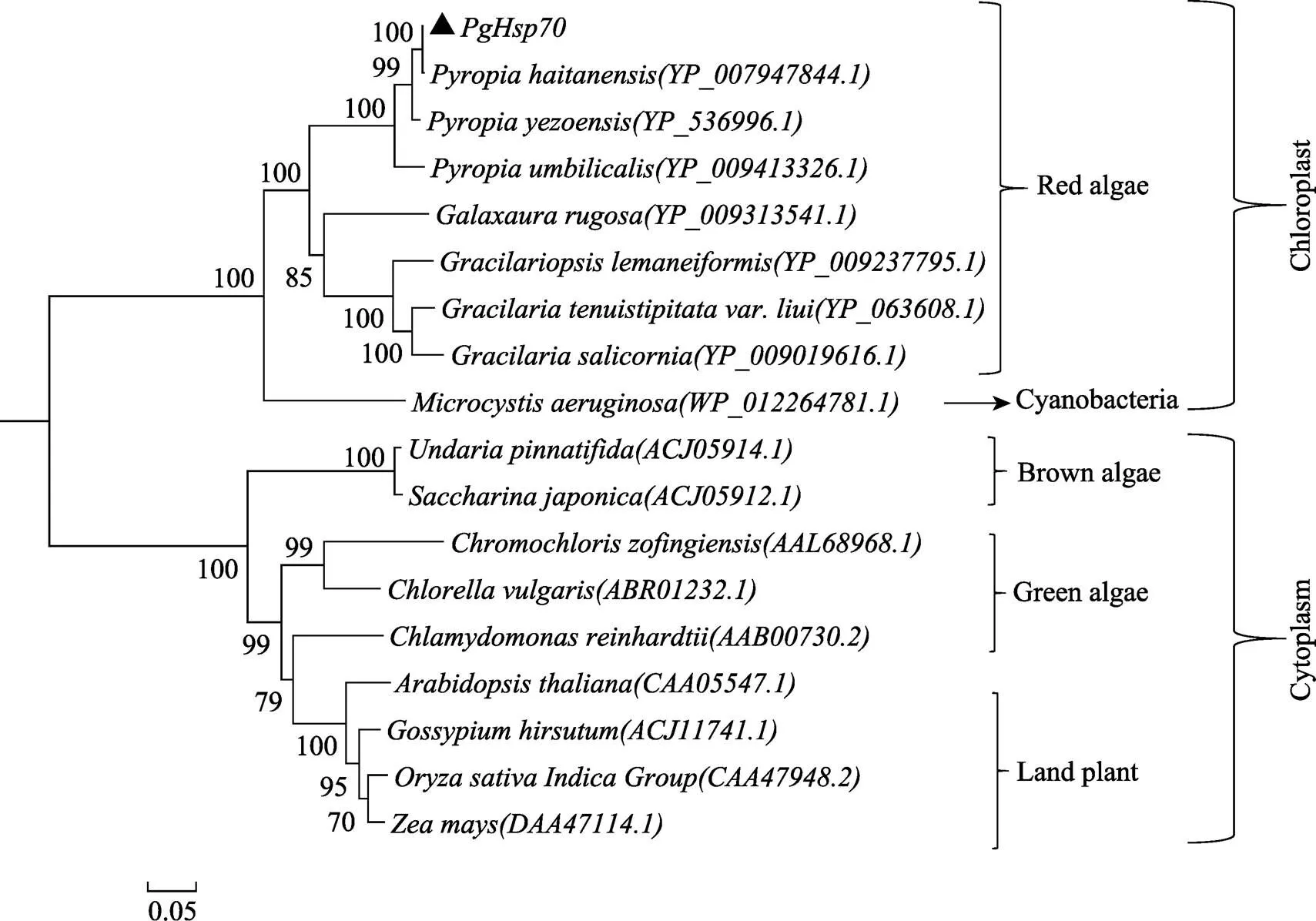
图4 采用NJ法构建的基于PgHsp70基因所编码氨基酸序列的系统进化树
2.3 PgHsp70基因在高温胁迫下的表达
基因在特定条件下表达水平的变化有助于了解相关基因的功能。为研究广东紫菜对高温胁迫的功能响应,本研究采用荧光定量PCR技术检测基因在不同温度(22℃、27℃和31℃)处理下,不同时间水平(0、1/6、1/2、1、6、12、24、36 h)基因相对表达水平变化。基因在高温胁迫过程中相对表达变化趋势见图5,内参为。检测结果显示,温度对基因表达水平有显著影响,基因表达量在不同温度胁迫下随时间变化趋势基本一致,均呈现1 h之前先上调、1 h之后下调的趋势,且均于1 h表达量到达最高水平,分别为未经高温处理组的3.9倍、7.1倍和11.1倍。在温度胁迫0~1 h时,基因表达量显著升高(<0.05),31℃温度组基因表达水平一直高于其他温度组,27℃温度组基因表达水平在1/6~1/2 h间低于22℃,在1 h时高于22℃;随着胁迫时间的增加(1 h之后),不同温度基因表达量均显著下调(<0.05),但在高温胁迫6~36 h之间,基因表达水平无显著性差异(>0.05)。因此,基因在应答高温胁迫中发挥着重要的作用,短时间内迅速大量表达以适应高温环境,在一定胁迫时间内温度越高,反应越灵敏,但应对高温胁迫的能力有限。
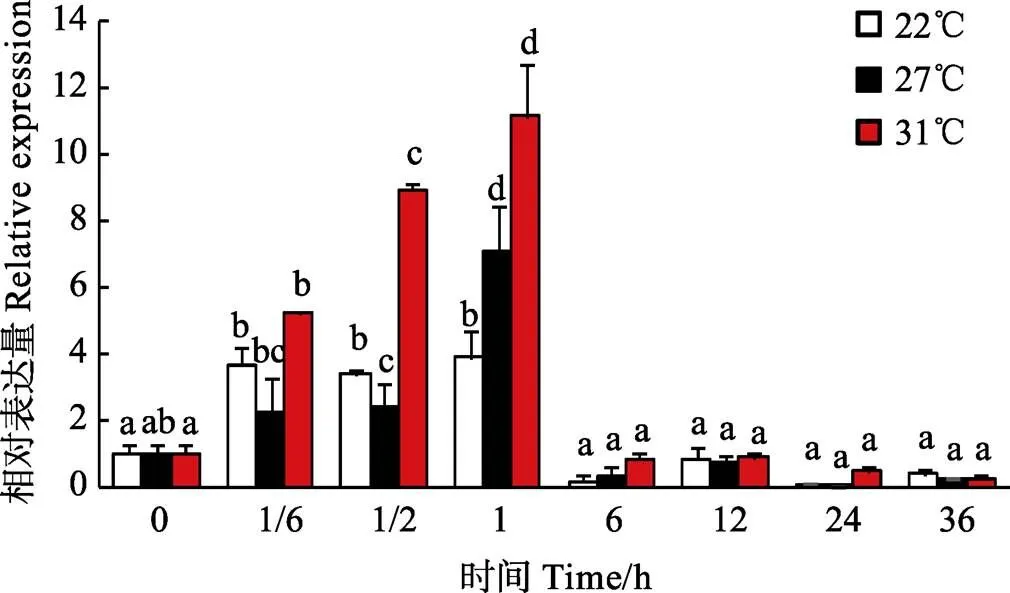
图5 广东紫菜Hsp70基因在高温胁迫过程中相对表达变化
3 讨论
热激蛋白是细胞受到不良环境(如干旱、洪涝、低温、高温、盐渍等)刺激时被激活并表达增强的一类蛋白(待真真等, 2014; 陈玉婷等, 2015)。其中,Hsp70是研究最多、在生物体内分布最广、进化上最保守及生物学功能多样的一类热激蛋白(齐妍等, 2013)。通常可分为2个区域:含有ATP酶结构域的N-端高度保守区和含有多肽结合结构的C-端区域,2个区域之间由绞链相连(Genevaux, 2007)。编码的氨基酸序列则一般有3条特征性序列:IDLGTTNS,VFDLGGGTFDVSVL,VVLVGGSTRIPAIQQ(郑红妍, 2017)。作者从广东紫菜叶状体中成功克隆了2004 bp的基因,ORF长度为1866 bp,可编码621个氨基酸,预测分子量为67.7 kDa,理论等电点为4.87(图2)。克隆获得的推导出来的氨基酸序列与其他大多数紫菜相似,378~534位点是多肽结合域,527~595位点是C末端结构域,也含有3条特征性序列(图2)。该序列与其他物种的基因氨基酸序列对比显示(图3),与同为南方的坛紫菜氨基酸序列相似性更是高达99%,表明其高度的保守性,其次才与北方条斑紫菜Hsp70氨基酸序列相似性达98%,表明地域位置更近,同源性可能更高。而与不同属的细基江蓠繁枝变种Hsp70氨基酸序列相似性只有78%。与陆生植物相似性则更低,在系统进化树中PgHsp70明显地与陆生植物区分开来(图4),说明亲缘关系越相近的物种和生境越接近的物种同源性可能越高,反之则同源性越低,可作为分子进化的一种依据,这与刘伟等(2012)对坛紫菜基因的研究结果基本一致。系统进化树结果还表明(图4),Hsp70蛋白按亚细胞定位不同分别聚类于一支,PgHsp70蛋白与红藻、蓝藻亲缘关系较近聚类于叶绿体定位的Hsp70蛋白,说明PgHsp70蛋白定位于叶绿体中。
温度是影响藻类生长分布的重要因素,李恒等(2013)研究表明,温度的变化对大型海藻的生长具有显著影响。对紫菜来说,高温是制约粤东沿海紫菜养殖生产发展的主要因素,近年来在汕头地区更是多次发生高温烂菜烂苗事件,严重威胁当地紫菜栽培业的发展。已有大量文献报道和证据表明,在逆境胁迫响应中发挥着重要的调控作用,具有提高机体抗热性能力,例如,顾颖慧(2011)研究发现,耐高温品种981龙须菜()在热激后,的表达量明显高于野生型龙须菜,说明是981龙须菜较野生型龙须菜耐高温的重要因素。韩俊英等(2011)对脊尾白虾()的研究证明,温度可以引起脊尾白虾的高表达,说明在动植物中均扮演抗逆境胁迫的角色。为探究在广东紫菜高温适应性的作用,作者从广东紫菜基因着手,分别在不同温度下对广东紫菜叶状体进行高温胁迫实验,分析了不同温度胁迫过程中基因表达变化趋势。图5的研究结果显示,基因表达量在不同温度胁迫下均呈现1 h之前先上调、1 h之后下调的趋势,且均于1 h表达量到达最高水平。在温度胁迫0~1 h时,基因表达量显著升高(<0.05),31℃温度组基因表达水平一直高于其他温度组,27℃温度组基因表达水平在1/6~1/2 h间低于22℃,在1 h时高于22℃;胁迫1 h之后,不同温度基因表达量均显著下调(<0.05)。说明对于高温胁迫反应非常迅速,短时间内大量积累表达,温度越高,反应越强烈,随着胁迫时间的推移,表达量下降,该研究结果与现有的多数文献报道情况基本一致(Ji, 2015)。由此,作者认为应答高温胁迫的调节作用机制可能一样。当高温胁迫时,机体受到温度刺激造成某些功能蛋白受到抑制,从而激活基因,并使其表达量快速大量上调以维持功能蛋白稳态,一方面,当大量表达时受到自身的反馈抑制,使其开始下调,另一方面,胁迫持续进行使机体长时间处于亚健康状态时,超越了维持机体功能蛋白稳态的限度,各种生理功能开始受到影响,表达量出现下调。当然,一个机体的响应调控是复杂多变的,远远比作者所述的复杂,但无论如何,对维持生物体抗胁迫动态平衡的作用十分重要,其开发利用对高温地区紫菜栽培生产乃至各个领域都有不容忽视的现实意义。
Bukau B, Horwich AL. The Hsp70 and Hsp60 chaperone machines. Cell, 2013, 92(3): 351–366
Chen YT, Xu Y, Ji DH,. Cloning and expression analysis of two small heat shock protein () genes from. Journal of Fisheries of China, 2015, 39(2): 182–192 [陈玉婷, 徐燕, 纪德华, 等. 坛紫菜两种小分子热激蛋白()基因的克隆及表达特征分析. 水产学报, 2015, 39(2): 182–192]
Dai ZZ, Li B, Xu Y,. Cloning and expression pattern analysis of two heat shock protein () genes from. Journal of Fisheries of China, 2014, 38(3): 340–349 [待真真, 李兵, 徐燕, 等. 坛紫菜两种基因的克隆及表达特征分析. 水产学报, 2014, 38(3): 340–349]
Freeman LA. Cloning full-length transcripts and transcript variants using 5ʹ and 3ʹ RACE lipoproteins and cardiovascular disease. Humana Press, 2013: 3–17
Genevaux P, Georgopoulos C, Kelley WL. TheHsp70 chaperone machines of: A paradigm for the repartition of chaperone functions. Molecular Microbiology, 2007, 66(4): 840–857
Gu YH. Molecular cloning and expression analysis of heat-shock-protein 70 () genes fromunder heat shock. Master´s Thesis of Ocean University of China, 2011, 2–4 [顾颖慧. 龙须菜热激蛋白70()基因克隆及热激下的表达模式分析. 中国海洋大学硕士研究生学位论文, 2011, 2–4]
Guy CL, Li QB. The organization and evolution of the spinach stress 70 molecular chaperone gene family. Plant Cell, 1998, 10(4): 539–556
Han JY, Li J, Li JT,. Cloning and expression of heat shock protein 70 () of. Journal of Fisheries of China, 2011, 35(8): 1130–1138 [韩俊英, 李健, 李吉涛, 等. 脊尾白虾热休克蛋白基因的克隆及其表达分析. 水产学报, 2011, 35(8): 1130–1138]
Ji DH, Li B, Xu Y,. Cloning and quantitative analysis of five heat shock protein 70 genes from. Journal of Applied Phycology, 2015, 27(1): 499–509
Lai XJ, Yan XJ, Yang R,. Digital gene expression profiling analysis of(Rhodophyta) under high temperature stress. Acta Oceanologica Sinica, 2014, 36(6): 104–11 [赖晓娟, 严小军, 杨锐, 等. 高温胁迫下坛紫菜的数字基因表达谱研究. 海洋学报, 2014, 36(6): 104–111]
Li B, Xu Y, Ji DH,. Effects of high temperature and non-aeration stress on the quality of. Progress in Fishery Sciences, 2013, 34(3): 104–110 [李兵, 徐燕, 纪德华, 等. 高温静水胁迫培养对坛紫菜品质的影响. 渔业科学进展, 2013, 34(3): 104–110]
Li H, Li MZ, Cao J,. Effects of temperature on nitrogen uptake and growth in several species of macroalgae. Progress in Fishery Sciences, 2013, 34(1): 159–165 [李恒, 李美珍, 曹婧, 等. 温度对几种大型海藻硝氮吸收及其生长的影响. 渔业科学进展, 2013, 34(1): 159–165]
Li XL, Wang WJ, Liang ZR,. Antioxidant physiological characteristics of wildunder desiccation stress. Progress in Fishery Sciences, 2017, 38(5): 156–163 [李晓蕾, 汪文俊, 梁洲瑞, 等. 野生条斑紫菜()叶状体对干出胁迫的抗氧化生理响应特征. 渔业科学进展, 2017, 38(5): 156–163]
Liu W, Yang R, Xu LN,. Cloning and expression offor. Journal of Ningbo University (Natural Science & Engineering), 2012, 25(2): 17–25 [刘伟, 杨锐, 徐丽宁, 等. 坛紫菜基因克隆与表达. 宁波大学学报(理工版), 2012, 25(2): 17–25]
Mayer MP, Bukau B. Hsp70 chaperones: Cellular functions and molecular mechanism. Cellular and Molecular Life Sciences, 2005, 62(6): 670–684
Mayer MP. Hsp70 chaperone dynamics and molecular mechanism. Trends in Biochemical Sciences, 2013, 38(10): 507–514
Qi Y, Xu ZS, Li PS,. Research progress on molecular mechanism and application of HSP70 in plants. Journal of Plant Genetic Resources, 2013, 14(3): 507–511 [齐妍, 徐兆师, 李盼松, 等. 植物热激蛋白70的分子作用机理及其利用研究进展. 植物遗传资源学报, 2013, 14(3): 507–511]
Raha S, Merante F, Proteau G,. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride. Gene Analysis Techniques, 1990, 7(7): 173–177
Ritossa F. A new puffing pattern induced by temperature shock and DNP in. Experientia, 1962, 18(12): 571–573
San C, Sunhee K, Sungoh I,. The heat shock protein 70a fromincreases heat tolerance in Chlamydomonas. Plant Omics, 2015, 8(4): 327–334
Snoeckx LH, Cornelussen RN, van Nieuwenhoven FA,. Heat shock proteins and cardiovascular pathophysiology. Physiological Reviews, 2001, 81(4): 1461–1497
Tang Q, Li S, Zhang H,. Correlation of the cyclin A expression level with porcine circovirus type 2 propagation efficiency. Archives of Virology, 2013, 158(12): 2553–2560
Tian L, Yang J, Hou W,. Molecular cloning and characterization of a P-glycoprotein from the diamondback moth,(Lepidoptera: Plutellidae). International Journal of Molecular Sciences, 2013, 14(11): 22891–22905
Tisseres A, Mitchell AK. Some new proteins induced by temperature shock in. Journal of Molecular Biology, 1974, 84: 389–398
Tseng CK, Chang TJ. On two newfrom China. Oceanologia et Limnologia Sinica, 1978, 9(1): 76–83
Wang YC, Li G, Pan GY,. Comparative study on the temperature adaptability ofand. Journal of Fisheries of China, 1982, 6(4): 307–312 [王永川, 李刚, 潘国瑛, 等. 广东紫菜和坛紫菜温度适应性的比较研究. 水产学报, 1982, 6(4): 307–312]
Wang YC, Pan GY, Jiang FK,. On artificial cultivation of. Oceanologia et Limnologia Sinica, 1978, 9(1): 85–88 [王永川, 潘国瑛, 蒋福康, 等. 广东紫菜的人工养殖试验. 海洋与湖沼, 1978, 9(1): 85–88]
Wang YP, Jiang JD. The structure and function of heat shock protein 70. Chinese Journal of Cell Biology, 2010, 32(2): 305–313 [王宇萍, 蒋建东. 热休克蛋白70的结构和功能. 中国细胞生物学学报, 2010, 32(2): 305–313]
Wu R, Zhang JT, Zhao X,. Comparative the effect which Trizol method and RNA Fast1000 kit method has been used to extract the total RNA from the peripheral blood. National Medical Frontiers of China, 2011, 6(5): 60–61 [武荣, 张俊涛, 赵霞, 等. Trizol与RNA Fast1000试剂盒提取外周抗凝血总RNA的方法比较. 中国医疗前沿, 2011, 6(5): 60–61]
Zhang J, Wei XL, Chen LP,. Sequence analysis and expression differentiation of chemokine receptor CXCR4b among three populations of. Developmental and Comparative Immunology, 2013, 40(2): 195–201
Zhang S, Wei J, Li J,. Immunohistochemical study of heat shock protein 70 in mouse endometrium during early pregnancy. Chinese Journal of Anatomy, 2002, 25: 21–24
Zheng BF, Li J. Flora Algarum Marinarum Sinicarum (Tomus ⅡRhodophyta, No.1 Porphyridiales Erythropeltidales Goniotrichales Bandiales). Beijing: Science Press, 2009, 65–105 [郑宝福, 李钧. 中国海藻志(第二卷红藻门, 第1册紫球藻目, 红盾藻目, 角毛藻目, 红毛菜目). 北京: 科学出版社, 2009, 65–105]
Zheng HY. The evolution of heat shock protein in algae and study on thegene from three species ofby cloning and expression. Master´s Thesis of Shantou University, 2017, 60–63 [郑红妍. 藻类热激蛋白系统进化研究及三种紫菜基因的克隆及表达. 汕头大学硕士研究生学位论文, 2017, 60–63]
Zhou XH, Li XS, Wang P,. Expression profiles ofgene in gametophytic blade of laverueda by high temperature stress. Fisheries Science, 2011, 30(4): 233–237 [周向红, 李信书, 王萍, 等. 高温胁迫下条斑紫菜叶状体基因的表达谱分析. 水产科学, 2011, 30(4): 233–237]
The cDNA Cloning and Expression Analysis of theGene from
ZENG Jun, CHEN Weizhou①, CHEN Zepan, LIU Haoran
(Guangdong Provincial Key Laboratory of Marine Biotechnology, Shantou University, Shantou 515063)
In order to explore the molecular mechanisms of thegene in, we have stimulated it with high temperature stresses. The aim was to provide technical references for the cultivation of. The full-length ofwas obtained by rapid amplification of cDNA ends technical (RACE). On this basis, the expression ofwith the different temperature (22℃, 27℃, and 31℃) stresses after 0, 1/6, 1/2, 1, 6, 12, 24, and 36 h were detected using quantitative real-time PCR. The results showed that the full-length cDNA ofwas 2004 bp, including an open reading frame (ORF) of 1866 bp, encoding a polypeptide of 621 amino acids. The molecular mass of the deduced amino acid sequence was 67.7 kDa, with an estimated pI of 4.87. The expression of the, as measured by qRT-PCR, can be significantly induced by high-temperature stress. The three kinds of expression profiles forwere similar at different times, and all of them significantly increased first and then reached their maximum levels after one hour, and then dramatically decreased. Compared to the temperature stress of 22℃and 27℃, the expression of thewith the 31℃ temperature stress reached the highest level after being challenged for 1 h and was 11-fold higher than the normal. These results suggested thatplays an essential role in response to high-temperature stresses.
; High temperature stress;; Rapid amplification of cDNA ends (RACE); Quantitative real-time PCR
CHEN Weizhou, E-mail: wzchen@stu.edu.cn
S917.3
A
2095-9869(2019)04-0131-09
10.19663/j.issn2095-9869.20180510001
* 现代农业产业技术体系专项(CARS-50)资助 [This work was supported by China Agriculture Research System (CARS-50)]. 曾 俊,E-mail: 1207615382@qq.com
陈伟洲,教授,E-mail: wzchen@stu.edu.cn
2018-05-10,
2018-05-30
曾俊, 陈伟洲, 陈泽攀, 刘浩然. 广东紫菜基因cDNA克隆与表达分析. 渔业科学进展, 2019, 40(4): 131–139
Zeng J, Chen WZ, Chen ZP, Liu HR. The cDNA cloning and expression analysis of thegene from. Progress in Fishery Sciences, 2019, 40(4): 131–139
(编辑 冯小花)
