光强对极北海带幼苗生长和生化特性的影响*
2019-08-05梁洲瑞刘福利杜欣欣袁艳敏梁启迪汪文俊孙修涛王飞久
梁洲瑞 刘福利 杜欣欣 袁艳敏 梁启迪 汪文俊 孙修涛 王飞久
光强对极北海带幼苗生长和生化特性的影响*
梁洲瑞1,2刘福利1,2①杜欣欣3袁艳敏4梁启迪1汪文俊1,2孙修涛1,2王飞久1,2
(1. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 青岛农业大学海洋科学与工程学院 青岛 266109;4. 上海海洋大学水产与生命学院 上海 201306)
通过探讨极北海带()幼苗在不同光强下的相对生长速率(RGR)及生化指标的变化规律,以期获得适宜极北海带幼苗生长的光照范围,并揭示其对光照胁迫的生化响应机制。结果显示,在40~80 μmol photons/(m2·s)光强下,极北海带幼苗的RGR较高,表明此光强范围对其生长较有利,而RGR与丙二醛(MDA)含量呈显著负相关关系,表明细胞膜脂的过氧化作用可能是导致极北海带幼苗RGR降低的原因之一。极北海带幼苗中超氧阴离子(SA)含量与MDA含量呈极显著正相关关系,而超氧化物歧化酶(SOD)及过氧化氢酶(CAT)的比活力与SA含量及MDA含量均呈负相关关系(其中,CAT比活力与SA含量的相关性达到显著水平),且过氧化物酶(POD)与SOD的比活力呈极显著正相关关系,表明SOD、CAT及POD对于极北海带幼苗中活性氧的清除均发挥着重要的作用,且SOD与POD有明显的协同作用。高光和弱光逆境均不利于极北海带幼苗中可溶性蛋白的积累,且均造成藻体中MDA的积累,表明在光照胁迫下幼苗的总代谢水平降低,而活性氧水平升高。在高光下,幼苗可通过增加类胡萝卜素含量及显著提高SOD及POD的比活力来降低藻体内活性氧水平,从而减轻光氧化伤害。在弱光下,幼苗可通过增加体内叶绿素a的含量以高效地捕获有限光能,但藻体的抗氧化酶比活力显著下降,从而造成其活性氧代谢发生了严重失衡,进而导致其细胞膜脂过氧化程度的加重。上述结果可为极北海带的人工育苗及海上养殖提供参考。
极北海带;光强;生长;生化组分;抗氧化系统
极北海带()是一种具有重要经济和生态价值的大型经济海藻,广泛分布于大西洋东北海域,包括葡萄牙至巴伦支海的沿岸以及英国、法罗群岛和冰岛的沿岸(Kain, 1967、1971; Schoschina, 1997)。极北海带柄和叶片的褐藻胶含量分别为25%~30%和17%~33%,属于褐藻胶含量较高的种类(Qin, 2008)。与其他褐藻相比,极北海带有较低的甘露糖醛酸和古罗糖醛酸比值(M/G),从而表现出较高的凝胶强度(Phillips, 2009; Qin, 2008; 曲艳艳等, 2016)。因此,极北海带在法国、挪威和英国等国家常被用作提取褐藻胶的原料(Bixler, 2011)。另外,因矿物元素和维生素等营养成分丰富,极北海带也用作动物饲料添加剂及海藻肥(范晓, 1991; Schiener, 2015)。极北海带的生态价值体现在其藻体较大(叶+柄的长度可达2~5 m) (Jupp, 1974; Kain, 1962、1971),多年生(平均寿命一般为8~15年) (Kelly, 2005; Sjøtun, 1993),是形成“海藻森林”的优势种,为海洋生物提供索饵场、产卵场或栖息地,对维护海洋生物多样性发挥重要作用(Smale, 2013)。另外,极北海带藻场具有重要的碳汇功能,是地球上具有较高生产力的植被系统之一(Pedersen, 2012)。综上可知,极北海带在海洋藻场建设及人工养殖方面具有重要的开发前景。
极北海带在幼苗期对光照的适应能力是决定其存活的关键因素之一(Kain, 1965),也是其应用于藻场建设及人工养殖中需考虑的首要问题之一。大型海藻对光照的适应性一般可从生长、生理、生化等方面的指标进行综合评价。对于极北海带的游孢子、配子体、幼苗、成藻等不同生长发育阶段的光合生理方面,已有学者做了一些初步探索(Drew, 1976; Kain, 1965; Kremer, 1984; Lüning, 1971; Willenbrink, 1975),他们主要测定了极北海带的光合速率、光饱和点、光补偿点、固碳强度等参数。许多研究表明,大型海藻的藻体生化组分(如色素、可溶性蛋白、丙二醛、抗氧化酶等)的含量或活性,会发生明显的变化以适应不同的光环境条件(姜宏波等, 2009; 卢晓等, 2013; 芦薇薇等, 2016),光照是造成海藻体内生化组分呈季节性变化的主要因素之一(Lapointe, 1984),而极北海带对不同光照强度的生化响应还没有相关的文献报道。本研究以基于配子体克隆系培育的极北海带幼苗为研究对象,探讨其生长及相关生化指标对不同光强的反应规律,以期探明适宜其生长的光照范围,并揭示其对光照胁迫的生化响应机制,进而为极北海带苗种规模化生产、人工增养殖及海藻场构建提供理论依据。
1 材料与方法
1.1 实验材料
本研究所用极北海带幼苗是通过配子体克隆育苗技术获得,极北海带配子体采集于法国布列塔尼半岛海区。由配子体培育成幼苗过程中的培养条件:温度为11℃~13℃,光合有效辐射(Photosynthetically active radiation, PAR)为40~50 μmol photons/(m2·s),光周期为12L︰12D,用灭菌天然海水作为培养液,并添加营养盐(PO43–-P:0.4 mg/L;NO3–-N:4 mg/L)。用到的主要仪器:智能光照培养箱(宁波江南仪器厂),352型酶标仪(Labsystems Multiskan MS公司, 芬兰),AC8洗板机(Thermo Labsystems公司, 芬兰),电热恒温培养箱(武汉一恒苏净科学仪器有限公司)。
1.2 实验方法
以下各个处理组均添加相同浓度的氮/磷营养盐(PO43–-P:0.4 mg/L;NO3–-N:4 mg/L),每个测量实验均至少3个平行。
1.2.1 不同光强下极北海带幼苗的相对生长速率的测定 挑选2~4 cm的极北海带幼苗,置于GXZ智能型光照培养箱,进行相对生长速率的测定实验:在温度为9℃条件下,分别在PAR为20、40、60、80和100 μmol photons/(m2·s)条件下持续培养10 d。实验开始前,挑选藻体完整、无损伤腐烂的极北海带幼苗,各处理组平均鲜重为(1.04±0.05) g,鲜重差异性不显著(>0.05)。每隔2 d换水1次,10 d后称量鲜重,计算相对生长速率(Relative growth rate, RGR),计算公式如下:
RGR=[ln(W/0)/]×100%
式中,0为初始藻的鲜重(g),W为实验结束时藻的鲜重(g),为实验持续的时间(d)。
1.2.2 生化指标的测定 相对生长速率测定结束后,立刻用液氮把不同处理组的极北海带幼苗冷冻并储存在超低温冰箱中,待进行生化指标的测定。本研究测定的指标包括:叶绿素a和类胡萝卜素、可溶性蛋白质(Soluble protein)、超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化物酶(Peroxidase, POD)、过氧化氢酶(Catalase, CAT)、丙二醛(Malondialdehyde, MDA)和超氧阴离子(Superoxide anion, SA)。
参考文献进行叶绿素a (王丽梅等, 2011)和类胡萝卜素含量(Chouhan, 2011)的测定,其他指标的测定均采用酶联免疫吸附分析法(Enzyme-linked immunosorbent assay, ELISA)。酶联免疫分析检测试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行各个指标的测定。SOD、POD和CAT的比活力单位(U/mg prot)以酶活性单位(U)每毫克蛋白表示(李合生, 2000)。
1.3 数据处理
采用SPSS 19.0数据统计软件进行单因素方差分析(One-way ANOVA)、Duncan多重比较及Pearson相关性分析,<0.05为差异显著,<0.01为差异极显著,用Excel软件绘制图形。
2 结果
2.1 不同光强下极北海带幼苗的相对生长速率
方差分析结果表明,光强对极北海带幼苗的相对生长速率(RGR)有显著影响(<0.05)。图1显示,在9℃时,40、60和80 μmol photons/(m2·s)光强组的RGR均较大,三者相比无显著差异(>0.05)。20和100 μmol photons/(m2·s)光强组的RGR均较小,它们与60和80 μmol photons/(m2·s)光强组相比均呈显著性差异(<0.05)。
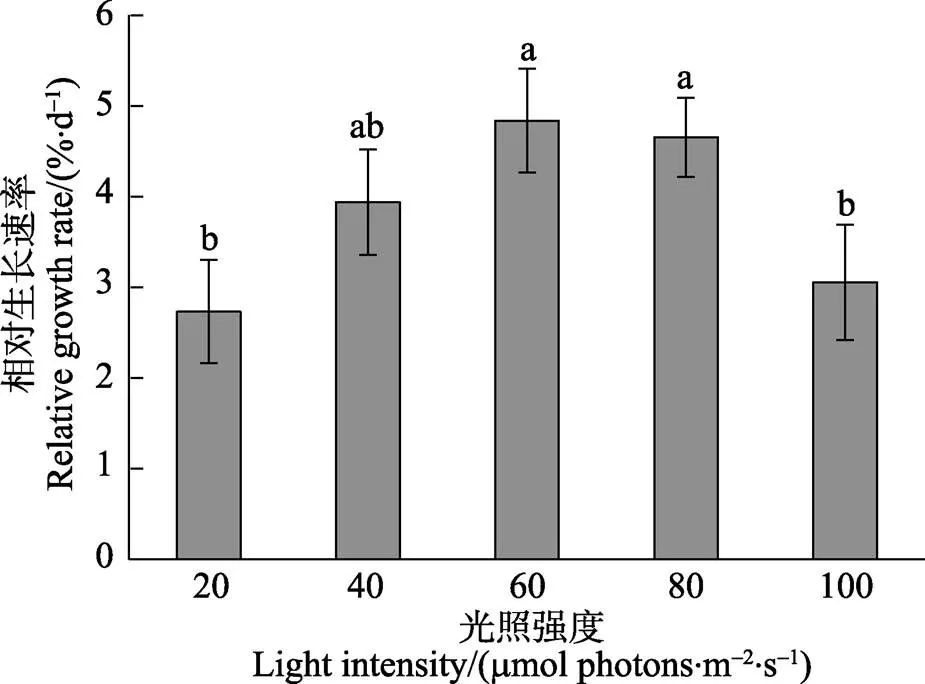
图1 不同光强下处理10 d后极北海带幼苗的相对生长速率(温度为9℃)
不同字母表示差异显著,<0.05,下同
Different letters indicate significant difference,<0.05, the same as below
2.2 不同光强下极北海带幼苗的色素(叶绿素a和类胡萝卜素)含量
方差分析结果表明,光强对极北海带幼苗的叶绿素a和类胡萝卜素含量均有显著影响(<0.05)。图2显示,极北海带幼苗的叶绿素a含量随着光强的升高而逐渐降低。20和40 μmol photons/(m2·s)处理组的幼苗叶绿素a含量均较高,二者无显著差异(>0.05)。光强≥60 μmol photons/(m2·s)的处理组与光强为20 μmol photons/(m2·s)组均差异显著(0.05)。光强≥40 μmol photons/(m2·s)的处理组之间无显著差异(>0.05)。
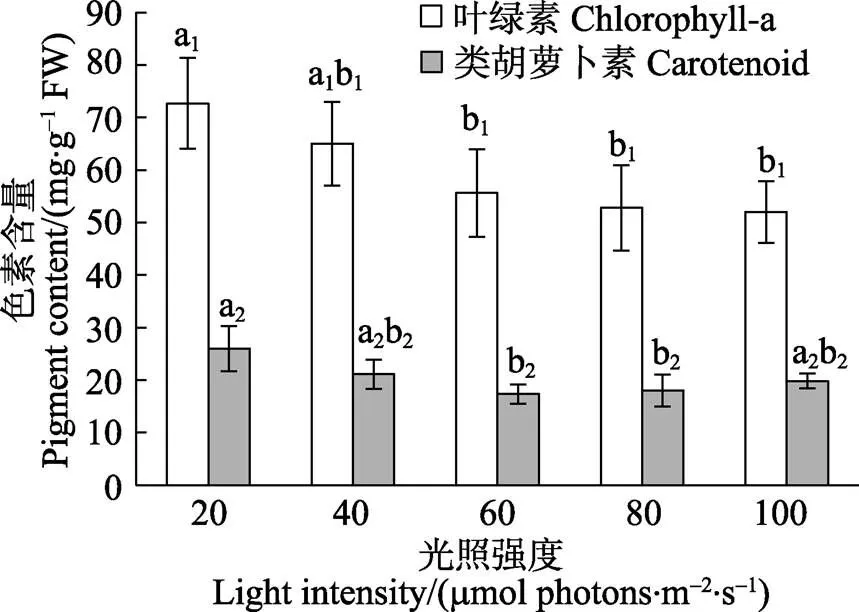
图2 极北海带幼苗在不同光强下的叶绿素a和类胡萝卜素含量
柱状图上的字母下标为相同数字的作为同一组进行多重比较,同一组的不同字母表示在<0.05水平具有显著性差异,下同
The same subscript number at the letters represent the same group. The measured value in the same group are compared. The different letters in the same group represent significant differences,<0.05, the same as below
图2显示,在20~80 μmol photons/(m2·s)光强范围内,极北海带幼苗的类胡萝卜素含量随着光强的升高逐渐降低。当光强升高到100 μmol photons/ (m2·s)时,幼苗的类胡萝卜素含量有所增加。20、40和100 μmol photons/(m2·s)光强组的类胡萝卜素含量均较高,三者无显著差异(>0.05)。40~100 μmol photons/(m2·s)光强组之间无显著差异(>0.05)。
2.3 不同光强下极北海带幼苗的可溶性蛋白含量
图3显示,在本研究光强范围内,随着光强的升高,极北海带幼苗的可溶性蛋白含量呈先升高后降低的趋势。40、60和80 μmol photons/(m2·s)光强组的可溶性蛋白含量均较高,三者相比无显著差异(> 0.05),20、40、80和100 μmol photons/(m2·s)光强组的可溶性蛋白含量之间相比亦无显著差异(>0.05)。Pearson相关性分析表明,可溶性蛋白含量与RGR呈极显著正相关关系(相关系数为=0.712,<0.01)。
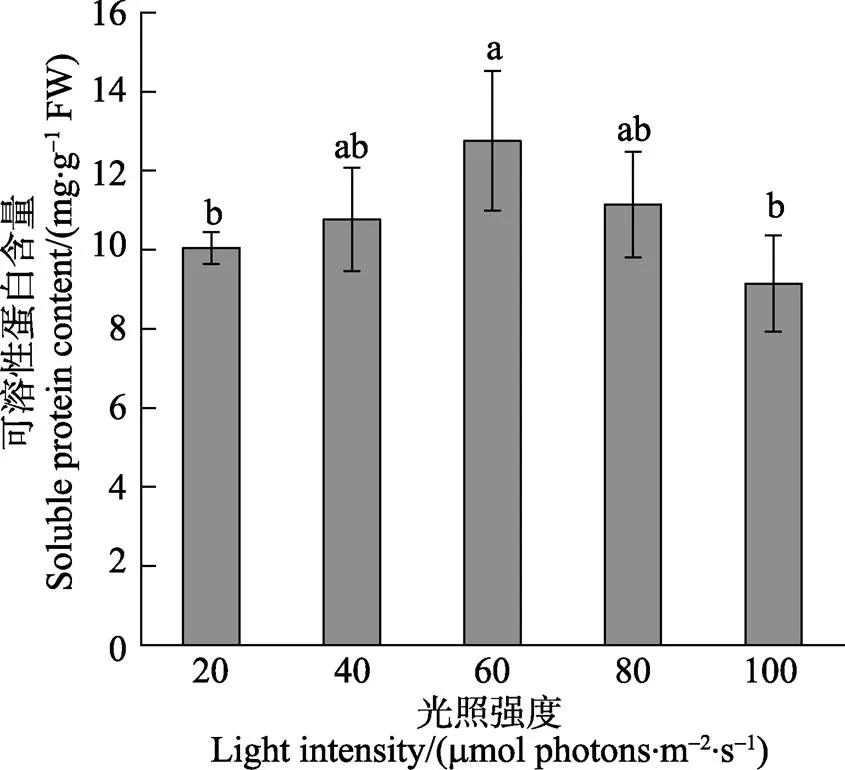
图3 极北海带幼苗在不同光强下的可溶性蛋白含量
2.4 不同光强下极北海带幼苗的丙二醛(MDA)和超氧阴离子(SA)含量
方差分析表明,光强对极北海带幼苗的MDA含量有显著影响(<0.05)。图4显示,20 μmol photons/ (m2·s)光强组的MDA含量最大,80和100 μmol photons/ (m2·s)光强组次之,40和60 μmol photons/(m2·s)光强组的MDA含量均较低。20 μmol photons/(m2·s)光强组的MDA含量与其他光强组的相比差异显著(<0.05)。Pearson相关性分析表明,MDA含量与RGR呈显著负相关关系(相关系数为=-0.58,<0.05)。
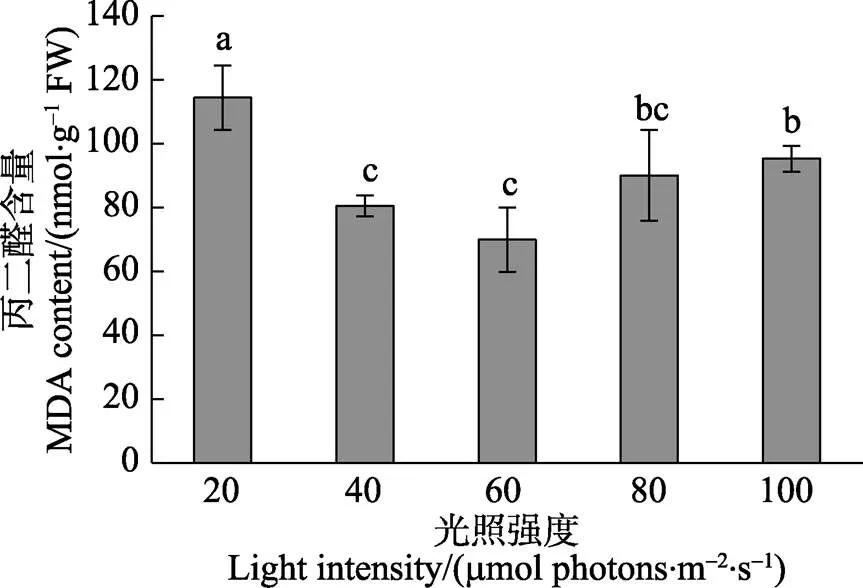
图4 极北海带幼苗在不同光强下的丙二醛(MDA)含量
方差分析结果表明,光强对极北海带幼苗的SA含量有显著影响(<0.05)。图5显示,20 μmol photons/ (m2·s)光强组的SA含量最大,与其他光强组相比均显著差异(<0.05)。40~100 μmol photons/(m2·s)光强范围内各组的SA含量之间相比无显著差异(>0.05)。Pearson相关性分析表明,SA含量与MDA含量呈极显著正相关关系(相关系数为=0.829,<0.01)。
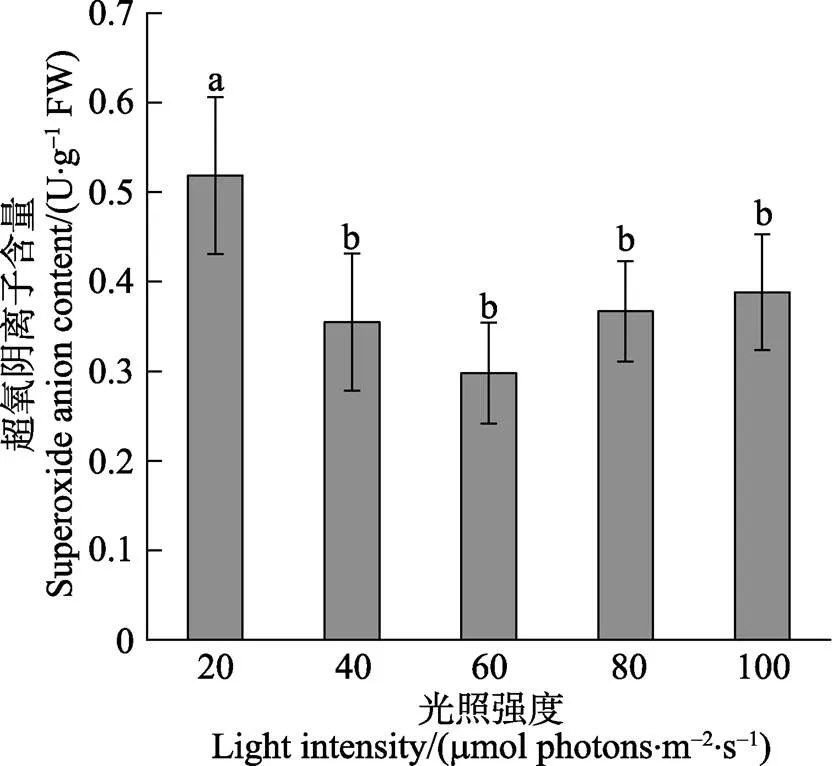
图5 极北海带幼苗在不同光强下的超氧阴离子含量
2.5 不同光强下极北海带幼苗的抗氧化酶(SOD、POD和CAT)比活力
方差分析表明,光强对极北海带幼苗的SOD、POD和CAT的比活力均有显著影响(<0.05)。图6显示,100 μmol photons/(m2·s)光强组的SOD和POD比活力均较大,与其他光强组相比均差异显著 (<0.05)。20和80 μmol photons/(m2·s)光强组的SOD比活力均较低,与其他光强组相比均差异显著(< 0.05)。40和60 μmol photons/(m2·s)光强组的SOD比活力无显著差异(>0.05)。80 μmol photons/(m2·s)光强组的POD比活力最低,与40和100 μmol photons/(m2·s)光强组相比均差异显著(<0.05),而与20和60 μmol photons/(m2·s)光强组相比均无显著差异(>0.05)。20、40和60 μmol photons/(m2·s)光强组的POD比活力之间无显著差异(>0.05)。40和60 μmol photons/(m2·s)光强组的CAT比活力均较大,二者无显著差异(>0.05)。20 μmol photons/(m2·s)光强组的CAT比活力最小,与40和60 μmol photons/(m2·s)光强组相比均差异显著(<0.05),而与80和100 μmol photons/(m2·s)光强组相比均无显著差异(>0.05)。
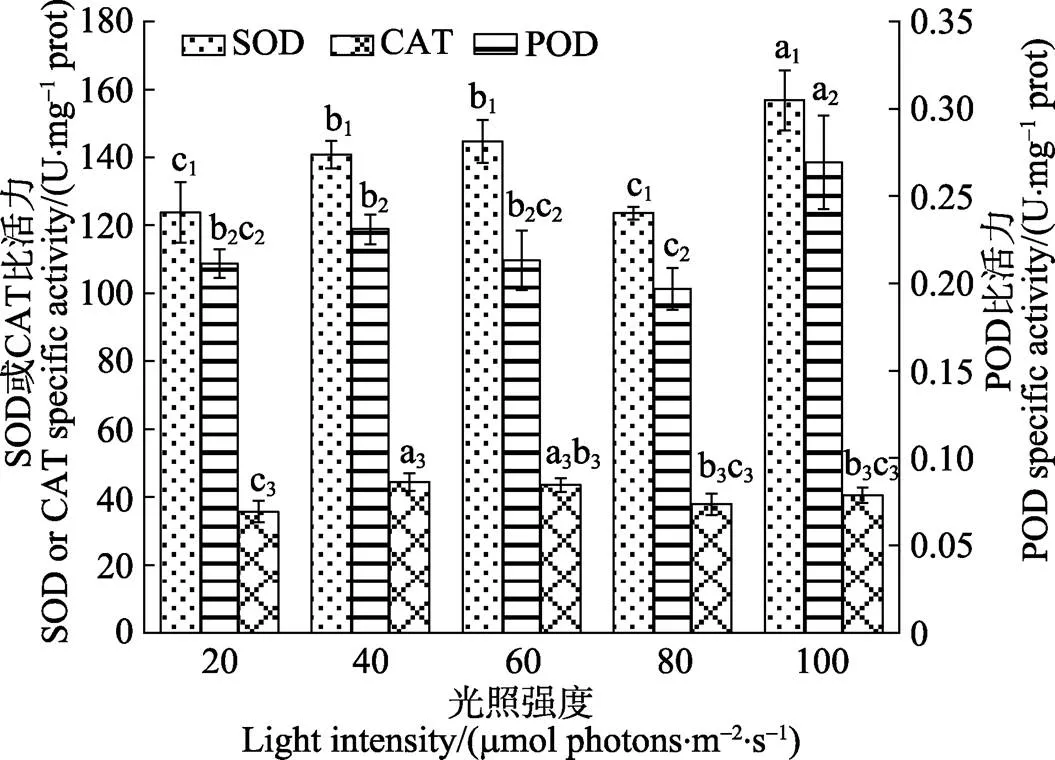
图6 极北海带幼苗在不同光强下的SOD、POD和CAT比活力
Pearson相关性分析表明,SOD比活力与MDA含量及SA含量均呈负相关关系(相关系数分别为=-0.337,=-0.331),而相关性均未达到显著水平(>0.05)。POD与SOD比活力呈极显著正相关关系(相关系数为=0.706,<0.01)。CAT比活力与MDA含量及SA含量均呈负相关关系(相关系数分别为=-0.466,=-0.546),其中,CAT比活力与SA含量的相关性达到显著水平(<0.05)。
3 讨论
生长于水深5 m及以下的极北海带个体一般小于生长于水深2~3 m的个体,如在水深2 m和12 m处,年龄约为2年的极北海带的平均柄长度分别为34 cm和9 cm (Jupp, 1974; Kain, 1963; Kain, 1971; Larkum, 1972)。极北海带垂直分布上限是略高于最低天文潮位处,而垂直分布下限因地而异,如在英格兰西南部透明度很高的海域,极北海带分布下限可达36 m,而在海水浑浊的环境中仅为1~2.5 m (Kain, 1971)。由此可知,光照是影响极北海带个体大小和垂直分布的重要因素之一。因此,若要把极北海带应用于藻场建设及人工养殖,了解其适宜的光照范围尤为重要。
植物体内可溶性蛋白质大多数是参与各种代谢的酶类,其含量可反映植物体内总代谢水平(詹冬梅等, 2013)。本研究中,在40~80 μmol photons/(m2·s)光强范围内,RGR及可溶性蛋白含量均较高,表明该光强范围对极北海带幼苗的生长有利。从RGR及可溶性蛋白含量的相关性可推测,极北海带幼苗代谢水平与其生长速率密切相关。活性氧(Reactive oxygen species,ROS),如SA自由基(O2–)、羟基自由基(•OH)、过氧化氢(H2O2)与单线态氧(1O2)等,是植物有氧代谢的副产物。大量活性氧可导致蛋白质、膜脂和其他细胞组分的严重损伤。MDA是活性氧攻击膜脂而形成的最终降解产物,其含量可以反映植物遭受逆境伤害的程度(杜秀敏等, 2001)。本研究显示,SA含量与MDA含量呈极显著正相关关系,且MDA含量与RGR呈显著负相关关系,由此可推测,极北海带幼苗中SA含量与MDA含量密切相关,膜脂的过氧化可能是导致极北海带幼苗相对生长速率降低的原因之一。
在正常生理条件下,植物本身的抗氧化系统(分为酶促抗氧化系统和非酶促抗氧化系统)可对活性氧进行有效清除,酶促抗氧化系统包括SOD、POD、CAT及谷胱甘肽还原酶(GR)等各种抗氧化酶,非酶促抗氧化系统包括维生素C、维生素E、类胡萝卜素等各种抗氧化剂(薛鑫等, 2013)。植物体内活性氧处于不断产生和清除的动态平衡中,抗氧化系统是维持这种平衡的关键。一旦遭受环境胁迫,这种平衡可能就会被破坏,使植物细胞中积累大量的活性氧(薛鑫等, 2013; 尹永强等, 2007)。过饱和光强是植物产生大量活性氧的重要诱因之一,可对植物造成光氧化损害(郭连旺等, 1996)。研究表明,极北海带成体的新生叶片饱和光强在80~100 μmol photons/(m2·s)范围内(Lüning, 1971),而对于长度为1~15 cm的极北海带幼苗,在5℃~17℃内其饱和光强范围为52.4~100.3 μmol photons/(m2·s)(梁洲瑞等, 2108)。由此可推测,本研究中的光强100 μmol photons/(m2·s)对极北海带幼苗来说可能已达到过饱和光强水平,即处于高光逆境中。
本研究中,当光强升高到100 μmol photons/(m2·s)时,幼苗的类胡萝卜素含量有所增加,这可能与幼苗对高光强的适应性有关。据报道,类胡萝卜素可直接猝灭单线态氧或通过猝灭三线态叶绿素而阻止单线态氧的形成(单线态氧是由O2和三线态叶绿素作用产生的),从而消除单线态氧对光合作用结构的破坏(郭连旺等, 1996; 尹永强等, 2007)。由此推测,类胡萝卜素在极北海带幼苗对抗高光胁迫过程中发挥重要作用。SOD是生物体内特异清除SA自由基(O2–)的酶,其与O2–反应产生H2O2和O2,是抗氧化的第一道保护层;POD是以H2O2为电子受体催化底物氧化的酶,CAT可与H2O2专一结合,即POD和CAT均可消除H2O2(阎成士等, 1999)。本研究中,SOD及CAT的比活力与SA和MDA含量均呈负相关关系,其中,CAT比活力与SA含量的相关性达到显著水平,表明SOD及CAT对于极北海带幼苗中活性氧的清除、降低膜脂的过氧化伤害发挥着关键作用。在100 μmol photons/(m2·s)的高光强环境下,SOD和POD的比活力均较大,与其他光强组相比均呈显著差异,且POD比活力与SOD比活力呈极显著正相关关系,由此可推测,在极北海带幼苗的酶促抗氧化系统中,SOD和POD可对高光逆境产生积极响应,可协同作用清除细胞内由高光强诱发引起的过量活性氧。CAT主要定位于线粒体、过氧化物体与乙醛酸循环体中,而叶绿体中H2O2的清除主要是通过Halliwell-Asada途径进行的,该途径主要是由抗坏血酸过氧化物酶(APX)和GR等抗氧化酶发挥关键作用(阎成士等, 1999)。因此,本研究中,在高光强环境下幼苗却没有表现出最高的CAT比活力,这可能与CAT在细胞中的位置和其他抗氧化酶的作用有关,即高光强直接对极北海带幼苗叶绿体产生了光氧化损害,而APX和GR对高光强诱发引起的幼苗叶绿体中过量的H2O2进行了有效清除,该猜测有待于下一步进行研究验证。综合上述结果可推测,极北海带幼苗的酶促抗氧化系统和非酶促抗氧化系统均可对高光逆境作出积极应答,它们可相互辅助以清除活性氧,降低光氧化伤害。
研究表明,极北海带成体的新生叶片光补偿点约为12 μmol photons/(m2·s)(Lüning, 1971),而对于长度为1~15 cm的极北海带幼苗,在5℃~17℃范围内其光补偿点范围为4.6~15.4 μmol photons/(m2·s)(梁洲瑞等, 2018)。战吉宬等(2003)研究认为,环境光强持久低于或短时间显著低于植物光饱和点,但不低于限制其生存的最低光照强度时的光环境,可以称为弱光逆境。由此推测,极北海带幼苗在20 μmol photons/(m2·s)光强下可能已处于弱光逆境中。弱光逆境可影响植物的光合作用、光合产物的运输和分配、营养元素的吸收、内源激素水平和抗氧化酶活性等生理生化过程(王明等, 2007)。本研究中,在20~80 μmol photons/ (m2·s)光强范围内,极北海带幼苗的叶绿素a和类胡萝卜素含量随着光强的减弱均呈现出逐渐降低的趋势。许多大型海藻在一定光强范围内色素含量也会呈现出这种变化趋势(陈伟洲等, 2015; 姜宏波等, 2009; 林贞贤等, 2007; 刘静雯等, 2001)。研究认为,这是植物表现出的生长补偿效应,即植物可通过增加细胞色素含量来更有效地捕获光能,以适应弱光环境(Beale, 1971; 王艺等, 2010)。弱光逆境可导致植物体内MDA含量的升高,受不同弱光胁迫强度和胁迫时间的影响,不同抗氧化酶的活性会有所差异(王明等, 2007)。本研究中,在20 μmol photons/(m2·s)的弱光环境下,极北海带幼苗的SA含量和MDA含量均显著高于其他处理组,且SOD、POD和CAT的比活力均较低。综合上述结果可推测,在弱光逆境下,极北海带幼苗虽然能通过增加体内叶绿素a的含量以更有效地捕获有限的光能,但幼苗的可溶性蛋白合成效率及抗氧化酶比活力均显著下降,从而造成其活性氧代谢发生了较严重的失衡,进而造成较严重的细胞膜脂过氧化损害,该氧化损害是导致极北海带幼苗相对生长速率降低的原因之一。
Beale SI, Appleman D. Chlorophyll synthesis in chlorella: Regulation by degree of light limitation of growth. Plant Physiology, 1971, 47(2): 230–235
Bixler HJ, Porse H. A decade of change in the seaweed hydrocolloids industry. Journal of Applied Phycology, 2011, 23(3): 321–335
Chen WZ, Zhong ZH, Liu T,. Effects of different light intensities and temperatures on growth and chemical constituents of. Transactions of Oceanology and Limnology, 2015(1): 28–34 [陈伟洲, 钟志海, 刘涛, 等. 光照强度和温度对智利江蓠生长及生化组分的影响. 海洋湖沼通报, 2015(1): 28–34]
Chouhan A, Iqbal S, Maheshwari RS,. Study of effect of air pollution on photosynthetic pigment of some plants growing in Pithampur Industrial Area, Dhar (M.P.). International Journal of Current Scientific Research, 2011, 1(4): 187–190
Drew EA, Jupp BP, Robertson WAA. Photosynthesis and growth ofin British waters. Underwater Research, 1976, 369–379
Du XM, Yin WX, Zhao YX,. The production and scavenging of reactive oxygen species in plants. Chinese Journal of Biotechnology, 2001, 17(2): 121–125 [杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制. 生物工程学报, 2001, 17(2): 121–125]
Fan X. Research and utilization of algae as feed additives. Feed Industry, 1991, 12(11): 14–16 [范晓. 海藻作为饲料添加剂的研究和利用. 饲料工业, 1991, 12(11): 14–16]
Guo LW, Shen YG. Protective mechanisms against photodamage in photosynthetic apparatus of higher plants. Plant Physiology Communications, 1996, 32(1): 1–8 [郭连旺, 沈允钢. 高等植物光合机构避免强光破坏的保护机制. 植物生理学通讯, 1996, 32(1): 1–8]
Jiang HB, Tian XL, Dong SL,. Effects of temperature and light intensity on the growth and biochemical composition of. Chinese Journal of Applied Ecology, 2009, 20(1): 185–189 [姜宏波, 田相利, 董双林, 等. 温度和光照强度对鼠尾藻生长和生化组成的影响. 应用生态学报, 2009, 20(1): 185–189]
Jupp BP, Drew EA. Studies on the growth of, (Gunn.) Fosl. I. Biomass and productivity. Journal of Experimental Marine Biology & Ecology, 1974, 15(2): 185–196
Kain JM, Jones NS. Aspects of the biology ofⅡ. Age, weight and length. Journal of the Marine Biological Association of the United Kingdom, 1963, 43(1): 129–151
Kain JM, Jones NS. Aspects of the biology ofIV. Growth of early sporophytes. Journal of the Marine Biological Association of the United Kingdom, 1965, 45(1): 129–143
Kain JM. Aspects of the biology ofI. vertical distribution. Journal of the Marine Biological Association of the United Kingdom, 1962, 42(2): 377–385
Kain JM. Populations ofat various latitudes. Helgoländer Wissenschaftliche Meeresuntersu- chungen, 1967, 15(1–4): 489–499
Kain JM. Synopsis of biological data on. FAO Fisheries Synopsis No. 87, 1971
Kelly E. The role of kelp in the marine environment. Irish Wildlife Mannuals No. 17, 2005
Kremer BP. Carbohydrate reserve and dark carbon fixation in the brown macroalga,. Journal of Plant Physiology, 1984, 117(3): 233–242
Lapointe BE, Tenore KR, Dawes CJ. Interactions between light and temperature on the physiological ecology of(Gigartinales: Rhodophyta). Marine Biology, 1984, 80(2): 161–170
Larkum AWD. Frond structure and growth in. Journal of the Marine Biological Association of the United Kingdom, 1972, 52(2): 405–418
Li HS. Principle and technology of plant physiology and biochemistry experiment. Beijing: Higher Education Press, 2000, 169 [李合生. 植物生理生化实验原理和技术. 北京:高等教育出版社, 2000, 169]
Liang ZR, Liu FL, Yuan YM,. Effect of different temperatures on growth and photosynthetic characteristic ofyoung seedling. Marine Sciences, 2018, 42(4): 71–78 [梁洲瑞, 刘福利, 袁艳敏, 等. 不同温度对极北海带幼苗生长及光合特性的影响. 海洋科学, 2018, 42(4): 71–78]
Lin ZX, Gong XZ, Li DP. Effects of light and the stress of nutrients deficiency on the growth and levels of chemical constituents of. Marine Sciences, 2007, 31(11): 22–26 [林贞贤, 宫相忠, 李大鹏. 光照和营养盐胁迫对龙须菜生长及生化组成的影响. 海洋科学, 2007, 31(11): 22–26]
Liu JW, Dong SL. Interactions between light and temperature on the growth and levels of chemical constituents ofvar. Liui. Journal of Ocean University of Qingdao, 2001, 31(3): 332–338 [刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响. 青岛海洋大学学报, 2001, 31(3): 332–338]
Lu WW, Wang QH, Gong QL. Effects of light and temperature on growth and biochemical composition of a marine macroalga () young sporophyte. Periodical of Ocean University of China, 2016, 46(1): 40–48 [芦薇薇, 王巧晗, 宫庆礼. 光照强度和温度对巨藻幼孢子体的生长和生化组成的影响. 中国海洋大学学报, 2016, 46(1): 40–48]
Lu X, Li MZ, Xu ZG,. Impact of light intensity on growth and levels of photosynthetic pigments of. Progress in Fishery Sciences, 2013, 34(1): 145–150 [卢晓, 李美真, 徐智广, 等. 光照对脆江蓠生长及光合色素含量的影响. 渔业科学进展, 2013, 34(1): 145–150]
Lüning K. Seasonal growth ofunder recorded underwater light conditions near Helgoland. Proceedings of the 4th European Marine Biology Symposium, 1971, 347–361
Pedersen MF, Nejrup LB, Fredriksen S,. Effects of wave exposure on population structure, demography, biomass and productivity of the kelp. Marine Ecology Progress Series, 2012, 451(1): 45–60
Phillips GO, Williams PA. Handbook of Hydrocolloids. Woodhead Publishing, 2009, 807–828
Qin Y. Alginate fibres: An overview of the production processes and applications in wound management. Polymer International, 2008, 57(2): 171–180
Qu YY, Wang WW, Cao ZM,. Determining the ratio of mannuronic acid to guluronic acid(M/G) of five species of brown algae. Progress in Fishery Sciences, 2016, 37(3): 160–164 [曲艳艳, 王伟伟, 曹增梅, 等. 5种褐藻的甘露糖醛酸和古罗糖醛酸比值测定. 渔业科学进展, 2016, 37(3): 160–164]
Schiener P, Black KD, Stanley MS,. The seasonal variation in the chemical composition of the kelp species,,, and. Journal of Applied Phycology, 2015, 27(1): 363–373
Schoschina EV. On(Laminariales, Phaeophyceae) on the murman coast of the barents sea. Sarsia North Atlantic Marine Science, 1997, 82(4): 371–373
Sjøtun K, Fredriksen S, Lein TE,. Population studies offrom its northern range of distribution in Norway. Proceedings of the International Seaweed Symposium, 1993, 14: 215–221
Smale DA, Burrows MT, Moore P,. Threats and knowledge gaps for ecosystem services provided by kelp forests: A northeast Atlantic perspective. Ecology & Evolution, 2013, 3(11): 4016–4038
Wang LM, Li SG, Chai Y,. Indoor culture and sexual reproduction synchronization ofyoung seedlings. Journal of Fisheries of China, 2011, 35(3): 395–404 [王丽梅, 李世国, 柴雨, 等. 鼠尾藻幼苗的室内培养及有性生殖同步化. 水产学报, 2011, 35(3): 395–404]
Wang M, Jiang WJ, Yu HJ. Effect of low light stress on plant physiology and its control measures. Journal of Inner Mongolia Agricultural University, 2007, 28(3): 198–203 [王明, 蒋卫杰, 余宏军. 弱光逆境对植株生理特性的影响及其调控措施. 内蒙古农业大学学报, 2007, 28(3): 198–203]
Wang Y, Wei XL. Advance on the effects of different light environments on growth, physiological biochemistry and morphostructure of plant. Journal of Mountain Agriculture and Biology, 2010, 29(4): 353–359, 370 [王艺, 韦小丽. 不同光照对植物生长、生理生化和形态结构影响的研究进展. 山地农业生物学报, 2010, 29(4): 353–359, 370]
Willenbrink J, Rangoni-Kübbeler M, Tersky B. Frond development and CO2-fixation in. Planta, 1975, 125(2): 161–170
Xue X, Zhang Q, Wu JX. Research of reactive oxygen species in plants and its application on stress tolerance. Biotechnology Bulletin, 2013(10): 6–11 [薛鑫, 张芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013(10): 6–11]
Yan CS, Li DQ, Zhang JH. Plant leaf senescence and oxidative stress. Chinese Bulletin of Botany, 1999, 16(4): 398–404 [阎成士, 李德全, 张建华. 植物叶片衰老与氧化胁迫. 植物学通报, 1999, 16(4): 398–404]
Yin YQ, Hu JB, Deng MJ. Latest development of antioxidant system and responses to stress in plant leaves. Chinese Agricultural Science Bulletin, 2007, 23(1): 105–110 [尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展. 中国农学通报, 2007, 23(1): 105–110]
Zhan DM, Wu HY, Liu MX,. Impact of irradiances on growth and biochemical composition of. Progress in Fishery Sciences, 2013, 34(1): 140–144 [詹冬梅, 吴海一, 刘梦侠, 等. 光照强度对海黍子生长及部分生化指标的影响. 渔业科学进展, 2013, 34(1): 140–144]
Zhan JC, Huang WD, Wang LJ. Research of weak light stress physiology in plants. Chinese Bulletin of Botany, 2003, 20(1): 43–50 [战吉宬, 黄卫东, 王利军. 植物弱光逆境生理研究综述. 植物学通报, 2003, 20(1): 43–50]
Effects of Light Intensities on the Growth and Biochemical Characteristics ofYoung Seedling
LIANG Zhourui1,2, LIU Fuli1,2①, DU Xinxin3, YUAN Yanmin4, LIANG Qidi1, WANG Wenjun1,2, SUN Xiutao1,2, WANG Feijiu1,2
(1. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071; 2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 3. College of Marine Science and Engineering, Qingdao Agricultural University, Qingdao 266109; 4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306)
is an important commercial seaweed, which has great potential for seaweed bed construction and artificial cultivation in China. To verify the suitable light for the growth ofyoung seedlings and clarify the biochemical response mechanism under light stress, the relative growth rate and biochemical responses under different light intensities were studied. Under these experimental conditions, the main conclusions are as follows: Light was beneficial for the growth ofyoung seedlings in the range of 40~80 μmol photons/(m2·s). The relative growth rate showed significant negative interrelation withthe content of malondialdehyde (MDA), which indicates that membrane lipid peroxidation may be one of the reasons contributing to the low relative growth rate ofyoung seedlings. An extremely significant positive correlation was found between the content of superoxide anion (SA) and the content of MDA ofyoung seedlings. The specific activity of superoxide dismutase (SOD) and catalase (CAT) were negatively correlated with the content of SA and MDA, respectively. And the negative relationship between the specific activity of CAT and the content of SA was significant. Moreover, an extremely significant and positive correlation was found between specific activity of peroxidase (POD) and SOD. It can be inferred from the above correlation analysis results that SOD, CAT and POD play important roles in removing reactive oxygen species (ROS) and there is a significant synergy between SOD and POD inyoung seedlings. The light stress environment was not conducive to the accumulation of soluble protein resulting in the accumulation of MDA inyoung seedlings, which indicates that the total metabolic level was reduced and the ROS level was increased in this environment. The content of carotenoid and the specific activity of SOD and POD inyoung seedlings will increase so that the ROS level can be reduced under high light stress, thus relieving light oxidative damage. The content of chlorophyll-a ofyoung seedlings will increase so that it can capture the limited light energy more effectively under low light stress. However, the antioxidant enzyme activity was significantly decreased as a result that led to a serious imbalance of ROS metabolism under low light stress, which resulted in more severe membrane lipid peroxidation damage. These results can provide the theoretical basis for the artificial breeding and cultivation ofin the future.
; Light intensity; Growth; Biochemical composition; Antioxidant system
LIU Fuli, E-mail: liufl@ysfri.ac.cn
* 中国水产科学研究院基本科研业务费专项(2016PT03; 2016HY-JC0302)、青岛市民生科技计划项目(17-3-3-65-nsh)、农业农村部农业国际合作交流项目——“一带一路”热带国家水产养殖科技创新合作项目和现代农业产业技术体系(CARS-50)共同资助[This work was supported by Special Scientific Research Funds for Central Non-Profit Institutes, Chinese Academy of Fishery Sciences (2016PT03; 2016HY-JC0302), Qingdao Science and Technology Project of People’s Livelihood (17-3-3-65-nsh), Projects of International Exchange and Cooperation in Agriculture, Ministry of Agriculture and Rural Affairs, Technology and Innovation Cooperation in Aquaculture with Tropical Countries along the Belt and Road, and China Agriculture Research System (CARS-50)]. 梁洲瑞,E-mail: liangzr@ysfri.ac.cn
刘福利,副研究员,E-mail: liufl@ysfri.ac.cn
2018-05-23,
2018-06-26
Q945.79
A
2095-9869(2019)04-0115-08
10.19663/j.issn2095-9869.20180523002
梁洲瑞, 刘福利, 杜欣欣, 袁艳敏, 梁启迪, 汪文俊, 孙修涛, 王飞久. 光强对极北海带幼苗生长和生化特性的影响. 渔业科学进展, 2019, 40(4): 115–122
Liang ZR, Liu FL, Du XX, Yuan YM, Liang QD, Wang WJ, Sun XT, Wang FJ. Effects of light intensities on the growth and biochemical characteristics ofyoung seedling. Progress in Fishery Sciences, 2019, 40(4): 115–122
(编辑 马璀艳)
