液态活检方法检测晚期非小细胞肺癌患者EGFR突变及临床分析
2019-08-03郑晋张秋蕊周灵戴然然周敏丁永杰
郑晋 张秋蕊 周灵 戴然然 周敏 丁永杰
上海交通大学医学院附属瑞金医院呼吸与危重症医学科 上海交通大学医学院呼吸病研究所 200025
2018年我国国家癌症中心公布的最新癌症数据显示,肺癌为我国癌症发病率及病死率第一位[1]。根据2015年公布的全球肿瘤流行病学统计数据 (GLOBOCAN 2012),2012年全球约有180万的患者被确诊为肺癌,数目约占所有确诊癌症的13%,居全球癌症首位[2]。虽然肺癌的诊断技术已不断进步,治疗方案逐步完善,但目前肺癌发病率和病死率仍在逐年上升。肺癌根据组织病理学分型可分为非小细胞肺癌 (non-samll cell lung cancer,NSCLC)和小细胞肺癌,其中约85%的肺癌是NSCLC[3]。NSCLC患者早期多无明显症状,由于缺乏有效的筛查手段,被确诊的NSCLC 患者多已经进展到晚期从而失去手术机会,5年生存率不足20%[4]。不像小细胞肺癌对化疗较为敏感,晚期NSCLC一直缺乏具有显著疗效的治疗方式,目前多是采取以化疗、放疗及靶向治疗为基础的综合治疗,而靶向治疗因其一定的疗效成为NSCLC 重要的治疗方法。
肺癌的靶向治疗主要代表药物为表皮生长因子受体-酪氨酸激酶抑制剂 (epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)和单克隆抗体 (贝伐珠单抗等)。研究发现,40%~80%的NSCLC 中表皮生长因子受体 (epidermal growth factor receptor,EGFR)被过度激活和表达,其与细胞增殖、血管生成和细胞凋亡密切相关[3]。事实上,NSCLC多可检测到EGFR 基因突变,突变多发生在18~21外显子上[3]。而EGFRTKI能够阻断EGFR 下游信号通路,从而抑制肺癌的进展。循证医学研究证实EGFR 突变的NSCLC患者通过EGFR-TKI治疗可获益。
组织学方法活检是肺癌诊断的金标准,但由于其有创性,对于一些难以耐受侵入性操作获得组织标本的患者,往往不能取到肿瘤组织进行检测。液态活检是一种以患者体液为检测标本的非侵入性检测手段,是通过敏感的检测手段检测肿瘤细胞释放于体液中的标志物以获取肿瘤信息。由于其取材方便、快捷且能够动态监测肿瘤基因信息的特点,具有良好的发展前景。液态活检主要检测物包括循环肿瘤细胞、循环肿瘤DNA、长链非编码RNA、小分子RNA、外泌体等。目前液态活检已经广泛应用于肺癌的EGFR 基因检测,成为肺癌EGFR 基因检测的有效手段之一[5-6]。
本项研究随机选取了107例均已采用液态活检进行血浆EGFR 基因检测的晚期NSCLC患者,通过对其血浆EGFR 基因表达情况和临床资料的比较,回顾性分析了EGFR 突变患者的临床诊疗特点,以此指导EGFR 基因检测在NSCLC患者中的临床应用。
1 对象与方法
1.1 临床资料 选取2012年1月至2017年12月上海交通大学医学院附属瑞金医院收治的经过EGFR 基因检测的晚期 NSCLC 患者 107 例。EGFR 基因检测样本为血浆,检测位点包括第18、19、20、21外显子。晚期定义为根据2009年国际肺癌研究学会公布的第7版肺癌TNM 分期系统中初次确诊为肺癌Ⅲ~Ⅳ期的患者 (Ⅲ期18例,Ⅳ期89 例)。患者中男 66 例,女 41 例;年龄(63.38±2.04)岁,年龄范围为27~84岁。组织病理类型包括腺癌93例、鳞癌8例、腺鳞癌4例、鳞癌伴大细胞癌1例、肉瘤样癌1例。本研究回顾性收集患者相关资料,对患者的诊断和治疗没有任何干预和影响,符合 《赫尔辛基宣言》的原则。
1.2 治疗随访 治疗方式包括手术治疗9例、化疗83例、放疗16例、靶向治疗67例和免疫治疗1例,其中有9例患者未行治疗。随访开始时间为治疗开始时间,随访终止时间为2017年12月31日。总生存期 (overall survival,OS)定义为治疗开始至因任何原因导致死亡的时间,计算对象为在OS内仅通过药物治疗 (包括化疗、靶向治疗和免疫治疗)的患者。无进展生存期 (progressive-free survival,PFS)定义为一线治疗开始至疾病进展(包括出现远处转移、出现新发病灶和病灶增大达疾病进展水平)及任何原因导致死亡的时间,计算对象为在PFS内仅通过药物治疗 (包括化疗、靶向治疗和免疫治疗)的患者。
1.3 EGFR 基因检测方法 检测样品为血浆,按照人类血浆游离DNA 提取试剂盒 (上海允英医疗科技有限公司)说明书提取血浆内游离DNA,后按照人类EGFR 基因突变检测试剂盒 (上海允英医疗科技有限公司)说明书通过实时荧光定量PCR方法检测提取的DNA 样本中EGFR 19-Dels、L858R、 T790M、 20-Ins、 G719A、 G719S、G719C、S768I、L861Q 突变。本组资料中有29例患者均进行了血浆和组织EGFR 检测,两者一致率为89.7%,血浆EGFR 检测特异度84.2%,敏感度100%。
1.4 统计学分析 采用SPSS 19.0统计软件进行χ2检验、logistic回归分析、COX 回归分析和生存分析,计数资料以例数 (百分比)表示,OS及PFS以月份数表示,P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征分析 入组患者中EGFR 突变型63例,野生型44例,EGFR 突变率为58.9%。EGFR突变型中,外显子18突变1例,外显子19突变39例,外显子20突变14例,外显子21突变25例。患者中单个位点突变49例,多个位点突变14 例 (EGFR 18/21突变1例 ,19/21突变6例 ,19/20突变5例,20/21突变1例,19/20/21突变1例)。
入组患者中>60岁70例,≤60岁37例;男66例,女41 例;有吸烟史47 例,无吸烟史60例;中央型肺癌30例,周围型肺癌77例;肿瘤原发灶部位在右肺67例,左肺40例,肺上叶55例,肺下叶33例,肺门18例,肺中叶1例。患者中最常见首发症状为咳嗽、咳痰 (表1)。患者在病程中远处转移45例,其中多发远处转移23例,骨转移43例,肝转移18例,脑转移30例,肾转移3例,肾上腺转移7例。
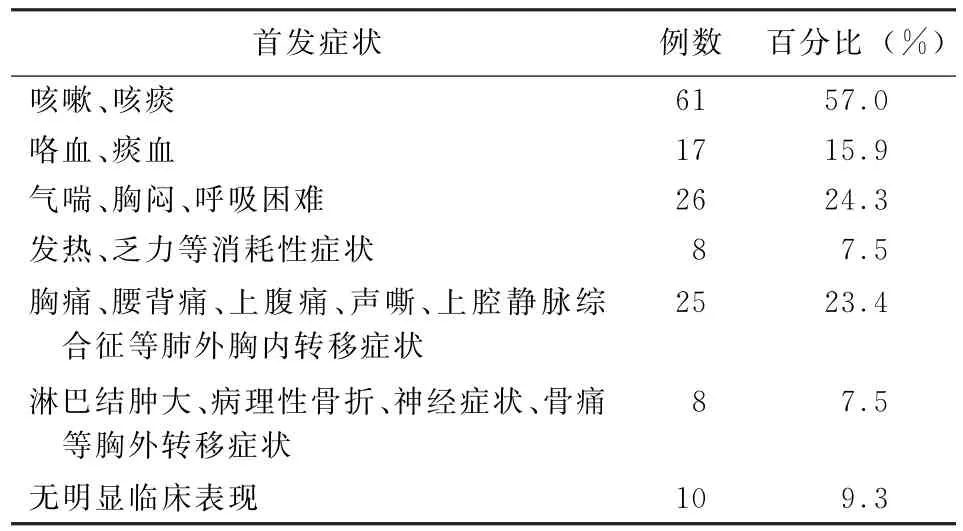
表1 107例晚期非小细胞肺癌患者首发临床症状特点
2.1.1 EGFR 突变型和野生型患者临床特征分析从年龄、性别、吸烟史、病理类型、影像学分型、肿瘤原发病灶部位、远处转移七个方面对EGFR 突变型和野生型进行比较分析发现,女性EGFR突变率与男性比较差异有统计学意义 (χ2=7.685,P=0.006)。而年龄、吸烟史、病理类型、影像学分型、肿瘤原发灶部位及远处转移在EGFR突变型和野生型比较中,差异均无统计学意义(P值均>0.05),见表2。对性别因素进一步做logistics回归分析,发现女性与EGFR 突变型具有显著相关性 (OR=3.294,95%CI:1.393~7.79,P=0.007)。
2.1.2 EGFR 单个位点突变和多位点突变患者临床特征分析 通过对单个位点突变和多位点突变的临床特征比较分析可以发现,EGFR 单或多位点突变在年龄、性别、吸烟史、病理类型、影像学分型、肿瘤原发病灶部位比较中,差异均无统计学意义 (P值均>0.05),见表2。在远处转移方面,是否发生肝转移在单个位点和多位点突变患者中比较差异有统计学意义 (χ2=4.162,P=0.041),而在骨转移和脑转移中并非如此。采用logistic回归分析对该因素进行分析可发现多位点突变与发生肝转移无明显相关性 (OR=3.981,95%CI:0.994~15.943,P=0.051)。
2.2 药物治疗预后及疗效分析 本研究中化疗83例,靶向治疗67 例 (靶向治疗药物包括EGFRTKI和单克隆抗体,其中使用EGFR-TKI的有吉非替尼27 例、厄洛替尼22 例、埃克替尼11 例、阿法替尼4例、克唑替尼4例、阿帕替尼2例、奥希替尼2例,使用单克隆抗体为贝伐珠单抗23例),免疫治疗1例 (伊匹木单抗)。病程中仅使用药物治疗的患者73例,其中仅使用化疗26例,仅使用靶向治疗11例,使用靶向+化疗36例。一线治疗仅使用药物治疗的患者86 例,其中仅使用化疗47例,仅使用靶向治疗18 例,使用靶向+化疗21例。
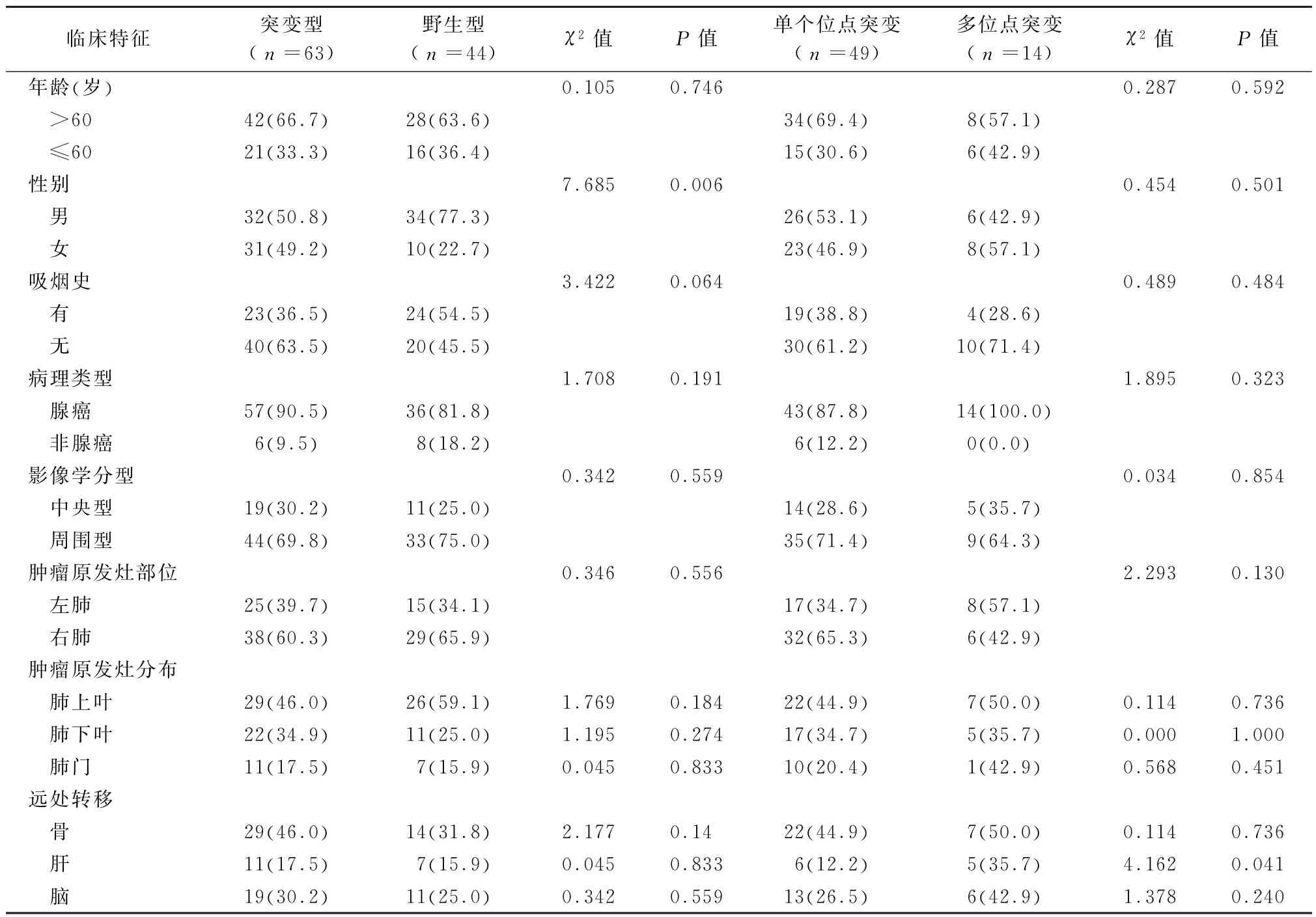
表2 EGFR 突变状态及突变位点数量患者的临床特征比较分析 [例 (%)]
2.2.1 EGFR 是否突变对预后的影响 通过生存分析发现EGFR 突变型和野生型患者经药物治疗后OS比较差异无统计学意义 (χ2=3.526,P=0.060),但PFS 比较差异有统计学意义 (χ2=5.927,P=0.015),突变型较野生型PFS明显延长 (HR=0.511,95%CI:0.288~0.905,P=0.021)。对于治疗过程中仅使用化疗的患者,EGFR 突变型和野生型的OS和PFS比较差异均无统计学意义 (χ2=0.002、2.228,P值均>0.05)。
2.2.2 EGFR 突变位点数量对预后的影响 63例EGFR 突变型患者中,排除手术或放疗的患者,仅使用药物治疗的患者共46例,55例一线治疗仅使用药物治疗 (18例仅使用EGFR-TKI,23例仅使用化疗,14 例使用化疗+EGFR-TKI±贝伐珠单抗)。通过生存分析发现单个位点突变的患者较多位点突变OS显著延长 (χ2=3.951,P=0.047),但突变位点数量并非为影响OS的独立因素 (HR=7.158,95%CI:0.742~69.021,P=0.089);突变位点数量对PFS并无显著影响 (χ2=0.491,P=0.484)。对于一线治疗仅使用化疗 (χ2=0.039,P=0.843)或仅使用EGFR-TKI(χ2=0.936,P=0.333)治疗的患者,EGFR 突变位点数量对PFS均无显著影响。
2.2.3 EGFR 突变型患者EGFR-TKI的疗效评价在仅使用药物治疗的EGFR 突变型患者中排除使用单克隆抗体 (贝伐珠单抗)的患者,29 例使用EGFR-TKI,9例仅使用化疗,使用EGFR-TKI较仅使用化疗的患者OS明显延长 (χ2=11.493,P=0.001)。在使用EGFR-TKI患者中一线或一线联合化疗较一线仅使用化疗OS显著延长 (χ2=8.632,P=0.003)。EGFR-TKI作为二线或二线以上用药患者的OS与仅使用化疗的患者比较,差异无统计学意义 (χ2=2.896,P=0.089);EGFR-TKI作为一线用药或一线联合化疗用药患者与二线或二线以上用药患者OS比较,差异无统计学意义 (χ2=2.864,P=0.091)。
2.2.4 EGFR 野生型患者EGFR-TKI疗效评价在44例EGFR 野生型患者中,排除经过手术或放疗的患者,27例仅使用了药物治疗,一线治疗均采用化疗,其中排除7 例病程中使用单克隆抗体(贝伐珠单抗)及免疫治疗 (伊匹木单抗)的患者,3例均使用EGFR-TKI作为一线联合化疗或二线、二线以上用药,17例未使用EGFR-TKI,两者OS比较,差异无统计学意义 (χ2=0.018,P=0.894)。
3 讨论
目前肺癌仍是世界上最常见的癌症,由于肺癌早期症状的隐匿性,诊断时多已处于中晚期,患者往往难以得到早期治疗。近年来,靶向药物尤其EGFR-TKI药物的出现为晚期肺癌患者带来了希望。EGFR 属于ErbB受体家族,为受体酪氨酸激酶家族,能够与配体结合以磷酸化的形式激活Ras/Raf/MAPK 等下游信号通路,促进细胞增殖及血管生成,抑制细胞凋亡[7]。EGFR 以基因突变、基因扩增、表达上调的形式在肿瘤细胞中被过度激活,从而可作为抗肿瘤的治疗靶点。EGFR 突变多见于东亚、肺腺癌的患者中[8-10]。本组资料中,93 例腺癌患者有57 例 (61.3%)检测到EGFR 突变,高于非腺癌患者的EGFR 突变率,但差异无统计学意义。此外,大量资料显示EGFR突变更多见于女性、无吸烟史的患者中。Yang等[9]对315例NSCLC患者进行临床分析,其中女性、非吸烟、腺癌的患者较可能发生EGFR 突变,EGFR 突变状态还与癌胚抗原的表达水平正相关,当癌胚抗原≥20μg/L,尤其在20~49μg/L 时提示该患者EGFR 突变的可能性大。Shi等[10]对1 482例亚洲国家晚期NSCLC 患者的EGFR 突变状态进行分析发现,EGFR 突变状态与国家、性别、种族、吸烟状态、吸烟时长、疾病分期均有关,EGFR 突变更多见于女性、无吸烟史或吸烟年限短、疾病分期越晚的腺癌患者中,但文献也提示仍有超过50%的EGFR 突变阳性患者存在于男性或吸烟人群中。本组资料显示,EGFR 突变更多见于晚期NSCLC女性患者中,非吸烟、腺癌患者的EGFR 突变率更高,但差异无统计学意义;EGFR突变状态也与患者年龄、原发灶的部位、肺癌影像学分型和远处转移无明显相关性。虽然EGFR 突变患者有着鲜明的临床特征,但仅基于临床特征进行EGFR 基因检测是存在一定局限性的。
此外,本研究还探究了EGFR 多位点突变可能存在的临床特点和对预后的影响,发现对于多位点突变的EGFR 突变型患者较单个位点突变更易发生肝转移,且OS显著缩短,提示预后较差。但多位点突变导致该临床特点的背后原因还待进一步探讨。
EGFR-TKI能够阻断酪氨酸激酶结构域与ATP相接处,从而阻断下游通路的信号转导[7]。目前常用的EGFR-TKI有吉非替尼、厄洛替尼、阿法替尼等。一项meta分析显示相比使用一线化疗,吉非替尼、厄洛替尼、阿法替尼的使用对EGFR 突变的肺癌患者缓解率明显提高,PFS明显延长 (中位PFS 9.6~13.1月比4.6~6.9月,HR=0.37,P<0.001),患者的症状得到更有效的控制[11]。Maemondo等[12]选取日本230例已发生转移EGFR 突变阳性的NSCLC患者给予紫杉醇+卡铂化疗或吉非替尼单药治疗,研究发现吉非替尼组相比标准化疗组PFS显著延长,吉非替尼组中位PFS可达10.8个月 (HR=0.3,95%CI:0.22~0.41,P<0.001),而标准化疗组中位PFS为5.4个月,同时吉非替尼组的缓解率也明显高于化疗组(73.7% 比30.7%,P<0.001)。本组资料显示突变型患者的PFS 显著延长 (HR=0.511,95%CI:0.288~0.905,P=0.021),EGFR 突变型患者使用EGFR-TKI较仅使用化疗的OS 明显延长 (P=0.001),EGFR 野生型患者中EGFR-TKI作为一线联合化疗或二线、二线以上用药与未使用EGFR-TKI的OS 比较,差异无统计学意义,且EGFR 突变状态并不影响患者从化疗中的获益成都,可见EGFR 突变型患者使用EGFR-TKI可得到更多获益。本组资料还显示一线使用或一线联合化疗使用EGFR-TKI的EGFR突变型患者较仅使用化疗OS 显著延长 (P=0.003),EGFR-TKI作为二线或二线以上用药的患者较仅使用化疗OS 延长,但差异无统计学意义,表明一线使用或早期使用EGFR-TKI可有效延长患者OS。同时,有研究报道一线使用EGFRTKI也可显著改善NSCLC患者的生存质量并延长PFS[12-13]。总而言之,对于EGFR 突变的NSCLC患者,建议一线使用或早期使用EGFR-TKI治疗。
液态活检作为一项有望代替组织活检的新兴病理检测技术逐渐走入人们的视野。在这个提倡 “精准医疗”的时代,液态活检凭借其方便快捷、无创性的特点为人们所青睐。液态活检技术已成为肺癌EGFR 基因有效检测技术之一。一项涉及13项研究的meta分析显示2 349例晚期NSCLC 患者样本中血液EGFR 基因检测具有较高的特异度 (96%,95%CI:0.90~0.99)及敏感度(61%,95%CI:0.49 ~ 0.72)[14]。2017年公布的IGNITE研究显示在2 581例NSCLC患者中血液检测具有较高特异度,亚太地区患者中达到97.2%,血浆与组织的一致率为77.7%[15]。本研究选取的患者均使用液态活检技术进行EGFR 基因检测,29例均进行组织和血浆EGFR 基因检测的患者中,血浆EGFR 基因检测特异度为84.2%,敏感度为100%,与组织EGFR 基因检测一致率可达89.7%。可见液态活检技术在EGFR 基因检测应用中有一定的可靠性。
综上所述,EGFR 突变更多见于晚期NSCLC中的女性患者,与患者年龄、肿瘤原发灶的部位、影像学分型、远处转移无显著相关性。多位点EGFR 突变的晚期NSCLC 患者更易发生肝转移,预后较单个位点突变差。EGFR-TKI对EGFR 突变型晚期NSCLC患者有显著疗效,建议一线使用或早期使用EGFR-TKI治疗。液态活检可作为肺癌EGFR 基因检测的有效手段之一。由于EGFR基因检测仍存在一定的假阴性,了解EGFR 突变患者的临床特征对于协助指导临床用药和个体化治疗有着重要作用。如何制定有效的EGFR-TKI治疗策略还需待进一步研究。
利益冲突所有作者均声明不存在利益冲突
