联合检测血清IDH1和Cyfra21-1在非小细胞肺癌中的临床价值
2019-08-03陈燕马尚白万秋尹颜军张鑫桐时广利
陈燕 马尚 白万秋 尹颜军 张鑫桐 时广利
北京市结核病胸部肿瘤研究所 首都医科大学附属北京胸科医院检验科 101149
肺癌是目前全球最常见的严重威胁人类健康和生命的恶性肿瘤之一,近几年肺癌的发病呈年轻化的趋势,其病死率排在癌症的第一位[1]。75%的肺癌患者为非小细胞肺癌 (non-small cell lung cancer,NSCLC),发现时大多数为晚期肺癌 (Ⅲ期和Ⅳ期),5年生存率大概只有10%,而早期肺癌 (Ⅰ期和Ⅱ期)患者的5 年生存率大约是40%[2]。因此,提高NSCLC 患者生存率的有效手段是早期发现和早期治疗。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)普遍存在于人的细胞质中,是一种蛋白酶,在细胞的代谢过程中起着重要作用,其主要功能是参与机体的应激损伤防御[3]。目前有研究表明,IDH1在肺癌组织中表达异常,并参与肺癌发病相关信号通路的传导[4]。细胞角蛋白19 片段 (cytokerantin-19,Cyfra21-1)是目前临床上常用的肺癌肿瘤标志物。本研究主要探索IDH1和Cyfra21-1 在NSCLC 患者血清中的浓度水平,分析联合检测血清IDH1和Cyfra21-1在NSCLC的早期诊断、辅助诊断和鉴别诊断中的临床应用价值。
1 对象与方法
1.1 研究对象 纳入2016年5月至2018年8月首都医科大学附属北京胸科医院肿瘤科NSCLC 患者247例为NSCLC 组,其中年龄 (51.2±23.4)岁,年龄范围为42~76岁;男146例,女101例;腺癌180例,鳞癌67例。所有患者为初次发现的NSCLC患者,并经过病理学确诊,既往未经过任何化疗、放疗或手术。肺部良性疾病组包括肺结核患者、肺炎患者或肺部良性结节患者共80例 (男34例、女46例)。健康组为北京胸科医院体检正常的职工50例 (男29例、女41例),血脂、肝肾功能指标正常,无高血压和糖尿病病史等。本研究符合 《赫尔辛基宣言》的原则。
1.2 研究方法 采集3组空腹静脉血标本各4 ml,在2 h内离心分离血清,然后放置于-80 ℃超低温冰箱中保存,最后集中进行IDH1和Cyfra21-1的测定。IDH1的检测采用北京现代高达生物技术有限责任公司生产的IDH1酶联免疫法定量检测试剂盒,吸光度值的测定采用进口酶标仪 (型号:Multiskan),IDH1的临界参考值为5μg/L。Cyfra21-1的检测采用上海透景生物技术公司生产的全自动流式荧光免疫分析仪完成 (型号:TESMI),Cyfra21-1的临界参考值为4μg/L。所有标本的检测过程严格按照试剂盒和仪器的说明书进行操作。
1.3 统计学分析 采用SPSS软件进行统计学分析,所有资料数据进行正态性分布检验,非正态分布数据以M(QR)表示,组间比较采用秩和检验方法;采用四格表计算敏感度和特异度。P<0.05为差异有统计学意义。
2 结果
2.1 3组NSCLC患者血清IDH1 和Cyfra21-1水平 NSCLC组血清中IDH1、Cyfra21-1水平均明显高于肺部良性疾病组和健康组,差异均有统计学意义 (Z=6.414、6.811,P值均<0.001),见表1。
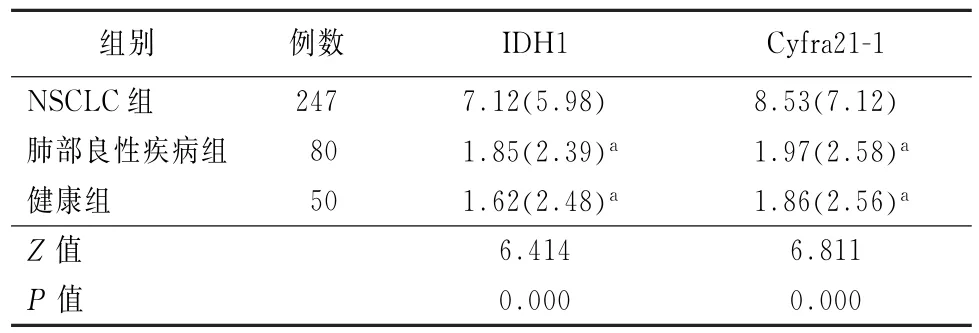
表1 3组NSCLC患者血清IDH1和Cyfra21-1的浓度水平 [μg/L,M(QR)]
2.2 不同病理类型的NSCLC 患者血清IDH1 和Cyfra21-1水平比较 鳞癌和腺癌NSCLC 患者血清IDH1 水平比较,差异无统计学意义 (Z=0.338,P>0.05);鳞癌NSCLC患者血清Cyfra21-1水平高于腺癌,差异有统计学意义 (Z=2.114,P<0.05),见表2。
2.3 不同TNM 分期的NSCLC患者血清IDH1和Cyfra21-1水平比较 Ⅰ期+Ⅱ期和Ⅲ期+Ⅳ期的NSCLC患者血清IDH1水平比较,差异无统计学意义 (Z=0.649,P>0.05);Ⅲ期+Ⅳ期的NSCLC患者血清Cyfra21-1水平高于Ⅰ期+Ⅱ期,差异有统计学意义 (Z=2.195,P<0.05),见表3。
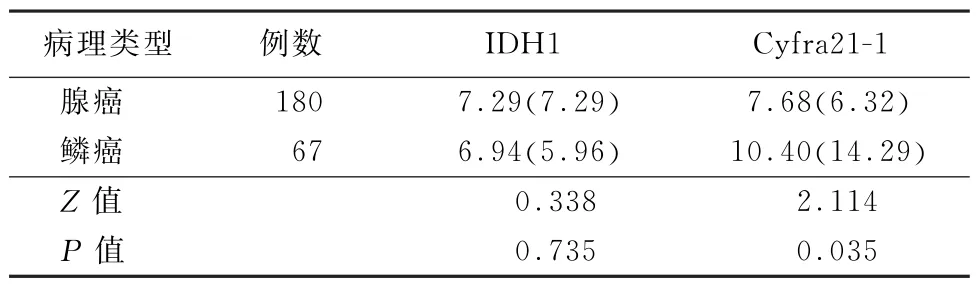
表2 不同病理类型的非小细胞肺癌患者血清IDH1和Cyfra21-1水平 [μg/L,M(QR)]
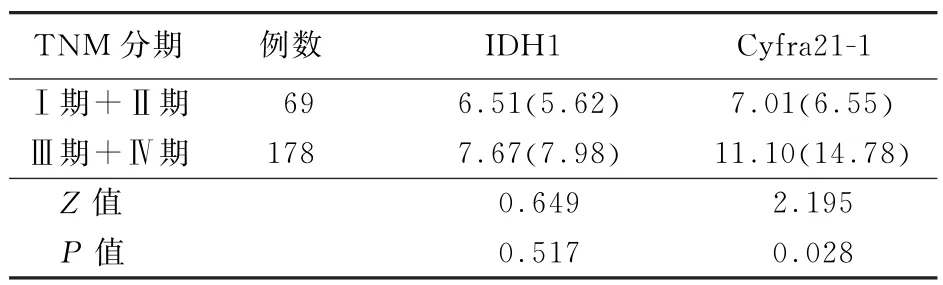
表3 不同TNM 分期的非小细胞肺癌患者血清IDH1和Cyfra21-1水平 [μg/L,M(QR)]
2.4 NSCLC 患者血清IDH1和Cyfra21-1的敏感度和特异度 NSCLC患者血清IDH1和Cyfra21-1的敏感度分别为46.5%和48.6%,特异度分别为88.5%和89.2%。二者联合对NSCLC 检测的敏感度明显提高 (61.9%),特异度略有下降 (81.5%)。
2.5 不同病理类型的NSCLC 患者血清IDH1 和Cyfra21-1敏感度的比较 血清IDH1在腺癌和鳞癌NSCLC患者中检测的敏感度分别为47.8%和43.3%,Cyfra21-1在鳞癌NSCLC 患者中检测的敏感度 (59.7%)高于腺癌NSCLC 患者的敏感度(44.4%)。
2.6 不同TNM 分期的NSCLC患者血清IDH1和Cyfra21-1敏感度的比较 血清Cyfra21-1 在Ⅲ期+Ⅳ期NSCLC 患者中检测的敏感度 (61.8%)高于Ⅰ期+Ⅱ期NSCLC 的敏感度 (14.5%),IDH1在Ⅰ期+Ⅱ期和Ⅲ期+Ⅳ期NSCLC 患者中的敏感度分别为44.9%和41.6%。
3 讨论
目前肺癌的发病率高居各种恶性肿瘤的第一位,早期肺癌患者发病时没有明显的症状,大多数肺癌患者确诊时已属于中晚期,丧失了最佳的治疗机会,因此肺癌的病死率较高,全球每年大概有130万人因患肺癌死亡[5]。目前早期肺癌患者的发现主要依靠影像学,胸部CT 在肺癌中有较高的阳性率,但是对于一些良性结节的鉴别诊断,胸部CT 有一定的局限性。虽然有学者建议肺癌的早期筛查可应用低剂量螺旋CT 的方式,但是此方式仍存在争议,还没有达成专家共识[6]。肿瘤标志物是由肿瘤细胞分泌或者是由机体产生的、进入到人的血液或体液中的物质,包括蛋白质、酶和激素等,能够在一定程度上反映肿瘤的发生、发展过程[7]。目前与肺癌相关的肿瘤标志物已经广泛应用于临床,例如癌胚抗原、Cyfra21-1、胃泌素前体、特异性神经元烯醇化酶等,用于肺癌的辅助诊断、预后判断和疗效监测。但是这些肿瘤标志物在Ⅰ期和Ⅱ期肺癌中的敏感度较低,只有20%左右[8]。因此,为了尽快发现早期肺癌患者,寻找敏感度和特异度都比较好的肺癌相关肿瘤标志物对提高肺癌患者的生存率具有重要的临床意义。
IDH1基因位于人染色体2q33上,IDH1存在于细胞质中,是三羧酸循环中重要的限速酶,可以促进NADPH 的产生,并参与细胞的代谢功能以及参与不同的生物途径、发挥不同的生物学功能[9-10]。孙涛等[4]应用荧光定量聚合酶链的方法检测了50例肺癌组织和癌旁组织中IDH1的表达水平,并且采用酶联免疫吸附试验的方法检测了50例肺癌患者和20例健康人血浆标本中IDH1的表达水平。研究结果发现,相对于癌旁组织IDH1在肺癌组织中过度表达,IDH1在肺癌患者血浆中的表达水平显著高于健康人,差异有统计学意义。Sun等[11]的研究结果同样发现,IDH1 在NSCLC患者血浆中的表达水平显著高于健康人组,差异有统计学意义,IDH1 在 NSCLC 中的敏感度为75.8%、特异度为89.6%。Cyfra21-1 是在上皮细胞凋亡的过程中,细胞角蛋白降解后形成的一种可溶性物质,可以直接进入人的血液中[12]。Cyfra21-1是目前临床常用的肿瘤标志物,2015 年版的 “中国原发性肺癌诊疗规范”中推荐Cyfra21-1主要用于NSCLC的辅助诊断、疗效监测和随访观察[13]。
本研究的结果显示,NSCLC 组患者血清中IDH1和Cyfra21-1水平高于肺部良性疾病组和健康组。IDH1在NSCLC 中的敏感度为46.5%、特异度为88.5%,Cyfra21-1 在 NSCLC 检测中的敏感度为48.6%、特异度为89.2%,二者在NSCLC中的敏感度和特异度大致相同,均可以作为NSCLC的肿瘤标志物。另外,本研究的重要发现是IDH1在早期NSCLC (Ⅰ期和Ⅱ期)中检测的敏感度 (44.9%)高于Cyfra21-1 (14.5%),提示IDH1对于早期NSCLC 的检测要优于Cyfra21-1。2015年版的 “中国原发性肺癌诊疗规范”中建议肿瘤标志物应该联合使用,可以提高检测的敏感度和特异度。本研究的结果也显示,将IDH1 和Cyfra21-1联合使用,显著提高了对NSCLC 检测的敏感度,达到了61.9%。
综上所述,血清IDH1的检测对于NSCLC 的辅助诊断有很好的临床应用价值,尤其是对Ⅰ期和Ⅱ期NSCLC 检测的敏感度优于目前使用的Cyfra21-1,联合检测IDH1和Cyfra21-1可提高Ⅰ期和Ⅱ期NSCLC的敏感度。
利益冲突所有作者均声明不存在利益冲突
