丁酸钠调控HepG2细胞的增殖、凋亡和侵袭
2019-08-02王英吴庆柏沈鹏谢睿季国忠王宏刚
王英,吴庆柏,沈鹏,谢睿,季国忠,王宏刚
肝癌是人类较为常见的恶性肿瘤,在男性恶性肿瘤中死亡率排第二位,而在女性肿瘤病人中,死亡率排第六位[1]。2008年,全球约有75万新发肝癌病人,我国死亡者约占一半[2]。肝癌的早期诊断比较困难,血清中循环无细胞DNA联合分子标志物检测有助于提高诊断率[3]。目前肝癌的临床疗效有限,亟需寻找有效的靶向药物及新的作用靶点,改善病人预后。组蛋白去乙酰化酶(HDAC) 催化组蛋白发生去乙酰化,应用 HDAC 抑制剂可通过调控靶基因的转录,抑制肿瘤细胞发生发展。HDAC4 是属于Ⅱ 类 HDACs,可能与肿瘤发生发展有关。短链脂肪酸被认为是有效的 HDAC 抑制剂,调控多种癌细胞的生长、分化以及凋亡过程。丁酸钠(Sodium butyrate)是其中一种短链脂肪酸,可在肠道细菌分解纤维素时产生。丁酸钠在1978年[4]被发现有抑制 HDAC 作用,显示出潜在的抗肝癌作用[5]。丁酸钠 能导致多种肿瘤细胞如结肠癌、肝癌、乳腺癌细胞周期阻滞,促进细胞凋亡,诱导肿瘤细胞分化[6-7],其机制可能是通过使组蛋白过乙酰化而发挥生物学作用。笔者研究丁酸钠 对肝癌细胞HepG2的增殖、凋亡和细胞侵袭能力的影响,探讨可能的作用机制。
本研究起止时间为2013年3月至2015年9月。
1 材料与方法
1.1 细胞培养 HepG2细胞系培养于含10%小牛血清和100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中。将含培养液的细胞培养瓶置于含5% 二氧化碳的细胞培养箱培养。每24~36小时换液1次,待细胞长至约80%单层时,用0.25%胰酶溶液进行消化、传代,取生长良好的细胞进行实验。
1.2 细胞活力测定(MTT法) 取对数生长期细胞,制成1×106个/毫升单细胞悬液,接种于96孔板,每孔180 μL,随即加入不同浓度的丁酸钠溶液20 μL,使药物终浓度分别为0,0.5,1,2,5,10 mmol/L,每组设6个平行复孔,对照组加入等量磷酸盐缓冲液(PBS),分别培养24 h,48 h和72 h后,每孔加入5 mg/mL的MTT 20 μL,继续孵育4 h后,弃上清液,加入二甲基亚砜(DMSO) 150 μL,震荡10 min,待结晶溶解后用酶标仪570 nm波长检测吸光度。
1.3 细胞周期和凋亡检测(流式细胞仪检测) 细胞培养于六孔板中,过夜贴壁,待细胞长至约80%时,用丁酸钠处理细胞,使药物终浓度分别为0,1,5,10 mmol/L,24 h后胰酶消化,收集细胞,PBS清洗细胞2次(1 000 r/min,5 min),予100 μg/mL 核糖核酸酶(RNase)处理,50 μg/mL 碘化丙啶(PI)避光染色,流式细胞仪检测细胞周期。细胞凋亡按照Annexin V-FITC试剂盒操作说明进行操作,流式细胞仪检测。
1.4 细胞侵袭实验(Transwell侵袭实验) 将-20 ℃保存的Matrigel置于冰上过夜融化,制备稀释的含Matrigel液体,加入到Transwell上室,覆盖整个聚碳酸酯膜,置于细胞培养箱使Matrigel 聚合成凝胶。将已用不同浓度丁酸钠处理24 h的HepG2细胞接种于Transwell培养板上室,下室加入500 μL含10%小牛血清的培养液,培养24 h后,用棉签轻轻擦去上室Matrigel 凝胶和聚碳酸酯膜上表面的细胞。小心取出上室,用冰预冷的甲醇固定30 min,结晶紫染色1 min。小心将聚碳酸酯膜自上室基底切取下来,置载玻片上,中性树脂封片。附着于聚碳酸酯膜下表面的细胞在显微镜下观察。将聚碳酸酯膜分为100个网格,按随机数字表法选取10个网格在高倍镜下(400倍)观察侵袭细胞并计数,取平均数。
1.5 免疫荧光实验 对单层生长细胞,在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,PBS洗涤后,予多聚甲醛固定细胞,再进行通透处理,通透后用PBS洗涤,使用封闭液对细胞进行封闭,抗体孵育4 ℃过夜。PST漂洗后加入二抗,室温避光孵育1 h,漂洗后封片,荧光显微镜检测。
1.6 蛋白质印迹法(Western Blot) 用PBS洗涤各组细胞3次,每孔加入蛋白裂解液,在冰上裂解30 min后,立即用细胞刮棒刮下细胞,4 ℃离心后取上清液,加入上样缓冲液,100 ℃水浴锅中变性。每组按50 μL蛋白上样量进行SDS-聚丙烯酰胺凝胶电泳,用150 mA恒流转膜1 h至聚偏氟乙烯膜上,5%脱脂奶粉封闭1 h,加一抗4 ℃孵育过夜,PBS漂洗后,加二抗室温孵育1 h,PBS漂冼。暗室内加入ECL发光液,X线片感光,显影,定影。
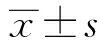
2 结果
2.1 丁酸钠抑制HepG2细胞的增殖能力 不同浓度(0.5、1、2、5、10 mmol/L)丁酸钠对 HepG2细胞的增殖能力的影响不同。低浓度(0.5 mmol/L) 丁酸钠处理 24 h后对细胞生长有轻微的促进作用。但随着丁酸钠浓度的增加(1、2、5、10 mmol/L)和处理时间的延长(24、48、72 h),HepG2细胞呈现出明显的生长抑制状态(图1)。10 mmol/L丁酸钠处理HepG2细胞24、48和72 h后,活细胞百分比分别为64.3%、41.7%、9.1%,差异有统计学意义(F=212.8,P<0.001)。

图1 丁酸钠抑制HepG2细胞的增殖能力
2.2 丁酸钠影响HepG2细胞周期分布 不同浓度(0、1、5、10 mmol/L)丁酸钠 处理HepG2 细胞24 h后,流式细胞技术检测细胞周期。1 mmol/L 丁酸钠处理后,HepG2 细胞G1期细胞比例稍增加,S期细胞比例稍减少。但随着丁酸钠浓度的增加,细胞周期明显发生阻滞,G1期细胞比例明显增加,而S期细胞比例明显减少(图2)。0、1、5、10 mmol/L丁酸钠处理HepG2细胞24 h后,S期细胞比例分别为27.4%、29.1%、12.8%、10.5%,差异有统计学意义(F=33.7,P<0.001)。
2.3 丁酸钠诱导HepG2细胞凋亡 与对照组(0 mmol/L丁酸钠)相比,不同浓度(1,5,10 mmol/L)丁酸钠处理HepG2细胞24 h后,凋亡细胞百分比明显增加,早期凋亡率分别为2.7%,4.5%,6.5%,6.7%,差异有统计学意义(F=15.1,P=0.001)。这提示丁酸钠对HepG2细胞的促凋亡作用呈药物浓度依赖性(图3)。

图2 丁酸钠影响HepG2细胞周期分布:A为不同浓度(0,1,5,10 mmol/L)丁酸钠处理HepG2细胞24 h后,细胞周期的变化;B为丁酸钠处理后,细胞周期G1期、S期、G2期的量化
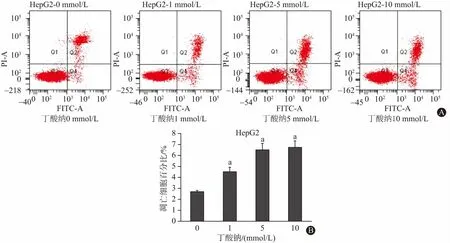
注:与对照组(0 mmol/L丁酸钠)相比,aP<0.05图3 丁酸钠诱导HepG2细胞凋亡:A为不同浓度(0,1,5,10 mmol/L)丁酸钠处理HepG2细胞24 h后,细胞凋亡增加;B为丁酸钠处理后,凋亡细胞百分比的量化
2.4 丁酸钠抑制HepG2细胞侵袭能力 本研究采用Transwell小室实验检测丁酸钠对肝癌细胞的侵袭能力。高浓度丁酸钠明显抑制了HepG2细胞的侵袭,并呈药物浓度依赖性(图4)。相对于0 mmol/L丁酸钠组,1、5、10 mmol/L丁酸钠组的侵袭细胞百分比分别降至72.7%、41.7%、21.3%,差异有统计学意义(F=202.1,P<0.001)。
2.5 HDAC4蛋白在HepG2细胞中的表达及定位应用免疫荧光法检测HDAC4蛋白的表达,发现HDAC4在HepG2细胞中表达阳性,细胞质和细胞核均有一定程度的表达,但主要位于细胞质(图5)。
2.6 丁酸钠显著抑制HDAC4蛋白表达 丁酸钠是一种HDAC抑制剂,可使组蛋白过乙酰化。不同浓度丁酸钠处理HepG2细胞后,Western Blot法检测HDAC4 蛋白的表达,发现随着处理浓度的增加,HDAC4表达显著减少(图6)。

图6 丁酸钠显著抑制HDAC4蛋白表达
3 讨论
HDAC4属于Ⅱ类 HDACs,与多种生物学过程有关,比如神经退行性疾病[8],内分泌疾病[9-10]。组蛋白乙酰化过程与肿瘤的发生发展密切相关[11-12]。可以推测,HDAC4 的抑制剂可能对肝癌有治疗作用。丁酸钠作为一种去乙酰化酶抑制剂,能够提高组蛋白乙酰化水平[13]。研究发现丁酸钠 能够抑制肿瘤细胞增殖、促进肿瘤细胞衰老和凋亡等,这可能与其提高组蛋白乙酰化有关。丁酸钠已经应用于肿瘤的临床研究,现已广泛用于畜禽饲料添加。丁酸钠能抑制大部分HDACs,除了Ⅲ类HDACs和 HDAC6、HDAC10[14]。丁酸钠对多种肿瘤细胞均有抑制作用。丁酸钠可以诱导结肠癌、食管癌、肝癌、骨髓瘤等多种肿瘤细胞凋亡,尤其在消化系统肿瘤的诱导分化和凋亡成为近年研究热点。
本研究发现丁酸钠是一种具有HDAC4抑制剂活性的短链脂肪酸。丁酸钠能抑制HepG2肝癌细胞中HDAC4的表达。随着处理浓度的增加,丁酸钠明显抑制HepG2细胞生长增殖能力,调控细胞周期,促进HepG2细胞凋亡,抑制细胞侵袭能力,但其具体作用机制还不清楚。有学者认为组蛋白去乙酰化酶抑制剂apicidin抑制了HDAC4的表达,从而抑制卵巢癌细胞的迁移[15]。研究认为HDAC4可能参与了肿瘤的侵袭和转移过程[16]。我们推测,丁酸钠可能通过抑制HDAC4而发挥作用。HDAC4属于Ⅱ类HDACs,主要表达于细胞质,但细胞核中也有,提示HDAC4在细胞质和细胞核之间可能存在信号传递的作用,有研发靶向HDAC4抗肿瘤药物的临床应用前景[17]。那么,丁酸钠是否通过抑制HDAC4而在基因水平调控肿瘤信号通路?我们下一步研究将构建HDAC4干扰载体,研究HDAC4下游的靶分子及其参与的信号途径,以进一步探讨肝癌的发生发展的机制。
总之,本研究认为丁酸钠抑制肝癌HepG2细胞增殖,促进细胞凋亡,抑制细胞侵袭能力。我们推测丁酸钠可能通过抑制HDAC4,靶向调控肝癌的进展,为研发新型化疗药提供依据。

图4 丁酸钠抑制HepG2细胞侵袭能力(0.1%结晶紫染色×100):A为0 mmol/L丁酸钠;B为1 mmol/L丁酸钠;C为5 mmol/L丁酸钠;D为10 mmol/L丁酸钠

注:绿色为HDAC4,蓝色为细胞核图5 HDAC4蛋白在HepG2细胞中的表达及定位(免疫荧光染色HDAC4,4′,6-二脒基-2-苯基吲哚染色细胞核,×400)
