虫草发酵菌丝体对胰岛素抵抗大鼠氧化应激的缓解作用
2019-08-02孙梦雪杨玉辉成向荣施用晖乐国伟
孙梦雪,韩 雪,杨玉辉,唐 雪,2,成向荣,2,施用晖,2,乐国伟,2*
1江南大学食品学院;2食品营养与功能食品工程技术研究中心,无锡 214122
随着现代经济的快速发展,人们的饮食结构和生活方式发生了巨大变化。高脂、高热能食物过量摄入,体内脂肪不断的累积,成为肥胖、糖尿病的重要发病因素。此外,快速的生活节奏,沉重的工作压力使机体长期处于精神高度紧崩状态,导致糖皮质激素(GC)水平上升,机体血糖和血压水平增高,加重了患病的风险。
胰岛素抵抗(IR)是糖尿病、肥胖和高血压等慢性代谢疾病的典型特征[1]。地塞米松(DEX)是一种人工合成的糖皮质激素,研究表明,大鼠在长期高脂饮食、急性或慢性DEX暴露的情况下,机体血脂代谢发生紊乱,血糖及胰岛素水平升高,产生IR和严重的氧化应激损伤[2-4]。因此,研究如何缓解IR状态下机体的氧化应激反应具有重要的意义。
近年来,虫草发酵菌丝体(CM)受到研究者的广泛关注。其主要化学成分及生物活性与天然虫草相似[5,6],具有降血糖、抗炎和抗氧化等多种功能[7-9]。目前关于CM体内抗氧化研究的报道较少,因此,本研究采用高脂饮食联合腹腔注射DEX诱导IR模型,初步探究CM对IR大鼠氧化应激水平的影响,为CM的应用与推广提供一定的理论基础和数据支持。
1 材料与方法
1.1 材料与试剂
SPF级雄性Wistar 大鼠40 只,4~6 周龄,130~150 g,斯莱克实验动物有限公司,SCXK(沪)2012-0002,地塞米松磷酸钠注射液(天津药业集团新郑股份有限公司),虫草发酵菌丝体(CM,市售),血糖试纸(强生稳豪)。

1.2 仪器
强生稳豪倍优血糖仪(强生医疗器材有限公司),台式高速冷冻离心机5804R(Eppendorf 公司),-80 ℃超低温冰箱(Thermo Scientific 公司),酶标仪(美国 Biotek 公司),PCR 扩增仪ETC811(东胜兴业科学仪器有限公司),ABI 7900 HT FAST 荧光定量PCR仪(美国应用系统公司)。
1.3 胰岛素抵抗大鼠模型及分组
实验动物按体重随机分成5组,正常对照组(C组),模型组(IR组),CM低剂量组(CM1组,剂量为1.65 g/kg 饲料),CM中剂量组(CM2组,剂量为3.30 g/kg 饲料),CM高剂量组(CM3组,剂量为6.60 g/kg 饲料)。IR模型采用高脂饮食联合腹腔注射DEX诱导(高脂饲料喂养三周后,连续4 周腹腔注射剂量为0.80 mg/kg体质量的 DEX)。CM干预组分别饲喂添加低、中、高剂量CM的高脂饲料,腹腔注射等量DEX;正常对照组饲喂正常饲料,腹腔注射等量生理盐水。饲料配方[10]见表1,大鼠饲养于SPF级动物房,每组2笼,每笼4 只,自由摄食和饮水,每周称重并记录,末次饲喂后,隔夜禁食不禁水12 h,心脏取血,分离血浆,取出骨骼肌,肝脏组织,液氮处理后保存于-80 ℃冰箱。

表1 饲料配方(%)Table 1 Composition of experimental diets (%)
1.4 测定指标及实验方法
1.4.1 CM体外抗氧化实验
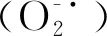
1.4.2 口服糖耐量实验
DEX注射4 周后,隔夜禁食不禁水12 h,尾部采血测0 min血糖(FBG),0 min胰岛素(FINS)。50% 葡萄糖溶液灌胃后,分别在30,60,120 min测血糖值,计算血糖曲线下面积(AUC),胰岛素抵抗指数(HOMA-IR),胰岛素敏感指数(HOMA-IS)。
1.4.3 血浆、肌肉、肝脏组织ROS测定
作为珠海市港航物流领域最具影响力、规模最大的盛会—“港航物流发展珠海论坛”至今已经成功举办五届,历届论坛聚集顶级专家和行业领袖,聚焦珠海港航物流,全方位探讨行业发展问题,多角度献策行业科学发展,为珠海区域物流体系建设和经济社会发展贡献了思维之光和破题之策。
心脏取血后,冰浴上取出肌肉和肝脏组织,利用 MP1-B 型多参数化学发光测试仪测定全血、肌肉和肝脏 ROS 水平,实验结果以发光峰积分值(RLUs) 表示[11]。
1.4.4 血脂的测定
心脏取血后,4 ℃,3 000 rpm,离心10 min ,取上层血浆,参照试剂盒说明书测定血浆中TG、TC、LDL、HDL、FFA。
1.4.5 血浆、肌肉、肝脏氧化应激指标的测定
10% 的肌肉、肝脏组织匀浆液,4 ℃,3 000 rpm,离心10 min ,取上清液,参照试剂盒说明书测定血浆、肌肉和肝脏组织中丙二醛MDA、T-AOC和GSH-Px。
1.4.6 实时荧光定量PCR

表2 引物序列Table 2 Sequence of the primers used in Real-Time PCR
1.4.7 Western blot法测定Nrf2、HO-1、NQO1蛋白表达
RIPA裂解液处理肌肉、肝脏组织提取总蛋白,BCA测定蛋白浓度,将各组蛋白稀释成统一浓度后,进行电泳、印迹、抗体孵育,ECL化学发光液进行显色,用凝胶成像系统进行扫描和拍照,分析目标条带的灰度值。
1.5 数据分析

2 结果与分析
2.1 体外实验对CM清除自由基作用研究

图1 CM(a)and VC(b)对的清除作用 Fig.1 Eliminating effect of CM (a) and VC (b) on
2.2 CM对IR大鼠体重的影响
由图2可知,各组大鼠初始体重无显著性差异(P>0.05),高脂喂养3 周后,IR组和CM干预组大鼠体重显著高于C组(P<0.01);腹腔注射DEX 4 周后,与C组相比,IR组大鼠体重显著下降(P<0.01);与IR组相比,CM1、CM2和CM3组体重增加(P>0.05)。

图2 CM对IR大鼠体重的影响 Fig.2 Effect of CM on body weight in IR rats (n 注:与正常组比较, * P<0.05,** P<0.01;与IR组比较,# P<0.05,## P<0.01Note:Compare with control rats,* P < 0.05,** P < 0.01;Compare with IR rats,# P < 0.05,## P < 0.01
2.3 CM对IR大鼠血糖、AUC、HOMA-IR、HOMA-IS的影响
由图3和表3可知,与C组相比,IR组血糖水平、AUC、FINS、HOMA-IR显著上升(P<0.01),HOMA-IS 显著下降(P<0.01);与IR组相比,CM3组0 min、120 min血糖及AUC显著下降(P<0.01,P<0.01,P<0.05),CM1、CM2、CM3组0 min胰岛素、HOMA-IR均显著下降(P<0.01),HOMA-IS 显著上升(P<0.01)。

图3 CM对IR大鼠血糖水平(a)和葡萄糖曲线下面积(b)的影响Fig.3 Effect of CM on blood glucose (a) and AUC (b) in IR rats(n

表3 CM对IR大鼠血糖FINS、HOMA-IR和HOMA-IS的影响Table 3 Effect of CM on insulin level,HOMA-IR and HOMA-IS in IR rats (n =
2.4 CM对IR大鼠血脂的影响
由表4可知,与C组相比,IR组血浆TC、TG、LDL和FFA含量显著增加(P<0.01),HDL含量显著降低(P<0.01);与IR组相比,CM1、CM2、CM3组血浆TG、LDL、FFA含量显著降低(P<0.01),HDL含量显著增加(P<0.01)。
2.5 CM对IR大鼠氧化还原状态的影响
由表5可知,与C组相比,IR组血浆、肌肉和肝脏组织ROS、MDA含量显著增加(P<0.01),T-AOC、GSH-Px酶活性显著降低(P<0.01);与IR组相比,CM1、CM2、CM3组血浆、肌肉和肝脏组织ROS、MDA含量显著降低(P<0.01),T-AOC、GSH-Px酶活性显著升高(P<0.01),其中CM3组的效果最佳。

表4 CM对IR大鼠血脂的影响Table 4 Effect of CM on lipid levels in IR rats (n

表5 CM对IR大鼠氧化还原状态的影响Table 5 Effect of CM on redox indicator of in IR rats (n
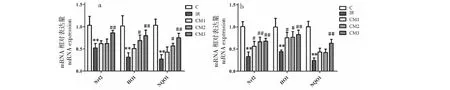
图4 CM对胰岛素抵抗大鼠肌肉(a)和肝脏(b)氧化应激相关基因表达水平的影响Fig.4 Effect of CM on the mRNA expression of oxidative stress related in IR rats muscle (a) and liver (b)
2.6 CM对IR大鼠肌肉和肝脏组织中氧化应激相关基因表达水平的影响
由图4可知,与C组相比,IR 组大鼠肌肉和肝脏组织中 Nrf2、HO-1 、NQO1 mRNA的表达水平显著下调(P<0.01);与IR组相比,CM干预后IR大鼠肌肉和肝脏组织中Nrf2、HO-1、NQO1 mRNA的表达水平显著上调(P<0.05),其中CM3组的效果最佳。
2.7 CM对IR大鼠肌肉和肝脏组织中Nrf2、HO-1、NQO1蛋白表达水平的影响
由图5可知,与C组相比,IR组大鼠肌肉、肝脏组织中Nrf2蛋白相对表达量显著下降(P<0.05);与IR组相比,CM3组IR大鼠肝脏组织Nrf2、NQO1蛋白相对表达量显著上升(P<0.05),肌肉组织中CM3组NQO1蛋白相对表达量显著上升(P<0.05)。

图5 CM对IR大鼠肌肉(a)和肝脏(b)组织中Nrf2、HO-1、NQO1蛋白表达水平的影响Fig.5 Effect of CM on the expression of Nrf2、HO-1、NQO1 protein in IR rats muscle (a) and liver (b)
3 讨论
本实验采用高脂饮食联合腹腔注射DEX来诱导大鼠IR模型,口服葡萄糖耐量实验结果显示,IR组大鼠空腹血糖、空腹胰岛素、血糖曲线下面积以及胰岛素抵抗指数显著高于正常大鼠,胰岛素敏感指数显著下降,说明成功诱导了大鼠IR模型。
氧化应激在IR发生过程中扮演了重要角色[12,13]。本研究体外实验发现,CM能够有效清除-OH、DPPH和超氧阴离子自由基,说明CM具有良好的体外抗氧化活性。有研究表明,长期高脂饮食,大鼠血浆TG、TC和FFA含量显著增加,糖脂代谢紊乱,机体对胰岛素的敏感性下降[14]。机体在肥胖、高血糖、高血脂状态下,通过提高ROS的含量,降低机体抗氧化能力,产生氧化应激[15]。本研究体内实验发现,CM干预能够显著降低高脂饮食IR大鼠血脂及血糖水平,其中CM3组的效果最佳;此外,CM干预后IR大鼠体内ROS及MDA含量显著降低,抗氧化酶T-AOC和GSH-Px(机体抗氧化系统中重要的酶)的活性显著提高;说明了CM具有显著改善IR大鼠血脂、血糖以及机体氧化应激的作用。Nrf2通路是迄今为止发现最为重要的内源性抗氧化应激通路,其可上调抗氧化蛋白和Ⅱ相解毒酶HO-1和NQO1的表达,增强机体的抗氧化能力[16]。研究表明,机体产生IR时,Nrf2表达量下调[17],本实验结果发现,CM干预后, 肌肉和肝脏组织中Nrf2、HO-1和NQO1 mRNA的表达水平显著上调;肝脏组织Nrf2、NQO1蛋白的表达量也显著上调;表明CM可能是通过上调IR大鼠机体Nrf2基因和蛋白的表达,使其下游抗氧化基因表达增加,从而降低机体的氧化应激水平。
综上所诉,CM可能是通过激活Nrf2途径缓解机体的氧化应激反应,从而改善IR大鼠血糖、血脂水平,提高机体胰岛素的敏感性。
