基于UPLC法测定离体大鼠及人源肠道菌对三七中人参皂苷代谢的差异
2019-08-02李根林齐月娟李寒冰姜文轩吴宿慧
李根林,齐月娟,李寒冰,吕 宁,姜文轩,吴宿慧
河南中医药大学,郑州 450046
肠道菌群与中药相互作用的研究是当前中医药发展中的热点问题之一[1]。中药在口服使用及实验研究中,与机体肠道菌群接触并相互影响,且肠道菌与居住环境、生活饮食等多方面有关,在不同的种属中也存在巨大的差异。研究表明人体肠道菌主要由Bacteroidetes和Firmicutes组成。而实验鼠通过人工饲养后,饮食习惯、生活环境基本相同,所以其肠道菌组成大致相同,大鼠肠道菌主要以Burkholderiales、Sphingobacteria、Sphingobateriales、α-变形杆菌和β-变形杆菌为主;而小鼠肠道菌则是以Firmicutes和Bacteroidetes为主,近几年发现小鼠的不同肠道部位的菌群组成是不相同的,小肠中主要有Actinobacteria和Proteobacteria,大肠中更多的是Mucispirillum、Alistipes、Lactobacillus、Prevotella、Barnesiella、Bacteroides和Pseudoflavonifractor[2]。因此,不同种属来源的肠道菌对同一中药的代谢过程可能存在本质的区别。
三七是五加科植物三七Panaxnotoginseng(Burk.)F.H.Chen 的干燥根,味甘、微苦,性温,2015版《中国药典》载归肝、胃经,入血分。最早记载于《跌损妙方》,首次正确绘图于《本草纲目》,属人参属,化学成分与人参相近相似,《本草纲目拾遗》有“人参补气第一,三七补血第一”之说[3],是一味名贵中药材,被广泛应用于临床,目前也是人们常用的保健品之一,动物实验中也发现三七具有降血脂、抗血栓、抗动脉粥样硬化、抗肿瘤等作用,但是,如何科学理解种属中肠道菌群种类的不同、个体间对药物代谢的差异及药理效应的同质性[4],这将有可能是打开中药现代研究的一把钥匙。鉴于此,为了探究三七与不同种属来源的肠道菌群相互作用后是否存在药理效应的差异,本实验拟提取离体大鼠及人源肠道菌,在体外厌氧模式下,开展对三七中几种常见人参皂苷与不同来源肠道菌体外代谢差异性的比较药理学研究,以期为三七临床效应的广泛应用提供理论基础。
1 试剂
人参皂苷Rg1(20160811)、人参皂苷Re(1205A021)、人参皂苷 Rb1(2016530)、人参皂苷 Rd(20160816)均购自北京索莱宝科技有限公司;原人参二醇PPD(wkq16042905)、原人参三醇PPT(wkq16052203)均购自四川省维克奇生物科技有限公司;磷酸(20170206,色谱纯 Dikma pure,HPLC Grade);肉汤培养基(HB0384-1,青岛高科技工业园海博生物技术有限公司);琼脂粉(01-023,青岛高科技工业园海博生物技术有限公司);甲醇(20170321,天津市四友精细化学品有限公司);乙腈(20170201,科密欧试剂);超纯水(杭州娃哈哈集团有限公司)。
2 主要仪器
厌氧工作站(YQX-Ⅱ,上海龙跃仪器设备有限公司,混合气体、氮气),微量台式高速离心机(D2012,北京莱博联泰科技有限公司),电子天平(BS1500,上海友声衡器有限公司),十万分之一电子天平(XS105,梅特勒-托利多集团),多功能粉碎机(150T,铂欧五金厂),Easy Well自动双重纯水器(ESM-I-30,上海茸研生化仪器厂),超高效液相色谱仪(Waters Acquity H-Class,美国Waters,QSM四元溶剂管理器,SM-FTN样品管理器,PDA检测器,Empower色谱工作站),光电浊度计(KJ.45-WZT-3,北京卓川电子科技有限公司),微量台式高速离心机(D2012,北京莱博联泰科技有限公司),电热鼓风干燥箱(GHG-9071A,上海精宏实验设备有限公司)。
3 药材
实验用三七(规格:40头)采购于云南文山。样品经河南中医药大学生药学科陈随清教授鉴定为五加科植物三七Panaxnotoginseng(Burk.) F.H.Chen的干燥根和根茎。
4 实验方法
4.1 三七水煎液的制备
取一定量三七,打粉后过40目筛,称取10.0 g三七粉末,加入10倍量的纯水浸泡30 min,加热,沸腾后文火煮30 min,过滤得滤液1和滤渣1。取滤渣1加入6倍量的纯水煮20 min,过滤得滤液2和滤渣2。合并两次滤液(1、2),浓缩至40 mL,得0.250 g/mL的三七水煎液。
4.2 鼠源/人源菌悬液的制备[5,6]
人源肠道菌悬液的制备:取3位健康男子(21~23岁,体重60~70 kg,身高172~178 cm,无抽烟、喝酒史,6个月内无使用抗生素经历)清晨第一次排出的新鲜粪便,无菌、厌氧环境下混合均匀后称量0.1 g,加入灭菌好的10 mL PBS(0.1 mol/L,pH 7.4)缓冲液,混合均匀后得浓度为1%的人源肠道菌悬液。
鼠源菌悬液的制备:取3只健康SD大鼠(购自山东省济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2014-0007)排出的新鲜粪便,在无菌、厌氧环境下称量1.0 g,加入灭菌好的100 mL PBS(0.1 mol/L,pH7.4)缓冲液,混合均匀后得浓度为1%的鼠源肠道菌悬液。
4.3 三七水煎液含药固体培养基的制备[5]
取5.4 g的肉汤培养基与5.4 g的琼脂混合均匀,加入300 mL的纯水充分溶解后灭菌待用。将三七水煎液置于70 ℃水浴锅中30 min,瞬间转移至4 ℃冰箱冷却(巴氏灭菌法),将3 mL 1.0 g/mL的三七水煎液加入2 mL PBS混匀既得0.6 g/mL的药液,随后倍比稀释为0.3、0.15、0.075 g/mL的药液。将已灭菌的培养皿放置于超净工作台内,每个培养皿倒入12.5mL已灭菌的培养基,待培养基凝固后,取0.1 mL不同浓度0.6、0.3、0.15、0.075 g/mL的药液,分别加入0.1 mL的菌悬液,混匀后用涂布器涂抹于培养基上,即得0.3、0.15、0.075、0.037 5 g/mL的含药培养基。在无菌、厌氧条件下培养48 h,观察判断菌群的生长情况并计数。
4.4 三七水煎液含药液体培养基的制备[7]
称取0.9 g肉汤培养基,加50 mL纯水,在121 ℃高温下灭菌15 min,按照表1内容配置空白组、三七水煎液组及三七+菌液共培养组,放置于无菌厌氧培养箱里培养48 h后,每组各取三个平行管,在4 ℃、3 000 rpm离心10 min后,取上清液1 mL,加入甲醇1 mL漩涡混匀,4 ℃下静置10 min,1 300 rpm离心10 min,取上清液经0.22 μm的微孔滤膜过滤后,UPLC色谱法进行三七水煎液与肠道菌共温孵后的代谢产物测定。
表1 三七与菌液共培养的液体培养基制备Table 1 Preparation of liquid medium for co-culture of Panax notoginseng and bacterial liquid
4.5 UPLC测定三七水煎液与肠道菌共温孵的代谢物测定方法
4.5.1 色谱条件[8]
色谱柱:Waters Acquity BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A),0.1%的磷酸水溶液(B);流速0.3 mL/min;柱温30 ℃;梯度洗脱条件为0~3 min,19.0%A;4~5 min,20.0%A;6~12 min,21.0%A;13~24 min,31.0%A;25~32 min,35.0%A;33~43 min,60.0%A;44~45 min,70.0%A;46~48 min,80.0%A;49~55 min,19.0%A;55~58 min,19.0%A。进样量8 μL;检测波长203 nm。
4.5.2 对照品溶液的配制
精密称取[9]对照品人参皂苷Rg1、Re、Rb1、Rd、原人参二醇PPD、原人参三醇PPT适量,配置成含有人参皂苷Rg1 1.96、Re 2.02、Rb1 2.07、Rd 2.19 mg/mL、原人参二醇PPD 2.22 mg/mL、原人参三醇PPT 0.93 mg/mL的溶液。经0.22 μm的滤头过滤后采用二倍稀释法,稀释成不同质量浓度梯度的混合对照品(n=8)。
4.5.3 方法学考察
线性关系考察:分别精密吸取上述“4.5.2”八个浓度混合对照品溶液8 μL注入超高效液相色谱仪,按“4.5.1”项下色谱条件进行检测,记录峰面积。以浓度为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,计算得线性方程、线性范围、相关系数(见表2、图1)
精密度实验:精密吸取对照品母液,稀释得Rg1 20.438、Re 21.063、Rb1 21.563、Rd 22.812、PPT 23.125、PPD 9.625 μg/mL的混合对照品,按照“4.5.1”项下色谱条件,平行测定6次,记录其人参皂苷及原人参二醇/三醇的峰面积并计算RSD值。
重复性实验:取人源肠道菌与三七水煎液共温孵的代谢产物6份,按照“4.5.1”项下色谱条件进行测定其峰面积,计算其人参皂苷及原人参二醇PPD/三醇PPT的含量并计算RSD值。
稳定性实验:取人源肠道菌与三七水煎液共温孵的代谢产物分别在0、2、4、6、8、12、16、20、24 h,按照“4.5.1”项下色谱条件进行测定,计算其人参皂苷及原人参二醇PPD/三醇PPT的含量及RSD值。

表2 相关系数考察Table 2 Investigation of correlation coefficient

图1 混合对照品的UPLC色谱图Fig.1 UPLC chromatography of mixed reference materials
加样回收率实验:取已知含量的人源肠道菌与三七水煎液的代谢产物样品6份,加入相对应样品100%的对照品,按照“4.5.1”项下色谱条件进行测定,计算其人参皂苷及原人参二醇PPD/三醇PPT的回收率及RSD值。
5 数据处理及统计方法
采用IBM SPSS19.0软件进行数据分析,两组数据的统计方法采用独立样本t检验,三组及以上的数据统计分析采用单因素方差分析,当方差齐性(P>0.05)时多重比较用Dunnett分析,方差不齐性(P<0.05)时多重比较用Wilcoxon分析。P<0.05认为数据间有显著的统计学意义,P<0.01认为数据间有极显著的统计学意义。
6 结果
6.1 三七水煎液对肠道菌群的调节作用
固体培养法结果显示:阴性对照组只加药考察药物对培养基的影响发现并无菌落生成,表明环境及培养条件符合要求(见图2)。与空白组相比,在0.037 5~0.3 g/mL范围内,三七水煎液随着浓度的升高对大鼠(图3)及人源(图4)肠道菌群促进作用增强。对菌落数进行统计的单因素方差分析结果表明:与人源空白组相比,0.037 5~0.3 g/mL给药组菌落数有显著性差异(P<0.01),在此浓度范围内三七水煎液对肠道菌作用表现促进;鼠源结果同人源,在此浓度范围内三七水煎液促进肠道菌的生长(见表3)。

图2 三七水煎液对培养基的影响Fig.2 Effect of Panax notoginseng decoction on medium.注:a为空白组,b-e为给药组,浓度分别为0.0375、0.075、0.15、0.3g/m L(下同)。Note:a:blank control group,b-e:administration groups,concentrations were 0.0375,0.075,0.15,0.3g/mL,respectively,(similarly hereinafter).

图3 三七水煎液对大鼠源肠道菌群的调节作用 Fig.3 The regulating effect of Panax notoginseng decoction on rats intestinal flora
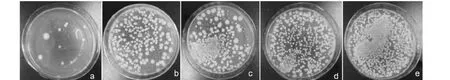
图4 三七水煎液对人源肠道菌群的调节作用 Fig.4 The regulating effect of Panax notoginseng decoction on human intestinal flora

表3 三七水煎液对人/鼠源肠道菌体外生长的影响Table 3 Effects of Panax notoginseng decoction on the growth of human/rats intestinal bacteria in
注:与空白组相比,*P<0.05,**P<0.01。
Note:Compare with control,*P< 0.05;**P< 0.01.
6.2 UPLC测定肠道菌对三七水煎液的代谢作用及代谢物鉴定
6.2.1 方法学考察结果
精密度实验结果:人参皂苷及原人参二醇/三醇的峰面积得Rg1、Re、Rb1、Rd、PPD、PPT的RSD值分别为0.96%、0.36%、0.51%、0.49%、2.55%、0.54%,表明仪器精密度良好。
重复性实验结果:人参皂苷及原人参二醇PPD/三醇PPT的含量得Rg1、Re、Rb1、Rd、PPD、PPT的RSD值分别为0.31%、0.20%、0.33%、0.55%、7.46%、1.44%,表明样品重复性良好。
稳定性实验结果:人参皂苷及原人参二醇/三醇的含量得Rg1、Re、Rb1、Rd、PPD、PPT的RSD值分别为0.61%、0.52%、0.66%、0.77%、5.77%、4.21%,表明样品在0~24 h内稳定性良好。
加样回收率实验结果:Rg1、Re、Rb1、Rd、PPD、PPT的RSD值分别为0.70%、1.70%、1.17%、1.92%、2.55%、1.24%,如表4所示。
6.2.2 样品测定结果
经测定知三七中含有三醇型人参皂苷Rg1 9.450 0、Re 1.887 2 mg/g,二醇型人参皂苷Rb18.581 6、Rd 1.945 6 mg/g。三七水煎液中未检测出原人参二醇PPD及原人参三醇PPT。经过与大鼠肠道菌共培养后,三七中含有的二醇型皂苷含量有轻微降低,而三醇型皂苷含量未见明显变化,但有少量PPT (0.018 4 mg/g)的生成。

表4 加样回收率(n=6)Table 4 Sample recovery rate(n=6)
与人源肠道菌共培养后,三七中含有的二醇型、三醇型人参皂苷含量显著降低,重要的是,在培养液中检测到代谢产物PPD和PPT的存在,含量分别为0.213 6 mg/g及0.034 4 mg/g,见表5,图5、6。
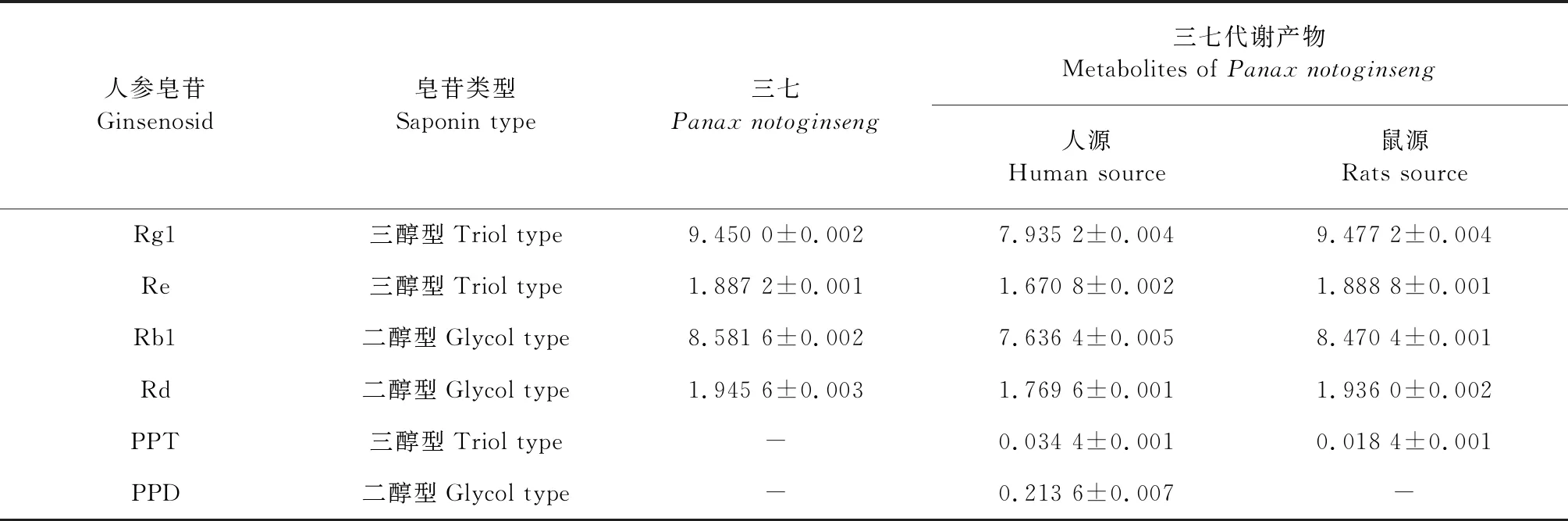
表5 UPLC法测定三七中四种人参皂苷的含量及与肠道菌共温孵后代谢产物的含量(mean±S.D,n=4,mg/g)Table 5 Determination of four ginsenosides in Panax notoginseng and the content of metabolites co-incubated with intestinal bacteria by UPLC method (mean±S.D,n=4,mg/g)

图5 人源/鼠源肠道菌对三七的代谢作用及代谢产物的测定Fig.5 Metabolism of human/rats gut microfloar to Panax notoginseng and determination of its metabolite
7 讨论
众所周知,中药可直接调整肠道菌群结构而影响健康,而肠道菌群亦能影响口服中药在体内的吸收、代谢、转化等过程,从而影响药物疗效的发挥[10]。本实验采用传统平板固体培养法研究了三七水煎液对肠道菌群生长情况的影响,结果发现0.009 4 g/mL的三七水煎液对肠道菌生长无显著影响,但在0.009 4~0.075 0 g/mL范围内,随着三七水煎液浓度的升高,药物对肠道菌群促进作用显著增强。提示:三七水煎液对肠道菌群有一定的调节作用,与文献报道一致[11],为离体进行肠道菌孵育方法系统研究三七中皂苷类成分的代谢过程奠定了基础,后续我们将进一步验证菌群种类的改变特征。
有文献报道在常规药理药效实验中,哺乳类啮齿目动物大鼠与人的代谢模式最为相似,常被用来模拟人体的代谢,且SPF级别大鼠的肠道菌群比人和小鼠更加稳定[12]。在对实验样本的处理上,为了避免实验结果的个体差异,因此常选择三例样本的肠道菌群混匀后与药物混合作为研究模式[13]。本实验采用UPLC的方法对人源/鼠源肠道菌群与三七水煎液共温孵培养48 h后的代谢产物进行测定,结果发现与三七水煎液的原有三醇型人参皂苷Rg1、Re及二醇型人参皂苷Rb1、Rd[14]含量相比,三七鼠源肠道菌代谢产物中二醇型皂苷含量略有降低,而人源肠道菌代谢产物中皂苷含量变化幅度相对较大,且有PPD与PPT生成,与文献报道一致[6,7]。目前研究显示离体人参皂苷的代谢主要是通过肠道内BifidobacteriumK506、Eubac-teriumA-44、Prevotellaoris、FusobacteriumK-60、Paecilomy-cesBainiersp.、BacteroidesJY-6等协同完成的[15]。其中人参皂苷Re主要依靠BacteroidesJY-6生成Rh1和F1,并产生少量的PPT[16];人参皂苷Rgl和Rbl是三七总皂苷中含量最高的2个成分,人参皂苷Rg1则主要通过肠道内FusobacteriumK-60代谢生成苷元进而发挥作用[17,18];人参皂苷Rb1在厌氧和有氧环境下,被肠菌液代谢成为人参皂苷Rd、F2、CK,代谢产物相同,但代谢的快慢有所差异[19],一般情况下,有氧代谢速率快于厌氧代谢速率[10]。在肠道菌的作用下,此类皂苷发生脱糖基反应代谢成为相应的单糖苷和苷元有可能是真正发挥药效的物质[6]
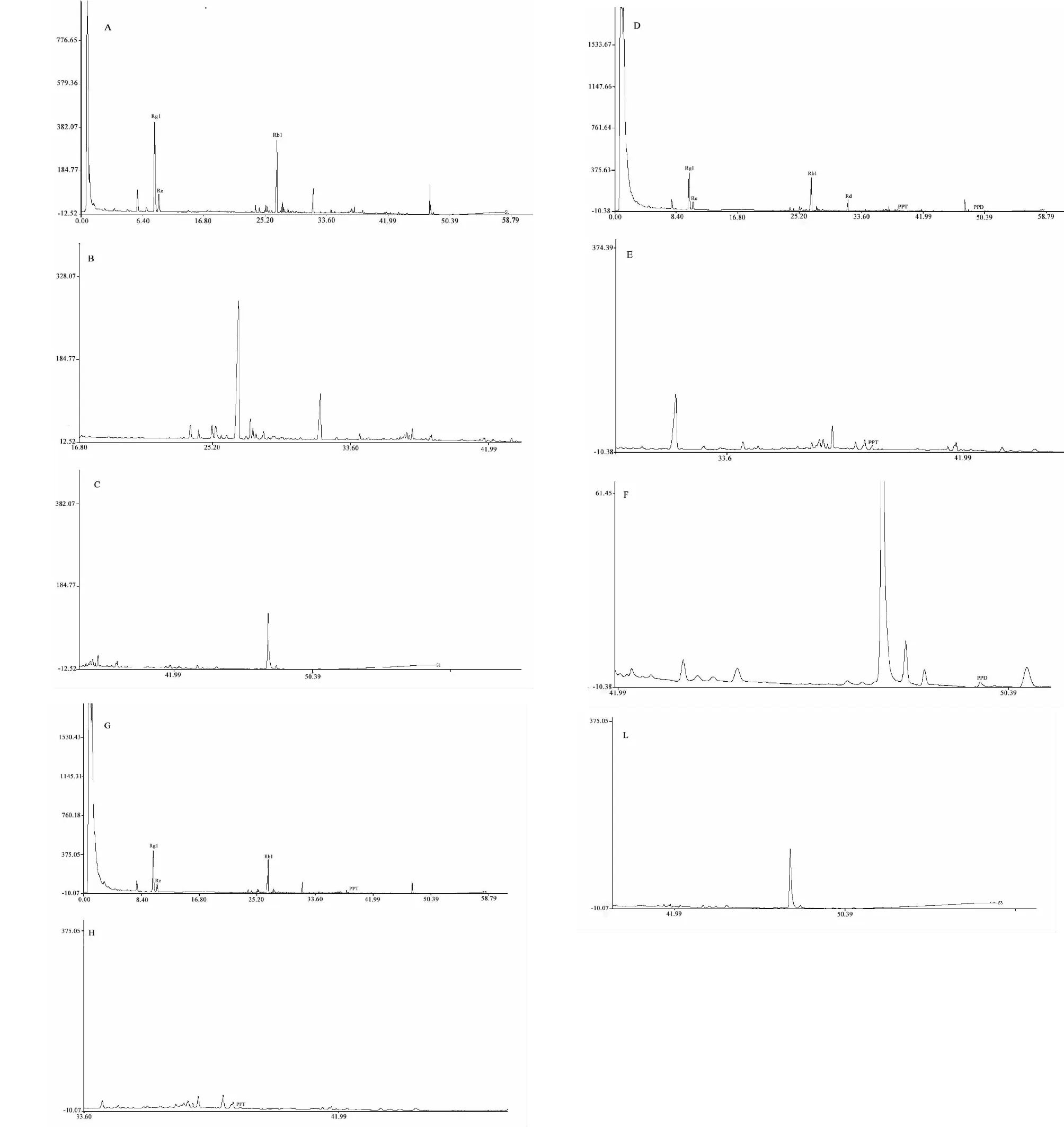
图6 三七水煎液(A、B、C)、三七+人源菌共培养液(D、E、F)、三七+鼠源菌共培养液 (G、H、L)中皂苷含量的UPLC色谱图Fig.6 Panax notoginseng decoction(A,B,C),Panax notoginseng + human bacteria co-culture solution(D,E,F), Panax notoginseng + rats bacteria co-culture solution (G,H,L) UPLC chromatogram of saponin content
。
值得说明的是,在本次研究中,我们发现原人参二醇PPD只在经人源肠道菌代谢后的产物中特征性地出现,在鼠源肠道菌中并无产生,这是否与菌群来源的种属差异有关,我们将作进一步研究。另外,三七水煎液在与肠道菌共温育的过程中,三七中的特征化合物如三七皂苷R1是否能被不同来源的肠道菌代谢及其可能的代谢产物的发现与鉴定,我们也将继续研究。
综上所述,我们以三七为主进行的体外中药代谢研究及其分析方法可以部分还原中药在口服途径中被肠道菌代谢的反应过程,可以通过“肠道菌群-宿主共代谢”途径探讨中药的生物学作用机制[10],也可以说明相当一部分中药的作用靶点可能是由人体共生微生物构成的微生态系统[20],还可以探讨动物种属差异对药理效应所产生的影响,为人类应用的临床研究与以动物为主的实验研究之间搭建起共性分析与特征性分析的桥梁,为三七在中医药精准医疗中的地位提供物质基础与研究思路。
