基于网络药理学的杜仲-山茱萸配伍治疗糖尿病的作用机制
2019-08-02韩立柱胡坤霞巨红叶唐志书
韩立柱,胡坤霞,巨红叶,段 玺,唐志书*,宋 逍*
1陕西中医药大学药学院;2陕西中医药大学附属医院,咸阳712046
杜仲-山茱萸配伍具有滋养肝肾,温补肾阳的功效,早在东汉医学家张仲景所著的《金匮要略》中已有记载。杜仲(EucommiaulmoidesOliv.),为杜仲科杜仲属植物。在《神农本草经》中被列为上品,有补益肝肾、强筋壮骨的功效。现代研究发现其所含化学成分有黄酮类、木脂素类、苯丙素类、环烯醚萜类、萜类等[1],具有增强体内物质代谢,分解体内胆固醇、脂肪,利尿清热等药理作用。山茱萸(CornusofficinalisSieb.et Zucc.),山茱萸科山茱萸属植物。果肉内含有生理活性较强的皂甙原糖、酒石酸、酚类、和维生素A、C等成分。其味酸涩,具有利尿、补肝肾等功效。主治血压高、腰膝酸痛、眩晕耳鸣、阳萎遗精等症。
糖尿病是一种内分泌代谢疾病,其发病率以前所未有的速度升高。基本病理特点为胰岛素分泌绝对或相对不足,或外周组织对胰岛素敏感性下降,引起以糖代谢紊乱为主,包括脂肪、蛋白质代谢紊乱的一种全身性疾病[2]。临床表现为典型的“三多一少”、疲乏无力。中医上糖尿病属“消渴”范畴,主要在肺、胃、肾的损伤,基本病机为阴津亏耗,燥热偏盛。消渴日久,热灼津亏血瘀,而致气阴两伤,阴阳俱虚,气血逆乱,脏腑器官受损而出现眩晕、耳聋、目盲、下肢坏疽、肾衰水肿、中风昏迷等兼症[3]。目前有关中药治疗糖尿病的相关研究越来越多,主要集中在单味药和单一作用机制等方面,传统中医药是基于人体的辨证施治和多味药材配伍治疗疾病。中药的药理作用较为复杂,具有多成分、多靶点的特征,是中药区别于西药的独特之处,中药成分的复杂性和药理作用的多重性使得难以对中药展开全面、系统的研究。网络药理学强调了将生物学网络与药物作用网络整合,从多成分、多靶点、多途径的角度阐明中药研究的基础理论,为中药现代化研究提供全新的思路,随着现代生物信息技术和基因工程的发展促进了中医药的现代化。本文以中药作用的多成分、多靶点、多通路为思路,利用中药系统药理学数据库、DisGeNET、DrugBank和KEGG等数据库,研究杜仲和山茱萸相配伍的有效成分治疗糖尿病的蛋白相互作用关系、生物过程和代谢通路等机制,为中药复方治疗疾病在网络药理学方面的科学研究提供参考。
1 材料与方法
1.1 有效成分和靶点的获得
在中药系统药理学数据库TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)中筛选杜仲和山茱萸的有效成分和相关靶点,筛选条件为OB(口服药物生物利用度)>30%;DL(类药性)>0.18[4]。
糖尿病的潜在靶点信息在DrugBank(https://www.drugbank.ca/)和DisGeNET(http://www.disgenet.org/web/DisGeNET/menu)数据库中设定物种为 “Homo sapiens”,将获得的靶点名称输入到UniProt数据库中得到靶点的基因名称(gene name)。筛选药物相关靶点和疾病潜在靶点的交集,得到可能存在作用的活性靶点。
1.2 通路和基因注释分析
利用RStudio软件中CludterProfiler程序包进行KEGG代谢通路分析和GO富集分析,并和DAVID数据库进行对比分析。将药物作用的活性靶点输入到STRING数据库中构建蛋白互作网络(PPI)分析。通过网络拓扑属性分析软件Cytoscape 3.7.0软件构建杜仲-山茱萸的“有效成分-活性靶点-代谢通路”网络。
2 结果与分析
2.1 有效成分的筛选
通过TCMSP数据库进行杜仲和山茱萸的数据挖掘,得到杜仲中含有66个化学成分,山茱萸中含有102个化学成分。根据OB>30%,DL>0.18筛选出杜仲中有效成分28个,山茱萸中有效成分20个。再根据DisGeNET和DrugBank数据库中糖尿病潜在的靶点和杜仲-山茱萸相关靶点的映射反推配伍后可能存在治疗作用的有效成分共30个,得到TCMSP编号、分子名称、OB值和DL值,结果见表1。

表1 杜仲和山茱萸中的有效成分Table 1 Active constituents of Eucommia ulmoides and Cornus officinalis
续表1(Continued Tab.1)

标识TCMSP ID分子名称Molecule Name口服生物利用度OB(%)类药性DLMOL0070593-(-hydroxymethyllenetanshiquinone32.160.41MOL009047(+)-Eudesmin33.290.62MOL002773β-Carotene37.180.58MOL000073Ent-epicatechin48.960.24MOL000443Erythraline49.180.55MOL009055Hirsutin-qt49.810.37MOL0090534-[(2S,3R)-5-[(E)-3-hydroxyprop-1-enyl]-7-methoxy-3-methylol-2,3-dihydrobenzofuran-2-yl]-2-methoxy-phenol50.760.39MOL009029Dehydrodiconiferyl alcohol 4,('-di-O-(-D-glucopyanoside-qt51.440.40MOL002058Pinosylvin57.200.62MOL009015(-)-Tabernemontanine58.670.61MOL004367Olivil62.230.41MOL009031Cinchonan-9-al,6'-methoxy-,(9R)68.220.40MOL009009(+)-Medioresinol87.190.62MOL006709AIDS21463492.430.55MOL009027Cyclopamine55.420.82MOL008457Tetrahydroalstonine32.420.81MOL000358β-Sitosterol36.910.75MOL001494Mandenol42.000.19MOL000449Stigmasterol43.830.76MOL0054812,6,10,14,18-pentamethylicosa-2,6,10,14,18-pentaene33.400.24MOL005503Cornudentanone39.660.33MOL005530Hydroxygenkwanin36.470.27MOL005531Telocinobufagin69.990.79MOL002879Diop43.590.39MOL000359Sitosterol36.910.75MOL001495Ethyl linolenate46.100.20
2.2 疾病和药物相关靶点的筛选
在DisGeNET、STITCH和DrugBank等数据库中设定物种为人类获取糖尿病的潜在靶点1 525个,并与杜仲-山茱萸有效成分的相关靶点通过Venny2.1.0映射,得到共有靶点20个,说明杜仲和山茱萸配伍后可能存在协同作用参与PPARG、PON1、PTGS2、NOS2等靶点的生物过程。将基因名称导入DAVID 6.8(https://david.ncifcrf.gov/home.jsp)构建KEGG代谢通路分析,筛选条件为P<0.05判断具有显著性,得到11条通路[5],结果见表2。

表2 杜仲-山茱萸治疗糖尿病的代谢通路与靶基因Table 2 Metabolic pathways and target genes in the treatment of diabetes mellitus by Eucommia ulmoides and Cornus officinalis
续表2(Continued Tab.2)
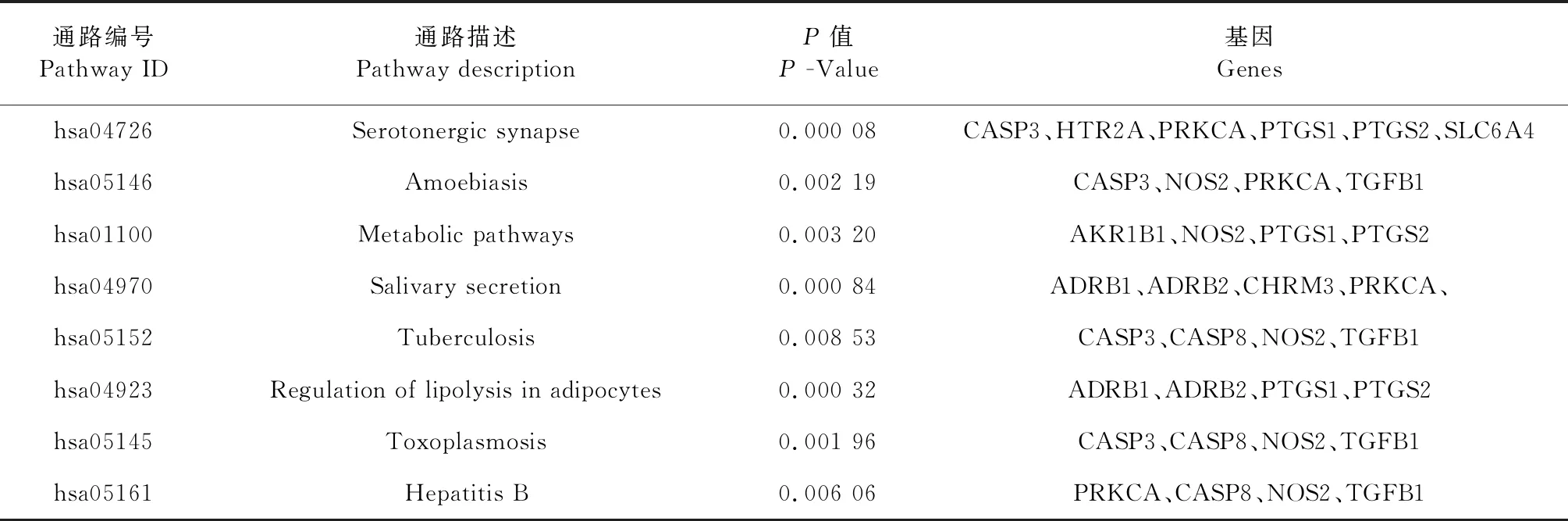
通路编号Pathway ID通路描述Pathway descriptionP值P -Value基因Geneshsa04726Serotonergic synapse0.000 08CASP3、HTR2A、PRKCA、PTGS1、PTGS2、SLC6A4hsa05146Amoebiasis0.002 19CASP3、NOS2、PRKCA、TGFB1hsa01100Metabolic pathways0.003 20AKR1B1、NOS2、PTGS1、PTGS2hsa04970Salivary secretion0.000 84ADRB1、ADRB2、CHRM3、PRKCA、hsa05152Tuberculosis0.008 53CASP3、CASP8、NOS2、TGFB1hsa04923Regulation of lipolysis in adipocytes0.000 32ADRB1、ADRB2、PTGS1、PTGS2hsa05145Toxoplasmosis0.001 96CASP3、CASP8、NOS2、TGFB1hsa05161Hepatitis B0.006 06PRKCA、CASP8、NOS2、TGFB1
利用Cytoscape 3.7.0软件将杜仲-山茱萸治疗糖尿病的有效成分、活性靶点和代谢通路绘制成“有效成分-活性靶点-代谢通路”网络(见图1)。 由结果知两药配伍后有效成分协同作用与多个靶点,提示可能有协同增效的作用。如杜仲中的山奈酚(kaempferol)、槲皮素(quercetin)与山茱萸中的四氢苦参碱(tetrahydroalstonine)都对活性靶点PPARG有调控作用;杜仲中表儿茶素(ent-Epicatechin)、刺桐灵碱(erythraline)和(-)-天门冬氨酸((-)-tabernemontanine)等成分与山茱萸中β-谷甾醇((-sitosterol)、羟基芜花素(hydroxygenkwanin)都参与PTGS1靶蛋白的调节,表明配伍使用较单味药的药效作用更强。
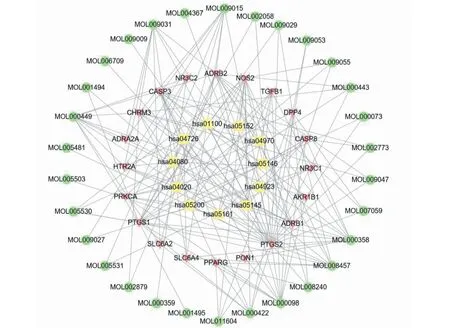
图1 杜仲-山茱萸“有效成分-活性靶点-代谢通路”网络Fig.1 "Active component-active target-metabolic pathway" network between Eucommia ulmoides and Cornus officinalis注:方块:通路;倒三角:潜在靶蛋白;圆球:化合物。Note:Diamond:pathway;Inverted triangle:protein target;Circle:compound.
其中表儿茶素、丁香素(syringetin)、山奈酚、槲皮素等可作用于多个糖尿病靶点,提示这些化学成分可能参与了杜仲-山茱萸配伍治疗糖尿病的过程。据研究报道其中山奈酚不仅能抑制铜离子诱导低密度脂蛋白(LDL)氧化成氧化修饰低密度脂蛋白(ox-LDL),而且还能降低THP-1性巨噬细胞表面CD 36蛋白的表达,阻止该细胞对ox-LDL的摄取,从而预防动脉粥样硬化的发生。研究表明,山奈酚具有与降糖药罗格列酮作激动剂的功效,但其不良反应远比罗格列酮弱,它能在不影响脂肪生成的情况下增加3T3-L1细胞对葡萄糖的摄取,预示着其有望成新一代的胰岛素增敏剂[6,7]。
表儿茶素为黄酮类物质具有诸多生理活性,如抗氧化、降脂降糖、预防心血管疾病、抗炎、保护神经、抑菌等作用。肥胖个体经常诱发糖尿病等慢性疾病的发生。BETTAIEB 等发现:对高果糖膳食的成年大鼠饮食中添加20 mg/kg 体重剂量的表儿茶素,可降低胰岛素信号级联(IR、IRK-1、AKT、ERK)的损伤,同时降低大鼠脂肪组织中的负调节因子(PKC、IKK、JNK 和 PTP1B)上调[8],表明表儿茶素是通过其氧化还原调节机制来减轻胰岛素抵抗。
2.3 蛋白互作网络分析
将筛选的基因名称输入到STRING数据库中,设定物种为“Homo sapiens”得到其蛋白-蛋白互作网络分析图,结果见图2。
由结果知PPARG和其他蛋白的互相关联程度最高,提示其可能参与的药理作用最明显。据研究报道,PPARG是过氧化物酶体增殖物激活受体γ;与过氧化物酶体增殖因子结合的核受体,如降血脂药物和脂肪酸。一旦被配体激活,核受体就会与DNA特异性的PPAR反应元件(PPRE)结合,并调节靶基因的转录,如酰基-辅酶A氧化酶(Acyl-CoA氧化酶)[9,10]。因此,它控制着脂肪酸的过氧化物酶体β氧化途径,是脂肪细胞分化和葡萄糖稳态的关键调节因子。
ADRB1属于β-1肾上腺素能受体;β-肾上腺素能受体通过G蛋白的作用介导儿茶酚胺诱导的腺苷酸环化酶的激活。这种受体结合肾上腺素和去甲肾上腺素的亲和力大致相等。RAS通过G(S)-α和cAMP介导的信号转导介导RAS的激活,属于G蛋白偶联受体1家族,肾上腺素能受体亚家族ADRB1亚家族[11]。
PTGS2是前列腺素G/H合成酶2;将花生四烯酸转化为前列腺素H2 (PGH2),这是前列腺素合成中的一个重要步骤。在生理条件下,如内皮细胞、肾脏和脑组织中,以及在肿瘤等病理条件下,构成性表达。PTGS2负责炎性前列腺素的产生。PTGS2的上调还与细胞粘附增加、表型改变、抗凋亡和肿瘤血管生成有关[12]。在癌细胞中,PTGS2是前列腺素E2 (PGE 2)产生的关键步骤,它在调节细胞运动、增殖和抗凋亡等方面起着重要作用,属于前列腺素G/H合酶家族[13]。

图2 杜仲-山茱萸靶蛋白PPI网络Fig.2 PPI network of target proteins from Eucommia ulmoides and Cornus officinalis
2.4 代谢通路分析
ClusterProfiler是基于R语言开发的Bioconductor软件包,可以对基因集合或基因cluster进行功能聚类的统计分析和可视化。先将基因名称转化为“ENTREZID”,选择OrgDb为“org.Hs.eg.db”;设定pvalueCutoff = 0.05进行KEGG通路富集分析,筛选排名前20的通路绘制气泡图(见图3)。
其中参与Serotonergic synapse 通路的基因有6个,5-羟色胺(5-HT)是一种单胺类神经递质,在学习记忆、情绪、睡眠、疼痛、运动功能和内分泌等生理功能以及情绪和认知异常等病理状态中发挥重要作用。5-HT一旦从突触前轴突终末释放出来,即与受体结合,根据其保守的结构和信号机制将受体分为7个亚家族。这些家族包括电离型5-HT3受体和G蛋白偶联的5-HT受体、5-HT1(GI/GO-偶联)、5-HT2(GQ-偶联)、5-HT4/6/7(GS-偶联)和5-HT5受体。预先定位的5-HT1B受体被认为是抑制过量5-HT释放的自身受体[14]。5-羟色胺的作用通过转运体介导的对神经元的再摄取而终止,导致单胺氧化酶分解代谢。
脂肪细胞脂解的调控(regulation of lipolysis in adipocytes)是脂肪组织中一种独特的功能,它是由三酰甘油(TAG)水解生成脂肪酸(FAs)和甘油,供其他器官作为能量底物。脂多糖处于严格的荷尔蒙控制之下。禁食期间,儿茶酚胺通过与GS偶联-肾上腺素能受体(AR)结合,激活腺苷酸环化酶(AC),增加cAMP,激活蛋白激酶A (PKA)。PKA磷酸化靶蛋白,如激素敏感脂肪酶(HSL)和Perilipin 1。plin磷酸化是TAG水解过程中的一个关键事件,包括脂肪甘油三酯脂肪酶(ATGL)、HSL和单甘酯脂肪酶(MGL)。在喂食过程中,胰岛素通过激活磷酸二酯酶-3B(PDE-3B),通过cAMP的降解抑制儿茶酚胺诱导的脂解[15]。由结果知杜仲-山茱萸通过多种基因参与多种通路协同作用于糖尿病。

图3 活性靶点KEGG代谢通路气泡图Fig.3 Bubbles of active target KEGG metabolic pathway
2.5 GO富集分析
基因本体(gene ontology,GO)是基因功能国际标准分类体系。它旨在建立一个适用于各种物种的,对基因和蛋白质功能进行限定和描述的,并能随着研究不断深入而更新的语言词汇标准。GO分为分子功能(molecular function)、生物过程(biological process)、和细胞组分(cellular component)三个部分。GO描述了基因产品(蛋白质或RNA)参与的生物过程,所处的细胞位置,发挥的分子功能三方面功能信息,并将概念粗细不同的功能概念组织成有向无环图(DAG)的结构。杜仲-山茱萸的活性靶蛋白的GO富集分析通过ClusterProfiler进行,生物过程、细胞组分和分子功能分析均设定PvalueCutoff = 0.05;QvalueCutoff = 0.01并绘制条形图(见图4)。
由GO富集分析结果知富集主要集中在生物过程上,共353条富集结果,其中血液循环、胰岛素抵抗和循环系统过程参与的基因数目最多。在细胞组分中有21条富集结果,其中基因参与最多的是膜筏,膜筏是不均匀的、高度动态的、富含甾醇和鞘脂的膜结构域,它分隔细胞过程;膜微区和膜区也参与较多的靶蛋白。在分子功能中有35条富集结果,其中G蛋白偶联胺受体占比重较大,它与胞外胺结合,通过激活相关的G蛋白来传递跨膜信号,促进GTP在异三聚体G蛋白复合物α亚基上的GDP交换。其次是肾上腺素能受体,它参与肾上腺素或去甲肾上腺素结合,通过激活相关异三聚体G蛋白复合物的α亚基,通过膜传递信号[16-18]。据研究表明,糖脂、蛋白质代谢、胰岛素抵抗等生物学过程与糖尿病的发生有着密切联系,持续性高糖高脂可增强机体氧化应激水平,破坏胰岛细胞,引起胰岛素抵抗,导致胰岛素分泌不足,从而形成糖尿病[19,20],而杜仲-山茱萸可以通过调节机体多种生物过程发挥治疗糖尿病的作用。
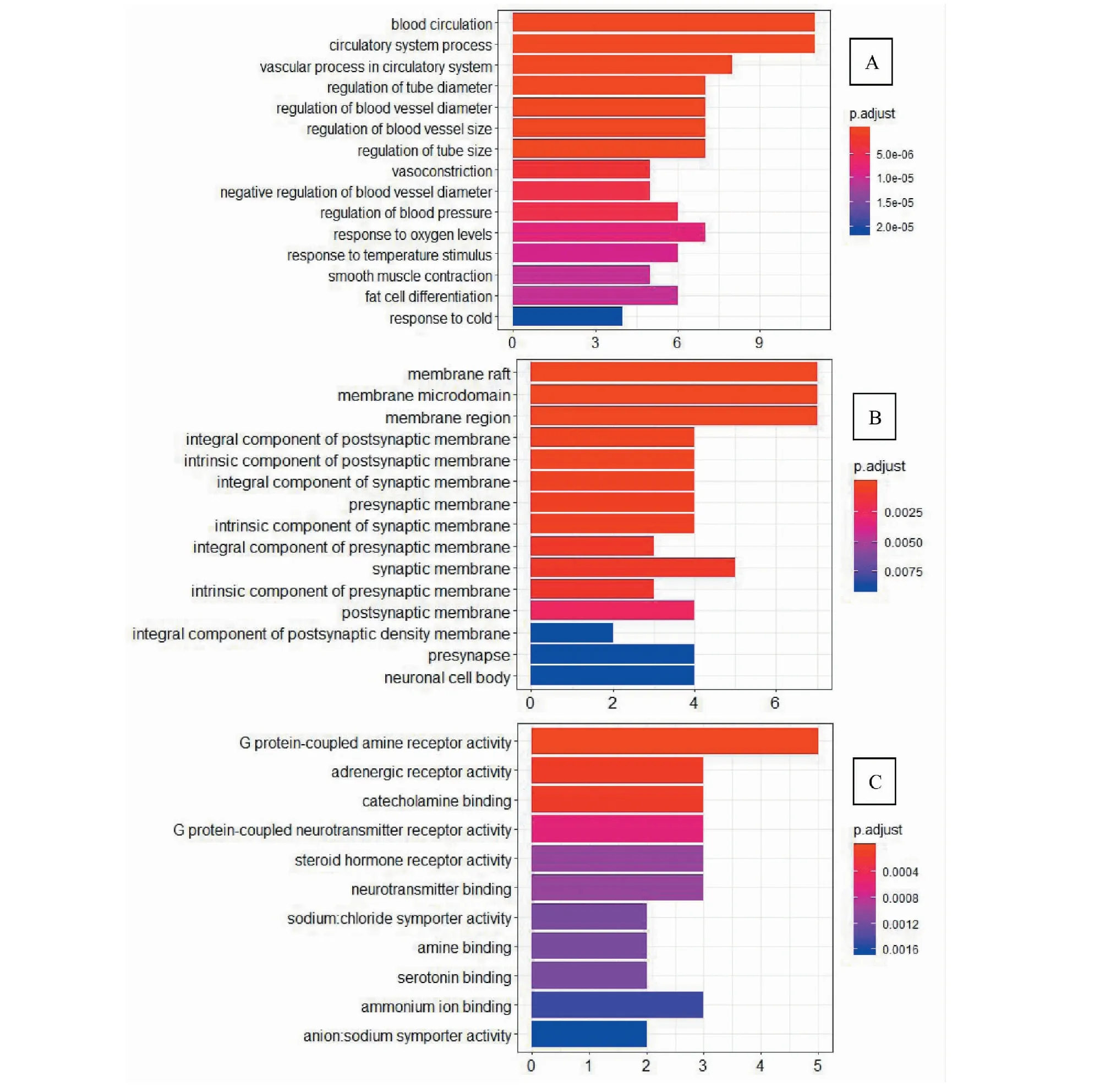
图4 杜仲-山茱萸治疗糖尿病活性靶点GO富集分析Fig.4 GO enrichment analysis of active targets of Eucommia ulmoides and Cornus officinalis for the treatment of diabetes mellitus注:A:生物过程;B:细胞组分;C:分子功能。Note:A:biological process;B:cellular component;C:molecular function.
3 结论
本研究利用网络药理学的技术和方法,探讨杜仲-山茱萸配伍治疗糖尿病的活性成分、活性靶点、作用通路和相关的药理作用。通过数据挖掘共找到杜仲和山茱萸的成分共168个,筛选后得到有效成分30个,存在作用的活性靶点有20个,代谢通路11条。体现了中药治疗疾病是多种成分作用于多种靶点,存在多维药理作用。研究表明山奈酚、表儿茶素和β-谷甾醇等成分具有诸多生理活性,如诱导低密度脂蛋白的氧化、影响糖分的摄取、降脂降糖、预防心血管疾病。通过蛋白互作网络分析,PPARG、PTGS2、ADRB1和NR3C1与其他蛋白存在较多的协同作用,Serotonergic synapse和Regulation of lipolysis in adipocytes等通路参与的基因数较多,提示杜仲-山茱萸在配伍发挥治疗作用的生物通路中较为重要。药物和疾病相关靶点及有效成分获取时应该注意数据的全面性和准确性,目前有多种数据库可以在线进行KEGG和GO富集分析,在分析时也应该考虑不同数据库分析结果之间的差异,因此本研究用DAVID、STRING和Bioconductor三种数据库进行对比分析获得了较为可靠的分析结果。本研究应用网络药理学的方法是对杜仲和山茱萸治疗糖尿病作用机制的预测,结果应谨慎处理,后续应进行实验验证确保预测结果的科学性、正确性和可靠性。中医药理论中多是用中药复方辨证施治,应对复方的组成和相关疾病进行总体的分析,研究复方配伍后对疾病的协同作用,本文以中药配伍综合分析其对糖尿病的药理作用,与中医药理论体系的研究方法相符合。
综上所述,本研究阐明了杜仲-山茱萸药对的活性成分、靶点、通路之间相互作用关系,发现其活性成分能通过多个靶点、多条生物通路发挥治疗糖尿病的作用,为进一步研究其多维药理作用机制提供依据,也为中药药对或复方的网络药理学研究提供参考。
