山杏叶乙酸乙酯提取物调控乳腺癌MCF7细胞增殖和凋亡的机制研究
2019-08-02单梅华董建新刘晓光马雅慧王金梅朱毓永
单梅华,董建新,刘晓光,马雅慧,王金梅,朱毓永,李 洁
河北民族师范学院生物与食品科学系,承德 067000
乳腺癌是危害人类健康的常见恶性肿瘤之一,其发病率位列女性癌症榜首,每年约52.2万人死于乳腺癌,且近十几年来居民发病率呈明显上升趋势[1,2]。目前乳腺癌的治疗包括手术治疗、内分泌治疗、放疗化疗以及分子靶向治疗[3]。尽管治疗乳腺癌的手段有了很大提高,但治疗方法仍会对人体造成较大的损伤,天然产物的治疗疗效显著且副作用小,在临床中逐渐得到广泛的应用。
山杏是蔷薇科杏属植物,其杏果具有良好的医疗保健作用,主治风寒肺病生津止渴、润肺化痰、清热解毒;山杏仁蛋白可抑制人结肠癌Caco-2细胞增殖,诱导其死亡[4],其蛋白酶水解物能够显著抑制人乳腺癌细胞的增殖[5];苦杏仁苷也有一定的抗癌活性[6]。据实验室前期研究发现,山杏叶中含有丰富的总三萜酸、桦木酸、齐墩果酸和熊果酸[7],提示其具有潜在的抗癌价值。本实验采用山杏叶乙酸乙酯提取物处理人乳腺癌细胞MCF7,观察其对该细胞的增殖、凋亡的影响,并通过对活性氧ROS和相关基因表达的检测来探讨其可能的机制,为进一步开发山杏叶的抗癌效果提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系
人乳腺癌细胞系MCF7购自北京嘉美臻元生物技术有限公司,由本实验室培养。
1.1.2 实验药物与试剂
山杏叶采自河北民族师范学院标本园,山杏叶乙酸乙酯提取物由本校生物资源开发实验室提取,并用DMSO配制为1 g/mL的储存液。胎牛血清(美国Gibco公司,批号:42F0266K); DMEM(美国Gibco公司,批号:8118387);胰蛋白酶(以色列BI公司,批号:0032018);青霉素-链霉素(以色列BI公司,批号:1831739);二甲基亚砜DMSO(碧云天,批号:1213C0343);CCK8试剂盒(碧云天,批号:C0042);活性氧检测试剂盒(碧云天,批号:S0033);细胞凋亡检测试剂盒(北京嘉美,批号:LHK601-100);第一链cDNA合成试剂盒(北京全式金,批号:7E281I8);GelRed核酸染料(Biotium,批号:18G00924);引物(上海生工);Bradford蛋白浓度测定试剂盒(碧云天,批号:P0006C);caspase3活性测定试剂盒(索莱宝,批号:BC3830)。
1.2 方法
1.2.1 细胞培养
完全培养基由含10%胎牛血清FBS+1%青霉素-链霉素的DMEM培养基组成,人乳腺癌细胞MCF7接种于完全培养基,置于37 ℃,5% CO2的培养箱中培养2~3天,待细胞密度为80%~90%时用胰酶进行传代消化培养。山杏叶乙酸乙酯提取物浸膏用DMSO配制为1 g/mL母液后,再用基础培养基分别稀释成0.125、0.5、2 mg/mL的浓度处理MCF7细胞,36 h后,收取细胞进行后续实验。
1.2.2 CCK8法检测山杏叶乙酸乙酯提取物对乳腺癌MCF7细胞的增殖影响
取对数期生长的MCF7细胞,约1×104/孔接种于96孔板,24 h贴壁后,对照组加入完全培养基,实验组分别加入含提取物浓度为0.125、0.25、0.5、1、2、4 mg/mL的培养基,每组设置6个复孔。培养36、48 h后,吸出培养基,加入含10% CCK8溶液的培养基,置于培养箱中继续孵育4 h,酶标仪检测各孔在450 nm波长处的吸光度,计算不同浓度下MCF7细胞的存活率以及36、48 h的细胞半数抑制浓度(50% inhibitory concentration,IC50)。
细胞存活率(%)=(OD实验组- OD空白组)/
(OD对照组- OD空白组)×100%
1.2.3 流式细胞仪技术检测山杏叶乙酸乙酯提取物对MCF7细胞凋亡的影响
按每孔3×105个细胞将MCF7细胞接种到六孔板中,培养过夜后加入提取物,设置为三组浓度(0、0.5、2 mg/mL),作用36 h后收集细胞。PBS洗涤一次,用Annexin V-FITC标记,避光孵育15 min。上机前5 min加入PI染色,取细胞悬液做流式检测。FITC激发波长为488 nm,发射波长为525 nm;PI激发波长为535 nm,发射波长为615 nm。实验重复三次。
1.2.4 乳腺癌MCF7细胞内活性氧ROS水平检测
在六孔板中加入每孔3×105个对数生长的MCF7细胞,培养24 h后,分别加入0、0.5、2 mg/mL提取物浓度的培养基培养36 h,之后利用荧光探针DCFH-DA进行活性氧ROS的检测。每孔加入1 mL稀释好的DCFH-DA,37 ℃细胞培养箱孵育20 min,基础培养基洗涤三次,倒置荧光显微镜下通过荧光强度来测定ROS水平。或将细胞消化下来,悬浮于终浓度为10 μmol/L的DCFH-DA溶液中,37 ℃细胞培养箱孵育20 min,洗涤三次。流式细胞仪检测ROS含量,激发波长为502 nm,发射波长为530 nm,并用FlowJo软件进行数据分析。实验重复三次。
1.2.5 RT-PCR检测CDK4、Cyclin D1、Cyclin E、Bax、Bcl-2的表达水平
实验分为对照组、山杏叶乙酸乙酯提取物处理组(0.125、0.5、2 mg/mL)。将MCF7按每孔1×105个细胞接种到24孔板中,提取物处理36 h后按照Trizol试剂盒方法裂解细胞提取总RNA,逆转录合成cDNA再加入相应的引物进行PCR扩增,扩增产物进行琼脂糖凝胶电泳,用Image J软件对电泳条带灰度分析。实验重复三次。内参为β-actin,目的基因为CDK4、Cyclin D1、Cyclin E、Bax、Bcl-2,引物序列见表1。

表1 引物序列和产物长度Table 1 Primer sequence and product length
1.2.6 caspase-3活性的检测
六孔板中每孔接种3×105个MCF7细胞,按0、0.125、0.5、2 mg/mL提取物浓度进行分组,培养24 h后,消化细胞用适量裂解液提取蛋白,并测定蛋白浓度。每组吸取25 μL样品置于96孔板中,根据试剂盒说明书进行操作,孵育6 h后用酶标仪检测OD405 nm的吸光度。利用公式计算caspase-3的相对活性: OD实验组/ OD对照组×100%。
1.2.7 统计学处理
应用SPSS 19.0软件进行统计学处理,显著性水准P<0.05。
2 结果
2.1 山杏叶乙酸乙酯提取物抑制MCF7细胞增殖
采用CCK8法检测不同浓度的山杏叶乙酸乙酯提取物处理36 h、48 h后,乳腺癌MCF7细胞的存活率变化。结果如表2所示, 0.125 mg/mL浓度处理组与对照组相比,抑制效果不明显,差异无统计学意义(P>0.05),而在浓度为0.25、0.5、1、2、4 mg/mL时,提取物对MCF7细胞有明显的抑制作用,细胞存活率随时间和浓度的增加而逐渐降低,差异具有显著统计学意义(P<0.05)。山杏叶乙酸乙酯提取物作用MCF7细胞36 h时,IC50为1.236 mg/mL,48 h的IC50为0.313 mg/mL。
2.2 山杏叶乙酸乙酯提取物诱导MCF7细胞凋亡的发生
流式细胞检测结果显示,浓度为0.5 mg/mL和2 mg/mL的山杏叶乙酸乙酯提取物作用36 h后,MCF7细胞早期凋亡和晚期凋亡的细胞平均所占比例为52.2%和58.6%, 较对照组的1.2%均有显著地提高(P<0.05),且具有一定的浓度依赖性(见图1)。
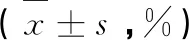
表2 山杏叶乙酸乙酯提取物对MCF7 细胞增殖的抑制作用Table 2 Inhibition effect of ethyl acetate extract of wild apricot leaves on the proliferation of MCF7
注:*P<0.05,与对照组比较;△P<0.05,与同组内36h比较。
Note:*P<0.05,compared with control;△P<0.05,compared with the 36h data in the same group.
2.3 山杏叶乙酸乙酯提取物诱导MCF7细胞内ROS的产生
用浓度为0.5 mg/mL和2 mg/mL的提取物处理MCF7细胞36 h后,利用DCFH-DA作为荧光探针来检测胞内活性氧水平的变化。图2荧光显微镜结果显示,实验组细胞中的ROS含量显著高于对照组,且随提取物浓度的增加而增加。同时,我们使用流式细胞仪检测技术检测了ROS变化,得到了同样的结论。这些都证明山杏叶乙酸乙酯提取物可以诱导MCF7细胞ROS水平的提升。
2.4 山杏叶乙酸乙酯提取物对MCF7细胞周期相关基因表达的影响
采用RT-PCR检测细胞周期相关基因CDK4、Cyclin E和Cyclin D1的表达。结果显示,与对照组相比,0.125、0.5、2 mg/mL提取物处理组均能显著下调MCF7细胞中CDK4、Cyclin E和Cyclin D1基因的表达(P<0.05),且有明显的浓度依赖性(见图3)。
2.5 山杏叶乙酸乙酯提取物调节MCF7细胞凋亡相关基因的表达
不同浓度山杏叶乙酸乙酯提取物(0、0.125、0.5、2 mg/mL)处理MCF7细胞36 h后,RT-PCR检测显示,与对照组相比,提取物的处理可以上调Bax的表达,下调Bcl-2的表达(P<0.05),且具有一定的浓度依赖性(见图4)。
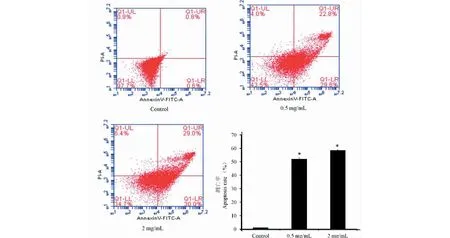
图1 山杏叶乙酸乙酯提取物对MCF7细胞凋亡的影响Fig.1 Effect of ethyl acetate extract of wild apricot leaves on the apoptosis of MCF7 cells

图2 山杏叶乙酸乙酯提取物对MCF7细胞产生ROS的影响Fig.2 Effect of ROS in MCF7 cells of ethyl acetate extract of wild apricot leaves
2.6 山杏叶乙酸乙酯提取物对caspase-3活性的影响
如图5所示,山杏叶乙酸乙酯提取物作用于MCF7细胞24 h后,实验组细胞的caspase-3活性与对照组相比明显增强(P<0.05)。药物浓度越高,活性也越强。提示山杏叶乙酸乙酯提取物可以通过调控caspase-3的活性来诱导细胞的凋亡。
3 结论
三萜酸化合物是分布广泛的天然产物,其抗肿瘤活性近年来受到越来越多的关注。研究报道,无论在体内还是体外,三萜酸化合物均能通过抑制肿瘤细胞的增殖和诱导凋亡来发挥其抗肿瘤的作用[8]。
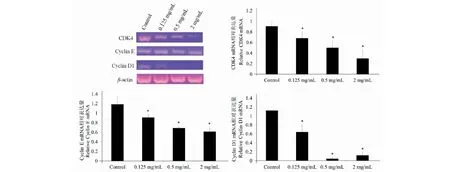
图3 山杏叶乙酸乙酯提取物对MCF7细胞中CDK4、Cyclin E和Cyclin D1 mRNA表达的影响Fig.3 Expression of CDK4,Cyclin E and Cyclin D1 mRNA of MCF7 cells in the effect of ethyl acetate extract of wild apricot leaves
图4 山杏叶乙酸乙酯提取物对MCF7细胞中Bcl-2和Bax mRNA表达的影响Fig.4 Expression of Bcl-2 and Bax mRNA of MCF7 cells in the effect of ethyl acetate extract of wild apricot leaves

图5 山杏叶乙酸乙酯提取物对MCF7 细胞中caspase-3活性的影响Fig.5 Relative activity of caspase-3 in the effect of ethyl acetate extract of wild apricot leaves
山杏叶中含有丰富的总三萜酸、桦木酸、齐墩果酸和熊果酸。本实验采用CCK8法证明,山杏叶乙酸乙酯提取物具有抑制乳腺癌细胞MCF7增殖、降低细胞存活率的作用,且呈现明显的浓度依赖性。
有文献表明,三萜酸化合物可以通过调控细胞周期进程来干涉肿瘤细胞的正常增殖,从而诱导细胞走向凋亡[9]。在细胞周期开始时,Cyclin D1首先被合成,并与CDK4组成CDK4/Cyclin D1复合体帮助细胞通过G1检验点,促使细胞分裂由G1期向S期过渡[10,11]。据报道,双氢青蒿素联合吉非替尼可以通过降低CyclinD1和CDK4的表达来造成周期阻滞[12]。本研究中,Cyclin D1、CDK4的表达量在药物处理后均有了明显下调,预示山杏叶乙酸乙酯提取物可能会抑制MCF7细胞由G1期向S期转换,从而使细胞停留在G1期。另外,Cyclin E在细胞周期G1的晚期可以与CDK2形成复合体来调控G1/S期的转化[13]。在我们的实验中,Cyclin E的表达随药物浓度的增大也发生了显著性降低。综上,我们可以推测山杏叶乙酸乙酯提取物可以通过调控G1/S期基因Cyclin D1、CDK4和Cyclin E的表达来抑制MCF7细胞周期的正常运行。
Bcl-2家族作为caspase的上游基因,在细胞凋亡过程中发挥着重要的调控作用。其中,Bcl-2是抗凋亡基因,Bax则是促凋亡基因。Bcl-2和Bax比例的调节起到了对细胞凋亡的指示作用[14,15]。研究表明,抑制Bcl-2和促进Bax可以诱导细胞的凋亡[16,17]。本实验结果显示,MCF7细胞在山杏叶乙酸乙酯提取物处理后,细胞凋亡率随药物浓度的增加而增加。并且,Bcl-2的mRNA水平明显降低,Bax则明显增高。caspase-3是Bcl-2和Bax的下游基因,也是细胞凋亡过程中最主要的效应者,抑制caspase-3的切割活化可有效抑制凋亡的发生[18]。本论文通过对caspase-3活性的检测,证实山杏叶乙酸乙酯提取物可以下调Bcl-2,上调Bax,从而增强caspase-3的活性,诱导凋亡的发生。
活性氧ROS是一种特殊的信号分子,作为第二信使参与细胞的多种信号传导过程。它在凋亡的线粒体途径中,通过改变线粒体的膜通透性、降低线粒体膜电位来促进Cyt-c的释放,引发caspase家族的酶活性级联反应,从而诱导细胞凋亡[19]。有研究表明,一种三萜类化合物3-O-acetyl-11-keto-β-boswellic acid可以通过提升肝癌细胞内的ROS水平,上调Bax表达和下调Bcl-2表达来诱导细胞凋亡的发生[20]。本文分别通过荧光显微镜和流式细胞仪检测了细胞ROS水平的变化,发现药物的刺激可以诱导细胞内ROS的产生,这说明山杏叶乙酸乙酯提取物可以通过提升ROS水平来促进细胞凋亡的发生。
综合以上实验结果,山杏叶提取物可以抑制细胞增殖,通过抑制CDK4、Cyclin E和Cyclin D1的表达而阻滞细胞周期的运行。另外,提取物通过下调Bcl-2、上调Bax,增强caspase-3活性,并促进活性氧ROS的释放来诱导细胞凋亡。
