甘氨酸甲酯重氮化反应的热危险性分级
2019-08-01郭云龙金满平
张 全,郭云龙,金满平
(1.中国石化青岛安全工程研究院,山东青岛 2660712.应急管理部化学品登记中心,山东青岛 266071)
0 前言
甘氨酸甲酯的重氮化反应广泛应用于菊酸或二氯菊酸的生产过程,该反应的产物重氮乙酸甲酯是重要的农药中间体。重氮乙酸甲酯属于重氮类化合物,一般重氮化合物由于氮-氮双键的存在分子结构不稳定,在干燥的固体状态下热力学性质很不稳定,碰撞、摩擦都会引发分解,导致燃烧或爆炸。
目前,重氮化合物的物理危险性检测与鉴定技术以及相应的储存运输方法已有了较为成熟的规范,国内外学者也对重氮化合物合成过程中的热危险性进行了大量的研究[1-5]。近年来,针对重氮化反应安全性的研究主要集中在优化、开发条件更加温和的反应工艺,寻找适合的催化剂等方向。由于高能基团氮-氮双键的存在,重氮化反应危险度高的问题很难通过改变工艺条件、反应容器或使用催化剂等手段解决。
2007年11月27日江苏联化科技有限公司重氮盐生产过程中反应釜发生爆炸,事故造成8人死亡,5人受伤,事故车间厂房全部倒塌,主要生产设备被炸毁。事故的直接原因是重氮化反应釜内重氮盐在保温阶段,操作工未将蒸气进气阀门关闭到位,造成部分蒸气持续进入反应釜夹套,使反应釜内重氮盐的温度不断上升,引起剧烈分解,最终导致爆炸。
基于上述原因,对重氮化反应热危险性进行分级研究并采取相应措施对保障生产安全、保护人身财产安全尤为重要。Francis Stoessel和Fischer U等人在前人研究及自身多年工作的基础上,总结出了适用较为广泛的反应热风险分析、测试、分级评价方法,并对间歇、半间歇、连续反应器的热安全提出了优化设计方法[6-8]。国内相关工作人员依照此方法对许多化工反应的安全性进行了评估。陈网桦[9-12]等对苯、甲苯、一硝基甲苯、二硝基甲苯等物质的硝化反应进行了评价,并对反应条件进行了优化。崔富陞[13]等对过氧化苯甲酸叔丁酯的合成反应在不同条件下的转化率和危险性进行了分析。程春生[14,15]等对烯草酮和氟吗啉等农药合成工艺的危险性及动力学进行了研究。周诚[16]等对1,1-二氨基-2,2-二硝基乙烯(FOX-7)合成过程中的硝化反应的危险性进行了研究。王新颖[17]等运用密度泛函理论,通过理论计算研究了苯胺重氮化-席曼反应的热危险性,计算结果与测试结果相吻合。国内在重氮化反应危险性方面的研究鲜见报道。本文采用加速量热测试和实验室全自动反应量热仪对甘氨酸甲酯重氮化反应热危险性进行了研究。
1 反应方法评估
1.1 风险矩阵评估法(方法1)
在评估一个事务的危险性时通常会考虑危险发生造成损失的严重程度和危险发生的可能性两个因素[7,18-19]。危险度的定义:危险度=危险严重度×危险可能性。
化工反应评估中,参考美国军用标准(MIL-STD-882)提供的定性分级方法,对特征参数进行定量分析,分别对危险的严重程度和危险发生的可能性进行等级划分,通过可能性等级和严重度等级的组合进行风险的矩阵评估。
国外的专家学者对危险严重度和可能性的划分标准不尽相同。本文采用的评估标准如表1和表2所示。
1.2 失控过程温度参数评估法(方法2)
温度参数评估法是一种侧重于评估工艺热安全和设备极限的评估方法,需要用到4个温度参数:工艺操作温度Tp;冷却失效发生后,反应体系可能达到的最高温度MTSR;技术最高温度MTT(开放体系中,技术最高温度为反应体系溶剂或混合物料的沸点;密闭体系中,技术最高温度为反应容器最大允许压力时所对应的温度);反应混合体系到达最大反应速率的时间为24 h对应的温度TD24(即在此温度下,反应混合体系形成爆炸需要24 h)。
通过对上述4个温度的高低进行排列,可将反应的危险程度分为5个等级,分级标准如表3所示。

表1 严重度和可能性的分级
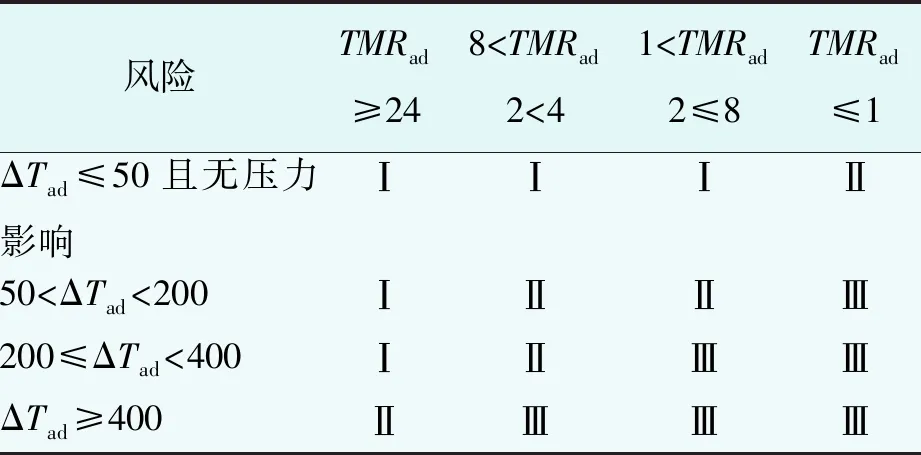
表2 反应热失控风险评估矩阵

表3 反应热失控风险等级
上述5个危险度评级中,1级和2级反应的危险程度较低,配置自动控制系统、报警和联锁系统等常规安全装置即可。3级属于中等危险工艺,需要在上述基础上增设紧急切断、紧急终止反应、紧急冷却降温等控制设施,设置相应的安全仪表。4级和5级反应的危险程度较高,应先开展工艺优化或改变工艺方法来降低风险,除了装备上述安全措施,还应设置防爆墙、超压泄爆,实现全面自控。
2 实验
2.1 反应原理
甘氨酸甲酯重氮化反应方程式为:
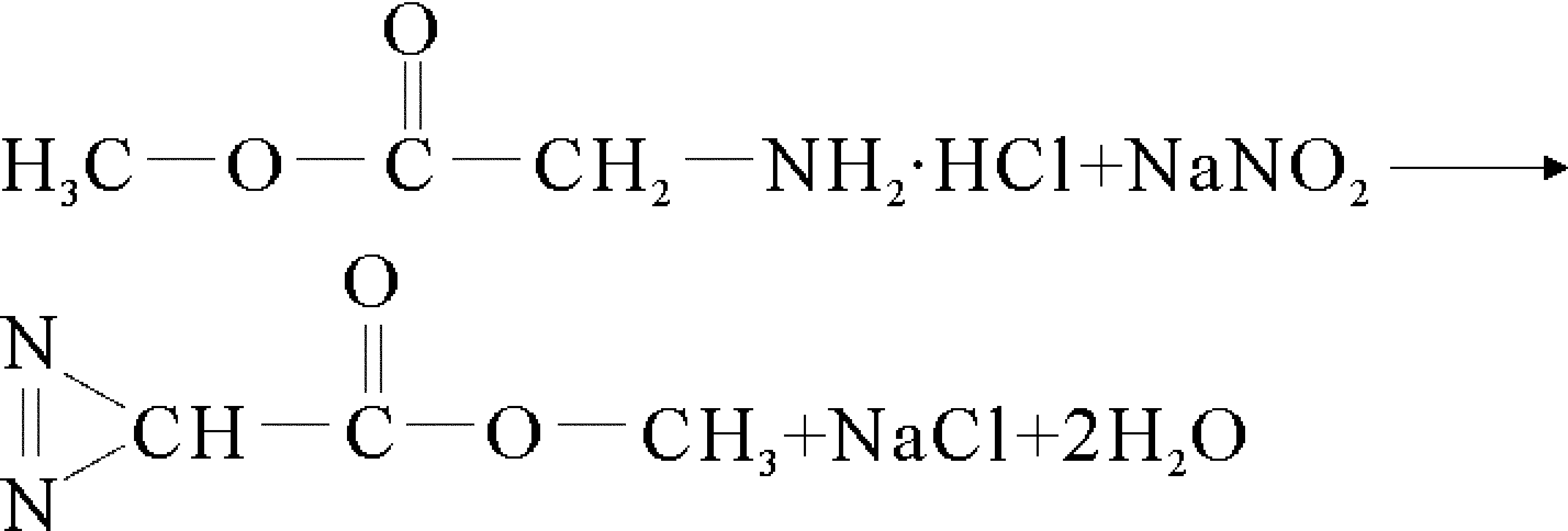
2.2 试剂与仪器
甘氨酸甲酯盐酸盐,自制;亚硝酸钠为分析纯;实验用水为去离子水。
浙江仰仪科技自动反应量热仪(RC HP-1000A),配备1L玻璃中压反应釜、自动加料装置和低温循环器。反应量热仪可通过对比夹套内硅油流经进出口温度的变化情况和反应釜中样品温度的变化计算反应的吸放热。
英国HEL集团绝热加速量热仪(ARC),在传统的被动绝热系统的基础上,另配有主动绝热系统。通过外部输入能量的方式弥补热传导或热辐射过程损失的热量,使样品及量热容器的内能达到动态平衡从而保证物料在测量周期内温度的恒定。
2.3 实验过程
2.3.1反应量热实验
依次向反应釜中投入甘氨酸甲酯盐酸盐溶液水溶液、醋酸-醋酸钠pH缓冲液和1,2-二氯乙烷。利用低温循环器将反应釜的温度降低至10 ℃,再将事先配制好的亚硝酸钠水溶液滴加入反应釜,滴加过程约2 h,滴加完成后保持反应釜温度稳定并静置一段时间等待物料完全反应。此时下部油层为重氮乙酸甲酯溶液,上部水层为反应废水。将料液倒入分液漏斗,静置30 min后分层,收集下层料液用于加速量热实验。
2.3.2加速量热实验
实验使用不锈钢量热球,称取收集的重氮乙酸甲酯溶液质量1.363 5 g,实验从35 ℃开始按照“加热-等待-搜寻”模式升温并检测样品放热,升温步长5 ℃,放热检测限为0.02 K/min,最高程序温度设置为350 ℃。
3 结果与分析
3.1 反应量热结果与分析
按照2.3.2中所述的步骤进行实验,反应量热仪测定甘氨酸甲酯重氮化反应放热速率曲线如图3所示。实验前期进行预热、校准程序,于135 min时开始滴加亚硝酸钠。反应初期亚硝酸钠滴加进反应釜放出大量的热,放热量随着滴加过程逐渐增加,经推测这一现象是由溶液中反应物浓度升高加快反应速率引起的,在此期间转化率并未严格按照放热速率的变化而变化,这与量热传导的滞后性有关,放热速率在149 min时升至最大值11.9 W;之后的几分钟内,放热速率迅速下降至5~6 W并保持约70 min,该时间段内放热速率和转化率较为平稳,反应状态较为稳定;实验进行至245 min时放热速率迅速下降,这是甘氨酸甲酯被消耗殆尽,浓度降低引起的。
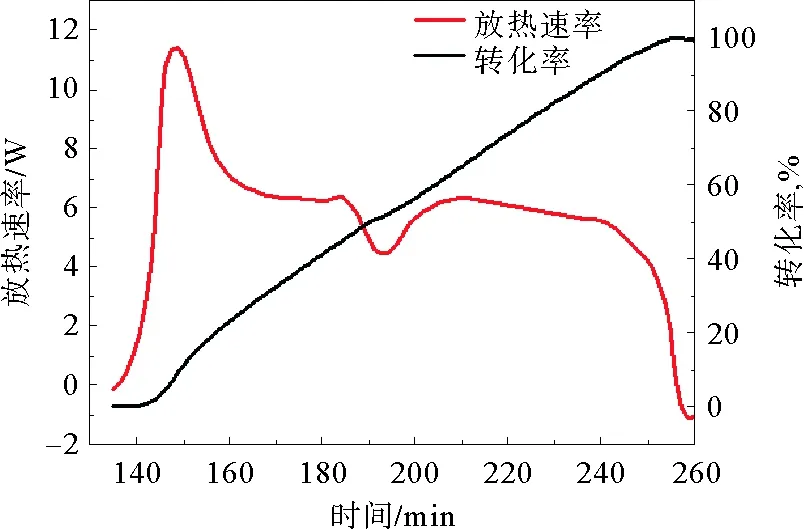
图1 转化率—放热曲线
累积度是反应热安全评估中的重要参数,累积度的高低直接决定了反应失控时放热量的多少。通过进一步计算得到物料的累积情况,某时刻总反应热中未释放部分所占的百分数为:
(1)
反应累积度结果如图2曲线所示。依照累积度的变化趋势可分为4个阶段,亚硝酸钠加入初期累积度随时间的推移迅速上升至11.9%,这一现象与放热速率的升高相吻合,证明了浓度增加推高反应速率的猜想。145 min时,累积度迅速下降至3.5%并在该状态保持一段时间,约190 min时迅速上升至6.5%~8.8%,放热速率的波动与累积度的变化时间相吻合,说明在这一阶段反应机理发生了变化,甘氨酸甲酯随着反应的进行逐渐被消耗,难以维持之前的反应状态,需要更高浓度的亚硝酸钠才能维持反应的进行,因此物料的累积度较前一阶段有了明显的升高。在反应后期随着反应釜中甘氨酸甲酯被消耗殆尽,物料累积度逐渐下降至0。整个反应周期中物料累积度的最高值11.9%出现在反应前期。
实验还测量出了反应体系的比热容(Cp)为1.3 J/(g·k)、总放热量(Q)为37.8 kJ、最大累积度为11.9%、最大放热功率为11.8 W。通过这些数据进一步计算出了反应的绝热温升ΔTad和反应能够达到的最高温度(MTSR)。绝热温升是指在绝热条件下,反应放出的热全部用于加热物料所能到达的最高温度。绝热温升ΔTad的计算公式为:
(2)
实验数据带入式(2)计算得本反应的绝热温升为67.7 K。

图2 转化率—累积度曲线
MTSR是指目标反应失控后,未释放累积的热量使反应体系在绝热条件下能够达到的最高温度。MTSR与反应失控时物料的累积程度有关,取累积度最大的点进行计算。体系能够达到的最高温度MTSR的计算公式为:
MTSR=Tp+Xac·ΔTad
(3)
在本反应中,累积度(Xac)在145 min时达到最大,最大值为11.9%。带入式(3)计算MTSR为18.0 ℃
3.2 加速量热结果与分析
图3、图4为重氮乙酸甲酯溶液的加速量热测试结果。在经历了多次“加热—等待—搜索”过程后,重氮乙酸甲酯在71.7 ℃时出现放热。放热初期,放热速率较为缓慢,升温速率与温度成一次函数关系,在此范围内热分解温升的变化趋势符合零级反应的特点;随着温度进一步上升到110 ℃时,升温速率加快,分解反应机理发生变化,在151 ℃时体系的升温速率达到最大(0.48 ℃/min),随后升温速率逐渐降低,这与重氮乙酸甲酯浓度减小有关,温度在升至178.6 ℃时放热结束,观测到温度升高106.9 ℃。
由于测量方法的限制,重氮乙酸甲酯分解放出的热量中的一部分用来加热了量热容器。为了修正量热容器温升引起的测量结果的偏差,引入了热惰性因子φ。热惰性因子φ的计算公式如下:
(4)

图3 温度—时间曲线

图4 升温速率—温度曲线
绝热温升观测值ΔTad,o与真实值ΔTad′时间的关系为:
ΔTad′=φΔTad,o
(5)
最大温升速率观测值TMRo与真实值TMR之间的关系为:
TMR=φTMRo
(6)
重氮乙酸甲酯加速量热实验中,热惰性因子φ为3.91,经修正后的绝热温升为418.0 ℃。说明物料分解产生的热量只有约1/4用于自身的温升,其他大部分剩余的能量用于加热量热容器,这是因为实验选用了不锈钢材质的量热球,同时重氮乙酸甲酯的潜热较高,为避免放热量超过量程引起安全事故,称取了较少的反应物质,二者共同决定了热惰性因子φ值的大小。在实验过程中,为减小容器温升对测量结果的影响,尽量选择质量较轻的容器,在保证安全的前提下适量增加测试物质的质量,使φ值尽可能趋近于1。
经φ值修正,工艺温度下最大温升速率TMR>24,到达最大温升速率为24 h的温度(TD24)为55.1 ℃。
甘氨酸甲酯的重氮化反应在常压体系中进行,采用二氯乙烷作为溶剂。该体系的技术最高温度MTT为83.5 ℃。
3.3 反应评级
根据风险矩阵评估法,甘氨酸甲酯重氮化反应放热量较大,失控的严重度等级为2级;由于采用了较低的工艺温度,从移热失效到出现事故的周期较长,发生事故的可能性低,可能性等级为1级。
失控过程温度参数评估法的评估结果显示,甘氨酸甲酯重氮化反应的风险矩阵评估等级为1级(表4)。

表4 风险矩阵评估结果
通过对工艺温度Tp,失控体系能达到的最高温度MTSR,到达最大温升速率为24 h的温度TD24,工艺最高温度MTT这4个温度参数进行排序,该重氮化反应危险度等级为2级(表5)。失控条件下体系温度不会引起二次反应,也达不到溶剂的沸点,反应较为安全。需要注意的是反应结束后物料需及时移出,热累积条件下储存时间过长仍存在触发二次的可能性。

表5 反应失控温度参数评估结果
4 结论
重氮化反应是15种首批被国家列入重点监管危险化工工艺的反应类型之一。运用风险矩阵评估方法和失控过程温度参数评估法,对甘氨酸甲酯的重氮化反应进行热安全评估,评估结果如下。
a)甘氨酸甲酯重氮化反应的放热量较大,重氮物潜在的分解放热大,具有一定危险性。经过工艺优化,降低工艺温度,采用半间歇的加料方式有效降低了反应的危险程度,两种方法评估均认为该反应工艺较为安全。
b)两种评估方法的侧重点有所不同。风险矩阵评估法注重目标反应的风险、本质安全,失控过程温度参数评估法则是对失控条件下反应工艺的危险性进行评估。在具体工艺评估过程中,二者联用能够提高评估的准确性与可信度。
c)风险矩阵评估法和失控过程温度参数评估法具有适用范围广,评估流程较为简单等优势,在工艺研发阶段能够提供重要的风险、危险性、安全性信息。上述两种方法只能评价反应热安全,不能对装置腐蚀、环境安全等方面进行评价,现场生产过程涉及物料、设备、施工、作业环境等多方面因素的影响,需配合HAZOP分析、安全评价、环境评价等多项评估才能保证化工过程的安全性。
