6mA在真核生物中的研究进展
2019-08-01陈映宏
陈映宏 刘 超
中国科学院动物研究所干细胞与生殖生物学国家重点实验室,北京 100101
DNA甲基化是被研究得最多的表观遗传修饰之一,组成DNA的4种碱基均可发生甲基化修饰。哺乳动物中胞嘧啶甲基化主要发生在一些基因5'区域的CpG岛上,由S-腺苷甲硫氨酸提供甲基基团,由DNA甲基转移酶(DNA methyltransferases, DNMTs)催化,在胞嘧啶第5位碳原子上加上一个甲基基团,形成 5-甲基胞嘧啶(5mC)[1-2]。DNMT1、DNMT3A/B和DNMT3L负责生成和维持5mC:DNMT1以半甲基化的DNA为模板维持DNA全甲基化状态;DNMT3A/B和DNMT3L作为从头甲基化酶可以催化DNA发生从头甲基化[3-4]。5mC机制是研究得最成熟和理解得最透彻的表观遗传修饰之一,在哺乳动物基因组中,大约60%~80%的CpG二核苷酸的胞嘧啶被甲基化[2,5-6]。5mC在基因的表达调控、染色质的结构变化、基因印迹、X染色体失活和基因组稳定性等生命过程中起着极为重要的作用[7]。近期发现的5mC通过TET家族蛋白氧化形成的5-羟甲基胞嘧啶(5-hydroxymethylcytosine,5hmC)及其进一步氧化产生的代谢衍生物5-甲酰基胞嘧啶(5-formylcytosine, 5fC)和5-羧基胞嘧啶(5-carboxylcytosine, 5caC)也参与众多的生命过程[8-12]。
6mA于1968年在细菌中被鉴定[13]出来,是原核生物中最普遍的DNA修饰。早期的研究发现6mA存在于原核生物中参与调节DNA复制的起始:以大肠杆菌为例,大肠杆菌复制起始位点oriC包含11个GATC/CTAG重复序列,腺嘌呤被DNA腺嘌呤甲基转移酶(DNA adenine methyltransferase, Dam)催化形成6mA,起始DNA的复制。复制后半甲基化oriC位点无法再次起始复制,直到Dam将oriC位点恢复成全甲基化状态,进而起始下一轮DNA复制[14-15]。6mA参与碱基错配修复:在细菌DAN复制中存在碱基错配,例如A-C错配,6mA允许DNA错配识别机制(MutHLS mismatch repair complex)区分模板链和新合成的子链,然后碱基错配修复系统以甲基化的母链为模板去替换未甲基化子链上的错配碱基[16]。由Dam介导的对于基因表达调控序列中GATC基序的腺嘌呤的不同甲基化修饰状态均参与基因的表达调控,如位于大肠杆菌agn43基因上游的操纵子的全甲基化GATC基序可以调控该结构基因的表达,位于大肠杆菌dnaA基因启动子的全甲基化GATC基序可以调控该基因的表达,位于IS10转座子的启动子区的半甲基化GATC基序有利于IS10转座子表达转座酶,位于pap基因上游激活序列(upstream activating sequence, UAS)的全甲基化或未甲基化GATC基序可以调控该基因处于不同状态[17]。在细菌和古生菌中,6mA还作为限制性修饰(restriction-modification systems)系统(Types I、II、III)的一部分参与防止噬菌体和质粒等外源DNA的入侵。具体而言,宿主细胞DNA中存在的6mA可以阻止DNA甲基化敏感的限制性内切酶对其基因组的消化。相比之下,外源的非6mA甲基化DNA在进入宿主细胞时会被限制性内切酶降解。此外6mA在调节细菌类核分离、细菌毒素的分泌、细菌接合、细菌细胞周期等多种生命活动过程中扮演了重要的角色[18-20]。
1 6mA的含量与分布
在过去的几十年中,6mA逐渐被报道存在于多种低等[21]和高等真核生物[4]中。通常,原核生物中6mA含量(6mA/dA)高于真核生物。
低等真核生物如衣藻(Chlamydomonas reinhardi)[22]、团藻(Stylonichiamytilius)[23]、双小核草履虫(Paramecium Aurelia)[24]、梨状四膜虫(Tetrahymena pyriformis)[25]、 嗜热四膜虫(Tetrahymena thermophila)[26]等绿藻类和原生动物的基因组都有6mA存在。以嗜热四膜虫等具纤毛原生动物为例,其显著特征是在同一细胞内存在一大一小两种不同的细胞核:二倍体生殖核和多倍体营养核。6mA仅在营养核中被发现,而生殖核中未检测到6mA存在;6mA主要分布于ApT回文序列中,6mA含量为0.8%,还发现6mA存在于相邻两个核小体之间的连接DNA中[27-29]。由于研究技术的限制,6mA在真核生物基因组中的精确含量和分布模式一直鲜有报道。直到2015年Fu等使用特异性抗体与限制性内切酶结合高通量测序技术,即6mA-IP-seq(6mA-immunoprecipitation sequencing)、6mACLIP-exo(6mAchromatin immunoprecipitation followed by exonuclease digestion)、6mA-RE-seq(restriction enzyme-based 6mA sequencing),发现衣藻84%的基因中存在6mA,并且他们发现6mA主要位于转录起始位点(transcription start site, TSS)周围的ApT回文序列中,6mA主要位于TSS位点并在TSS位点上下游呈现双峰分布,这种分布模式与基因的转录激活相关[30]。这些结论与先前在嗜热四膜虫的研究中得出的结论具有相似性[28]
在真菌界中也发现了6mA的存在。1986年Rogers等采用高效液相色谱法分析产黄青霉菌(Penicillium chrysogenum)的碱基成分,发现产黄青霉菌基因组中存在6mA,但不存在5mC[31]。2017年Mondo等采用单分子实时测序技术(single-molecule real-time sequencing,SMRT-seq)对16种不同真菌的基因组进行单分子长读长测序,从单碱基分辨率水平上分析全基因组范围内6mA的含量与分布模式,发现在双核菌亚界[子囊菌门(Ascomycota)和担子菌门(Basidiomycota)]中6mA含量较低,为0.048%~0.210%,而在早期分化系真菌基因组中6mA含量高达2.8%。同时该研究发现在早期分化系真菌基因组中,几乎所有的6mA都对称分布于ApT回文序列中,这与嗜热四膜虫和衣藻中的发现类似。其中80.0%~99.6%的6mA密集地分布在进化保守基因与活跃表达基因的TSS位点周围并形成甲基化腺嘌呤簇(methylated adenine clusters, MACs)。对比分析发现6mA与5mC的分布呈现负相关关系,6mA主要富集于TSS位点,5mC更多的分布于重复元件(repetitive elements, REs)[32]。
对于高等真核生物而言,也早已有证据表明在蚊子[33]和水蜡虫[34-35]中存在6mA。之前对于秀丽隐杆线虫DNA甲基化的研究中,由于有关5mC存在的实验缺乏可重复性[36]以及未检测到胞嘧啶DNA甲基转移酶的线虫同源物,因此秀丽隐杆线虫中可能不存在DNA甲基化[37]。Greer和Shi等人使用SMRT-seq和超高效液相色谱—三重四极杆串联质谱技 术(ultra-high performance liquid chromatographytriplequadrupole mass spectrometry, UHPLC-MS/MS)等多种方法,发现秀丽隐杆线虫基因组DNA中比较均匀地分布着6mA,未发现明显的富集区域,6mA的含量在0.01%~0.40%之间,分析发现6mA显著定位在AGAA和GAGG基序[38]。
前期研究发现果蝇基因组中5mC的含量极低[39]。Zhang等用6mA特异抗体和斑点印迹实验在果蝇胚胎发育的早期阶段发现了强烈的6mA信号。随后他们使用UHPLC-MRM-MS/MS检测果蝇胚胎发育不同阶段的6mA含量变化,发现在0.75hr阶段DNA中6mA的含量达到峰值为0.07%,到4~16hr阶段DNA中6mA的含量达到极低值为0.001%[40]。
早在1983年就有间接的证据表明6mA可能存在于哺乳动物中[34,41-42]。2006年Ratel等检测小鼠多种组织发现小鼠中几乎不存在6mA修饰[43]。但在2016年Wu等利用SMRT-ChIP研究哺乳动物小鼠胚胎干细胞组蛋白变体H2A.X的沉积区域[44]时发现了小鼠胚胎干细胞基因组中存在6mA,并且6mA主要位于组蛋白变体H2A.X的沉积区域的基因间区,存在于多种基序中[45]。2017年Schiffers等利用UHPLC-MS检测了目前报道的多种具有表观遗传相关性的DNA甲基化修饰,高灵敏度的质谱分析表明6mA极有可能不存在于小鼠基因组中[46]。对斑马鱼和猪基因组中的6mA的研究表明,两者卵细胞基因组中的6mA含量显著高于精子基因组中的6mA,两者早期胚胎发育过程中6mA的含量能够积累到较高水平0.10%~0.17%,当胚胎发育到囊胚期的时候6mA的含量下降到极低水平0.006%~0.050%,这说明6mA在脊椎动物胚胎发育过程中是一种动态的表观遗传修饰。随后对6mA在斑马鱼基因组中的分布进行研究发现6mA在斑马鱼基因组中普遍存在,富集于外显子和基因间区,并且80%左右的6mA分布于重复元件,尤其分布在简单重复序列中[47]。2016年Koziol等报道6mA以非常低的水平(0.00009%)存在于非洲爪蟾中,并且在转录起始位点缺失[48]。
2018年Xiao等利用“华夏一号”的测序数据[49],分析鉴定出6mA广泛存在于人类基因组中,6mA总含量约为0.051%,其中X染色体(0.023%)和Y染色体 (0.024%)的含量最低,线粒体(0.184%)中含量最高,6mA富集于外显子并与基因的激活表达相关,富集基序为[G/C]AGG[C/T][50]。Xie等应用UHPLC-MS/MS等技术发现恶性胶质瘤干细胞中6mA的水平相比于正常的人类星形胶质细胞升高了100多倍,6mA富集于基因间区并与H3K9me3和H3K27me3共定位在异染色质区域[51]。
在高等植物中也发现了6mA的存在。Vanyushin等在1988年报道了6mA存在于黄化小麦幼苗的线粒体DNA中[52]。2018年Zhou等采用质谱,6mA-IP-seq和SMRT-seq等技术发现在水稻基因组中6mA含量达0.2%,6mA主要分布于水稻基因组约20%的基因中和14%的转座子元件并富集在GAGG基序,并且6mA的分布与基因体区域中CG位点的5mC和转座子的CHH位点的5mC密切相关[53]。
在2002年Ashapkin等利用限制性内切酶消化的方法发现6mA存在于拟南芥Drm2基因的一些GATC基序中[54],但他们并未阐明6mA在全基因组范围的分布特征。随后在2018年发现6mA广泛存在于拟南芥基因组中并富集于着丝粒周围的异染色质区域,6mA在外显子的富集程度高于基因间区,此外6mA在TSS位点附近也呈现出类似于衣藻中的双峰分布模式,6mA在拟南芥的不同组织器官中的含量具有异质性,6mA含量最高达0.138%,最低为0.006%,并且在拟南芥的发育过程中6mA的含量是动态变化的[55]。表1总结了6mA在部分原核生物和真核生物中的含量与富集基序。

表1 6mA在部分原核生物和真核生物中的含量与富集基序
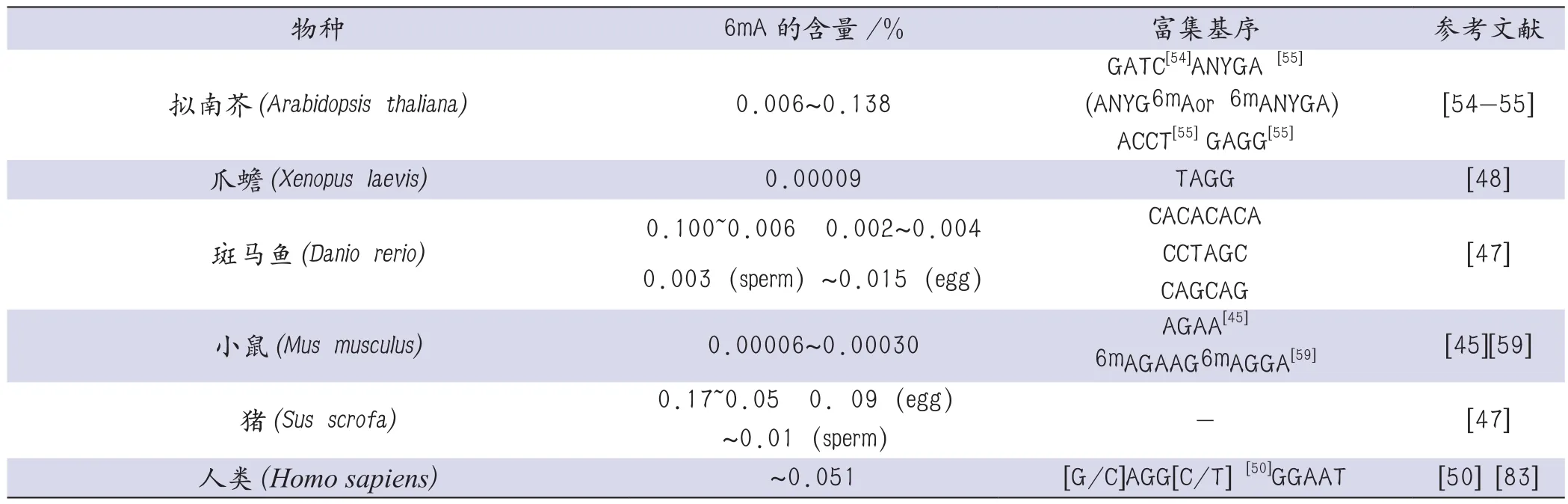
续表
这些文章所报道的极低含量的6mA,是进化的残余,或是细胞内的异常修饰,还是实验样本中有细菌污染或者支原体污染,仍然有探究的余地。
在真核生物中6mA富集的基序具有一定的进化保守性,如AGG基序相对高频率地存在于拟南芥、水稻、线虫、非洲爪蟾和人类基因组中,这提示我们真核生物保守的AGG基序可能具有类似的生物功能,或者有类似的识别AGG基序的机制存在。6mA富集的基序和相关的生物学功能之间的精确的关系还有待确定。但是6mA富集的基序在同一物种内或不同物种间仍然存在很大的异质性,这启示我们在进化的过程中可能出现了多种添加、去除和识别6mA的酶类并且可能存在多种调控6mA动态变化的机制。
2 26mA的调节酶
2.1 编码器—6mA甲基转移酶
真核生物中6mA甲基转移酶方面的研究长期以来都是空白。有研究分析了真核生物中DNA甲基化的酶系,预测了多种可能参与6mA修饰的结构域[19][56]。
有报道称植物蛋白Wadmtase参与小麦线粒体6mA修饰[57],而Wadmtase是一种Mg2+- Ca2+依赖的酶,属于tRNA甲基转移酶TRM11家族,该家族蛋白甲基化tRNA上的鸟嘌呤形成m2G[56],因此Wadmtase是否真正参与6mA修饰还需更多证据进行证明。
在线虫中敲除Damt-1基因能降低6mA的水平,而过表达该基因能增加6mA的水平。DAMT-1是在真核生物中保守的MT-A70家族蛋白的同源物[38],METTL3和METTL14是MT-A70家族蛋白的两个同源物,二者作为甲基转移酶形成异二聚体介导mRNA产生m6A,而METTL3和METTL14也能在体外修饰DNA产生微弱的6mA[58];而且哺乳动物METTL4也与线虫DAMT-1是同源物[19],并且Kweon等最近也鉴定了小鼠METTL4也可以催化6mA的形成,在小鼠中敲除METTL4基因后导致新生小鼠整体发育不良和面部畸形(包括下颌畸形和无眼畸形),也会导致成年小鼠在10~12周就表现出垂死状态和造血功能异常[59];可见MT-A70家族蛋白在6mA的甲基化中扮演了重要的角色,因而研究人员推测该家族蛋白也许还包含其他未被鉴定的6mA甲基转移酶。
在胃癌和肝癌组织中鉴定了N6AMT1是6mA的甲基转移酶[50],相反的是在恶性胶质瘤干细胞中敲除N6amt1基因和体外实验均未发现6mA的水平变化[51],结合先前发现的N6AMT1作为哺乳动物翻译终止因子eRF1的谷氨酰胺特异的甲基转移酶[60],N6AMT1是否普遍作为哺乳动物6mA的甲基转移酶还存在争议,需要更多的实验证据阐明其功能。
2.2 消码器—6mA去甲基酶
表观遗传修饰往往是受到动态调控的可逆过程,DNA甲基化也不例外。在真核生物中存在6mA甲基转移酶,则必定存在6mA去甲基酶。AlkB家族是进化保守的、Fe(Ⅱ)和α-酮戊二酸依赖的双加氧酶家族。AlkB家族蛋白具有广泛的底物和多种功能,在大肠杆菌中AlkB双加氧酶通过对腺嘌呤1号和6号氮原子进行氧化脱烷基作用逆转DNA的烷基化损伤发挥DNA损伤修复的作用,6mA也是AlkB双加氧酶的底物,在氧化作用下经过中间产物HO-6mA生成腺嘌呤[61-62]。哺乳动物AlkB双氧酶家族共有9个成员,ALKBH1-8和FTO,其中ALKBH5和FTO是mRNAm6A的去甲基酶,ALKBH2和ALKBH3均参与DNA 1mA和3mC的去甲基化[63-64]。ALKBH1及其同源物在多种真核生物中被发现具有6mA去甲基酶的作用。在线虫中发现AlkB家族蛋白同源物NMAD-1参与6mA的去甲基化,敲除Nmad-1基因或体外实验发现6mA的水平显著变化[38]。
在果蝇中发现DMAD参与调节6mA的去甲基化,并证明了DMAD促进果蝇早期生殖细胞分化,是果蝇发育所必需的蛋白,DMAD是果蝇CG2083基因编码的一种含有多个功能结构域并且进化高度保守的蛋白,DMAD类似于哺乳动物TET家族蛋白,但在果蝇体内却并不参与催化5mC形成5hmC;更值得注意的是DMAD含有与细菌6mA去甲基化酶AlkB家族蛋白具有相似的DSBH(double-strand α-helix)结构域。在果蝇胚胎发育的早期DMAD低表达,而在后期高表达,此外胚胎发育过程中DMAD介导的6mA去甲基化还与转座子表达抑制相关[40]。
在小鼠中Alkbh1基因缺失导致胚胎致死和产仔率下降80%,在Alkbh1基因纯合缺失的小鼠胚胎干细胞系中发现6mA的含量增加,体外实验发现重组ALKBH1蛋白能有效降低6mA的含量,因此在小鼠中ALKBH1作为去甲基酶调节6mA的动态变化[45]。此外Kweon等通过斑点杂交实验发现小鼠ALKBH4能有效地使双链DNA上的6mA发生去甲基化,但对单链上的6mA去甲基化效果不显著[59]。
人类ALKBH1蛋白与小鼠ALKBH1蛋白的序列同源性很高,在胃癌和肝癌组织发现6mA含量降低的同时ALKBH1表达上调,因而研究人员推测ALKBH1是6mA的去甲基酶;敲降和异位表达ALKBH1均能使6mA含量降低,结合体外实验进一步证明ALKBH1是人类6mA的去甲基酶[50]。Xie等也用多种方法鉴定了ALKBH1是6mA的去甲基酶作为转录激活因子识别6mA富集位点移除6mA从而解除6mA对基因表达的抑制作用,敲降ALKBH1导致6mA含量增加从而抑制抑癌基因的表达,进而促进恶性胶质瘤干细胞的存活,因此ALKBH1可以作为潜在的癌症治疗靶点[51]。
Zhou等利用CRISPR/Cas9等技术鉴定了ALKBH1在水稻中的同源基因OsALKBH1(LOC_Os03g60190—)是水稻6mA的去甲基酶[53]。以上发现的哺乳动物ALKBH1及其在果蝇和水稻中的同源物蛋白都具有相似的DSBH结构域作为核心催化结构域,提示我们更多具有6mA去甲基化作用的含有DSBH结构域的双加氧酶在真核生物中还有待被发现。此外,果蝇去甲基酶DMAD是TET家族蛋白的类似物这一事实也提示我们,在基因组5mC含量极低或者缺失的真核生物中TET家族蛋白及其同源物或类似物可能不参与5mC动态调节,而参与6mA的代谢调节。
2.3 阅读器—6mA阅读蛋白
目前已经在小鼠中发现了2种6mA阅读蛋白ASXL1和MPND,两者都是哺乳动物中与原核生物6mA阅读蛋白具有同源结构域的蛋白。体外Pull-down实验证明ASXL1和MPND能结合含有6mA的双链DNA[59]。当ASXL1和MPND与6mA结合时,E3泛素连接酶TRIP12会识别这两种蛋白并促进它们通过泛素化途径降解,从而维持6mA抑制基因表达的状态。
RNA m6A的相关调节酶:包括编码器(writers)—m6A甲基转移酶METTL3、METTL14、WTAP、KIAA1429,消码器(erasers)—m6A去甲基酶FTO、ALKBH5和阅读器(readers)—m6A 阅 读 蛋 白 YTHDF1、YTHDF2、YTHDC1、HNRNPA2B1、HNRNPC等已经有大量相关研究报道[65]。对于真核生物中6mA的甲基转移酶、去甲基酶和阅读蛋白已经有一些报道。不同生物中的6mA调节酶如表2所示。
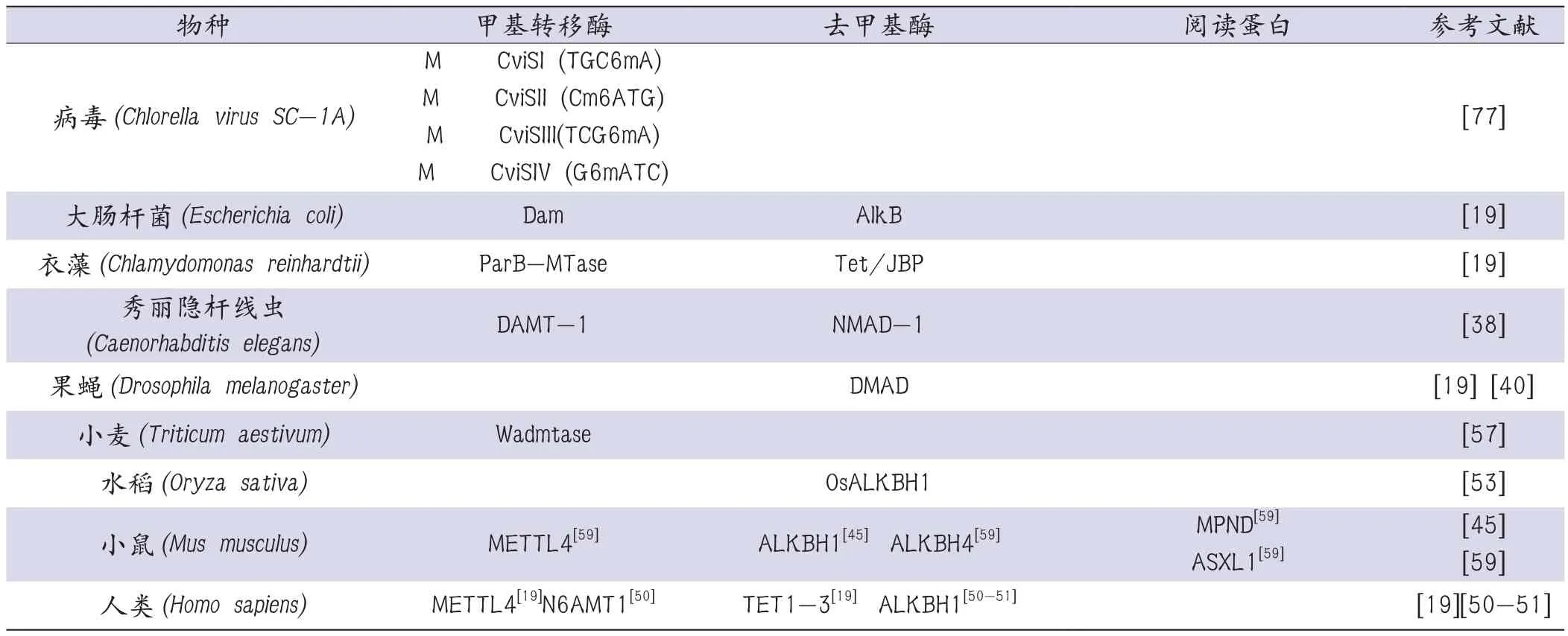
表2 6mA的甲基转移酶、去甲基酶和阅读蛋白表
3 6mA的生物学功能
目前对于6mA修饰在真核生物中的功能的报道较少。已有的研究表明6mA参与基因和转座子表达的激活或抑制、跨代遗传与胚胎发育、组蛋白修饰与核小体定位、癌症与精神类疾病等生理病理过程。
3.1 6mA与基因和转座子的表达相关
嗜热四膜虫在营养生长、分化和增殖过程中生殖核的DNA处于转录失活状态,营养核的DNA处于转录激活状态,而6mA只存在于营养核中,因此研究人员推测6mA是营养核基因转录激活所需要的[26]。随后的研究也发现在四膜虫中6mA与RNA聚合酶II(Pol II)转录的基因高度相关,但6mA并不是四膜虫活跃转录基因的一个明确标记[87]。早期分化谱系的真菌中6mA的分布并不是随机的而是与基因的功能相关的,主要体现在6mA的分布位点与5mC的分布位点呈现明显的负相关性以及6mA在TSS位点富集与基因的激活具有正相关性[32]。对于衣藻[30]、线虫[38]和果蝇[40]的研究也表明6mA的积累与基因或转座子的表达成正相关。
对于小鼠胚胎干细胞的研究发现6mA的含量与LINE-1(Long Interspersed Nuclear Element-1) 转 座 子的进化年龄负相关,6mA在年轻的全长LINE1(young full-length LINE-1 <1.5 million years old)转座子上富集并与LINE1转座子及其邻近的增强子和基因的沉默直接相关,结合先前在人类ES细胞中的研究表明年轻的全长LINE1转座子被5mC所沉默[81],由此猜测6mA与5mC可能在ES细胞中共同调节某些基因的沉默,并且6mA在哺乳动物中的表观遗传效应可能与5mC有一定的相似之处。通过分析6mA去甲基化酶基因Alkbh1基因敲除的ES细胞的转录组数据并结合RT-qPCR实验,结果表明Alkbh1基因敲除导致的6mA积累抑制了X染色体上基因的转录;由于LINE1在X染色体上富集,这也为阐明LINE1转座子在X染色体失活过程中的功能提供了新的线索[45]。在小鼠大脑皮层中,压力诱导的6mA的动态变化与神经元功能和发育相关基因以及LINE转座子表达水平呈负相关[69]。最新的研究表明小鼠基因组中6mA的富集可以维持Polycomb基因沉默[59]。在人类中6mA含量增加可以抑制抑癌基因的表达从而促进恶性胶质瘤干细胞的存活[51]。以上研究均表明6mA的积累与基因或转座子的表达成正相关或者负相关,但在水稻中发现位于启动子区的6mA使基因沉默,而位于基因体的6mA则与基因的活化相关[53]。在拟南芥中,6mA的含量与基因的表达水平以及营养生长向再生生长的转变成正相关[55]。因此,研究人员推测6mA在真核生物中的转录调控效应可能具有物种、时间和空间多样性。
3.2 6mA与胚胎发育和跨代遗传相关
6mA的含量在果蝇、斑马鱼和猪的胚胎发育的不同阶段是高度动态变化的,6mA在胚胎发育的早期含量较高,当胚胎发育到囊胚期时6mA下降到极低水平,这种动态变化可能在促进早期胚胎的发育中发挥重要作用[40][47]。而与此相反的是,5mC在受精后的早期胚胎中大规模的被擦除,在随后的发育过程中胚胎基因组DNA重新甲基化并逐渐恢复到高水平[66-68]。早期胚胎发育过程中,5mC缺失的时候6mA可能作为替代性的表观修饰标记起到一定的补充作用或者发挥特殊的作用,6mA是否作为5mC的一个互补的表观遗传标记而发挥作用还需要进一步探究。
值得注意的是6mA主要对称地分布在嗜热四膜虫、衣藻和真菌的ApT回文序列中,这种对称分布也许与DNA的复制相关,而在其他真核生物中还没有关于6mA分布于类似回文序列的报道;更进一步的研究在线虫中发现6mA具有隔代遗传的表型,因而推测6mA可能是一种可跨代携带和传递的表观遗传标记[38]。
3.3 6mA与组蛋白修饰和核小体定位相关
在人类基因组中6mA与组蛋白甲基化修饰H3K9me3和H3K27me3共定位在异染色质区域[51]。6mA与组蛋白甲基化修饰的相互关系及两者是否共同作用于异染色质的形成过程等问题具有较大的研究价值。衣藻基因组中发现单个6mA位点专一地标记相邻两个核小体之间的连接DNA,6mA修饰位点的位置有助于核小体的精确定位,首次揭示了6mA在真核生物核小体定位中具有功能意义[30]。随后研究人员在四膜虫中发现含有6mA的连接DNA的两侧通常是包含H2A.Z变体的核小体[87]。
3.4 6mA与癌症和精神类疾病相关
在环境压力下小鼠大脑中6mA含量受到动态调控,慢性压力可诱导6mA在小鼠前额叶皮质(prefrontal cortex, PFC)中积累,脑中总的6mA水平在响应压力时显著升高,并发现6mA与自闭症和精神分裂症相关,第一次证明了哺乳动物脑中6mA的含量变化与神经精神类疾病存在联系[69]。
与邻近正常组织相比,胃癌和肝癌组织中6mA的含量更低,并伴随着甲基转移酶N6AMT1的下调和去甲基酶ALKBH1的上调,这说明6mA含量降低可以促进肿瘤发生[50]。ATAC-seq和H3K9me3、ChIP-seq等方法获得的实验数据表明高水平的6mA能够降低染色质的可接近性并促进异染色质区域的形成,抑制多个抑癌基因的表达从而促进恶性胶质瘤干细胞的存活,这说明在癌症的进展中6mA作为一种抑制性的表观遗传标记发挥作用[51]。因此,6mA的含量降低与上升可能在不同类型的癌症中发挥促癌作用。
4 6mA检测及研究方法
与真核生物中高度丰富的5mC相比,6mA水平在真核基因组中占比极低,因此只能通过高度灵敏的技术检测[19]。自1971年以来报道的在一些高等植物的质体、线粒体或细胞核中存在的6mA,主要是通过限制性内切酶消化的方法被间接的检测得出的,早期的检测方法无法对6mA含量进行精确测定也无法确定6mA在基因组中的分布模式[33-35,52],因此限制了6mA的研究进程。近些年来几项新技术的出现使6mA的研究有复苏的趋势,以下对这些方法进行简单的总结。
4.1 基于6mA特异性抗体的方法
早在1983年Chhaya等使用特异性的抗体结合其实验室所开发的高灵敏度的免疫化学方法[70]在人类胎盘、大鼠精子、2种雌性的处于妊娠期的水蜡虫和黑腹果蝇的DNA中检测到了6mA的存在[34]。现今使用商业化的抗6mA的特异性抗体结合斑点杂交实验对实验材料中DNA是否含有6mA进行定性和半定量分析,果蝇、线虫、小鼠等基因组中6mA的发现使用了这种方法。6mA特异性抗体结合免疫荧光染色可以对DNA中的6mA进行半定量分析,Liu等用这种方法检测了斑马鱼和猪的胚胎基因组6mA的动态变化[47]。这种方法的缺点是目前的6mA抗体无法区分6mA与mRNAm6A,需要用RNase消化掉mRNAm6A;此外,6mA抗体对DNA 1mA也有一定的识别作用,随后需要结合更加灵敏的检测技术进一步检测6mA的具体含量和动态变化。
在表观遗传学研究中,高通量测序技术被广泛用于探究表观遗传学修饰的含量与分布[71]。Weber等人将免疫共沉淀(immunoprecipitation)技术和下一代测序(next generation sequencing, NGS)技术相结合,已经用于在哺乳动物基因组中检测5mC[72]。6mA特异性抗体用于6mA-DNA免疫沉淀再结合高通量测序手段(6mAIP-Seq)已经是研究6mA的基本方法。6mA-IP-seq利用抗6mA的抗体富集测序文库中的含有6mA修饰DNA片段[85],然后利用下一代测序技术对富集得到的DNA片段进行测序,然后通过分析测序数据绘制6mA在全基因组内的修饰图谱,6mA-IP-seq的缺点是无法达到单碱基的分辨率[19]。6mA-IP-Seq结合核酸外切酶消化的方法(6mA-CLIP-exo-seq)能够提高分辨率,6mACLIP-exo-seq虽然能够在6mA-IP-Seq的基础上提高识别6mA的分辨率,但这两种基于抗体的检测方法从原理上限制了它们,使其都无法做到完全从单碱基的水平上以高分辨率识别6mA。
4.2 限制性内切酶介导6mA测序
基于限制性内切酶的6mA测序(6mA-RE-seq)能够达到单碱基分辨率,但这种方法依赖于限制性内切酶的序列识别特异性,只能检测到有限的6mA修饰基序(motif sites),而无法得到全基因组范围内的6mA甲基化修饰图谱。Fu等使用6mA-IP-seq和6mA-CLIP-exo-seq在衣藻基因组中确定了6mA富集基序是CATG和GATC,随后用对6mA修饰不敏感的限制性内切酶CviAII(25℃,识别CATG)和DpnII(37℃,识别GATC)处理衣藻的基因组DNA,并加以超声处理,非甲基化CATG或GATC基序的DNA片段将被消化,分别生成带有CATG或GATC末端的约300bp的片段,甲基化CATG或GATC基序能够抵抗限制性内切酶的消化因而存留于超声处理后产生的DNA片段的内部,随后将消化后的片段的末端连上接头序列,然后经PCR扩增构建DNA文库用于高通量测序。CATG或GATC基序在DNA片段内部和外部的比例就代表了6mA甲基化和未甲基化的相对比例[30]。
4.3 单分子实时测序技术
单分子实时测序技术(SMRT-seq)是由Pacific Biosciences公司开发的第三代高通量测序技术,其原理是基于边合成边测序的思想,不经过PCR,以SMRT芯片为载体进行测序反应,SMRT芯片上包含多个孔状纳米光电结构,DNA聚合酶与DNA模板和测序引物结合在一起形成复合物并被固定在每个纳米孔的玻璃底板上,加入四色荧光基团标记的dNTPs后进行互补DNA链的合成,参加反应的单个dNTP上与其焦磷酸基团相连的特定的荧光基团被从测序小孔底部入射的激光激发产生相应的荧光脉冲,同时荧光信号被检测系统记录,随后荧光基团标记的焦磷酸基团被DNA聚合酶切割脱落使荧光信号淬灭,再进入下一轮反应;若DNA模板链存在甲基化修饰,根据DNA聚合酶的动力学特征,当合成反应进行到修饰位点时子链上的碱基加入所需时间相比于未修饰位点会出现延长;荧光检测系统根据荧光脉冲的类型和出现两次荧光脉冲的间隔时间判断新加入的dNTP的种类以及记录模板DNA上的修饰位点[73-74,84]。利用单分子实时测序技术在大肠杆菌基因组中获得了单碱基分辨率的全基因组甲基化腺嘌呤图谱[75-76]。实际上,目前所报道的有关高等真核生物6mA的研究中基本都会用到SMRT-seq。SMRT-seq的优点是能对提取并处理好的基因组DNA直接进行测序,无须PCR的扩增步骤,能够产生长读长的读段(reads)并且能够检测基因组序列高度重复区域的甲基化修饰。其缺点是不能很好地区分1mA和6mA,所以一般需要结合LC-MS/MS排除1mA的干扰。
4.4 UHPLC-MS/MS 法
超高效液相色谱—三重四极质谱(ultra-high performance liquid chromatography-triple-stage quadrupole mass spectrometry, UHPLC-MS/MS)将高效液相色谱技术与质谱技术相结合,可以检测含量很低的6mA灵敏核苷酸修饰[10],具有高灵敏度和高精确度的优点,一般用来进一步确定SMRT测序所得结果的可靠性。简而言之,其原理就是超高效液相色谱(UHPLC)分离消化的DNA与质谱检测相结合,通过使用串联质谱仪(MS / MS)在检测到特定的核苷酸修饰之后,使用在目的样品中同时分析的标准曲线实现定量分析[19]。由于6mA特异性抗体检测和单分子实时测序等技术无法区分6mA、1mA,而UHPLC-MS/MS法能够通过色谱和分子质量差异区分6mA、1mA从而排除1mA的干扰。因此目前6mA在真核生物的发现过程中大多数都使用了UHPLC-MS/MS法。值得注意的是,运用UHPLC-MS/MS法检测真核生物6mA时,需要排除任何来自支原体或细菌DNA的潜在污染。
实际上,所有的检测方法都应该注意样本的细菌污染程度,细菌污染造成6mA的假阳性结果应当被排除。但是很多文献都没有提到这一点,仅有极少数文献中提到他们排除了细菌污染对于所测得的6mA数据的影响[53]。
5 结语
6mA是一种在细菌中发挥重要作用的DNA修饰,它参与细菌DNA复制起始,碱基错配修复,转录与转座,保护细菌基因组免于外源DNA的侵入和细菌毒素的分泌等生命活动。近年来对于真核生物的6mA修饰的研究逐渐增多,特别是哺乳动物6mA修饰已经吸引了众多研究人员的关注但仍然方兴未艾。已报道的真核生物6mA能够跨代传递并与基因表达、转座子表达、核小体定位和组蛋白修饰等众多生物功能相关,也与癌症和精神疾病等病理过程相关;多个研究证据表明6mA可以被动态调节,6mA也具有调节功能,因此阐明与6mA功能相关的上游和下游调控机制很有研究价值。
目前发现6mA在不同物种中的含量、分布和功能具有较大的异质性和一定的相似性, 我们还需要在更多的真核生物中去探索6mA的含量和分布,寻找更为普遍的规律。6mA的功能是否具有保守性也尚未阐明,如果6mA的功能是保守的,那么理论上应该存在具有保守结构域的甲基化酶、去甲基化酶和阅读蛋白;就目前已经鉴定存在的6mA的甲基化酶和去甲基化酶而言,仍然需要进一步研究它们调节6mA的催化机制;真核生物中存在6mA的甲基化酶和去甲基化酶说明6mA是可以被动态调控的,这也从侧面证明了6mA在真核生物中具有重要的生物学作用。6mA的阅读蛋白已经在小鼠中被发现, 6mA的阅读蛋白是否在其他哺乳动物中也存在,以及这些蛋白的6mA识别位点与下游通路仍然有待研究;6mA的调节蛋白在真核生物中的鉴定和功能阐释将使人们对6mA修饰的调控机制产生新的理解。现已报道的6mA与癌症和精神疾病相关,6mA与众多人类疾病的关联未来将得到更进一步的研究。
