Ni-W-P非晶态合金催化剂的制备及催化硝基苯液相加氢性能
2019-07-31程庆彦王明明王延吉
程庆彦,王明明,张 凯,王延吉
(河北工业大学 绿色化工与高效节能河北省重点实验室,天津 300130)
苯胺是重要的化工原料,广泛用于聚氨酯、染料、橡胶助剂、炸药、医药、农药和香料的合成,开发利用前景十分广阔[1-3]。工业生产苯胺的传统方法是硝基苯Fe粉还原法[4],因存在设备庞大,腐蚀严重,铁粉耗用量大,“三废”污染严重等不足,逐渐被硝基苯加氢法所取代。目前常用的硝基苯加氢催化剂如Raney(Raney Ni[5]、Raney Cu[6]等)存在严重的环境污染问题,而负载型贵金属催化剂(如Pd/SiO2、Pt/C等)[7-8]则存在成本过高等问题。由此可见,制备价廉、高效且环境友好型的加氢催化剂具有重要意义。
非晶态合金具有独特的配位不饱和、电子相互作用以及组成均匀可调的特点,显示出良好的催化性能;同时,非晶态合金催化剂的制备以及使用过程对环境友好,符合绿色化工对催化剂的要求,成为催化剂研究领域的热点。目前研究较多的是金属-B非晶态合金,但该类催化剂制备成本较高;另一类是用相对廉价的次亚磷酸盐为还原剂制备的金属-P非晶态合金,更具有应用前景。经过几十年的发展,镍系非晶态合金催化剂取得了非常大的进步,广泛应用于不饱和化合物催化加氢[9-11]、脱硫[12-13]、硼氢化物水解[14-16]、燃料电池的电催化氧化[17-19]等方面。目前,非晶态合金催化剂虽然有较高的催化活性,但是其比表面积小、抗硫性差、稳定性差、易失活,严重影响了其工业应用化价值。在前期对Ni-P非晶态催化剂研究[20]的基础上,通过加入助剂W,制备Ni-W-P非晶态合金催化剂,并探讨了W含量对催化剂结构和催化硝基苯液相加氢性能的影响。
1 实验部分
1.1 原料和试剂
NiCl2·6H2O、NaH2PO2·H2O、NaOH、KBH4,Na2WO4·2H2O、25%(质量分数)氨水,均为AR,购自天津市风船化学试剂科技有限公司;CH3COONa·3H2O、无水乙醇为AR,购自天津市化学试剂一厂;硝基苯,AR,购自天津市登峰化学试剂厂;甲苯,AR,购自天津市福晨化学试剂厂。
1.2 催化剂的制备
采用化学还原法制备Ni-W-P非晶态合金催化剂。按n(Ni)∶n(P)∶n(CH3COO-)=2∶8∶1称取NiCl2·6H2O、NaH2PO2·H2O和CH3COONa·3H2O 3种试剂,然后称取一定量的Na2WO4·2H2O,依次加入到三口烧瓶中,加入去离子水,用NH3·H2O调节溶液pH值至9.0,30 ℃下磁力搅拌。在N2保护下,滴加几滴KBH4溶液诱导反应发生,反应溶液中生成黑色沉淀并伴有气泡产生,反应至无气泡产生,停止反应。将黑色沉淀分别用去离子水和乙醇洗涤3次,然后置于无水乙醇中保存,以备使用。制备出的非晶态催化剂样品记为Ni-xW-P,其中,x为助剂W的添加量(摩尔分数,以下同),x=(nW/(nW+nNi))×100%。
1.3 催化剂表征
采用日本理学公司生产的D/MAX-2500型X射线衍射仪(XRD)进行X-射线衍射分析,CuKα射线,管电流为100 mA,管电压为40 kV,扫描范围为10°~90°,扫描速率为8 °/min;采用赛默飞世尔科技有限公司ESCALAB 250Xi仪器测定X-射线光电子能谱(XPS),AlKα(1486.6 eV)射线作为激发源。采用FEI Nova SEM-450型扫描电子显微镜(SEM)表征催化剂的表面形貌特征;采用美国TA仪器公司SDT Q-600差示扫描量热仪(DSC)检测催化剂的热稳定性,N2氛围,流速为100 mL/min,升温速率为10 ℃/min;采用美国Micromeritics公司ASAP2020型比表面积和孔隙度吸附仪(BET)测试催化剂的比表面积及孔结构,催化剂于90 ℃下真空脱气8 h,分析采用的吸附质为N2,载气为He。
1.4 催化剂活性评价
在100 mL带磁力搅拌的高压反应釜中依次加入适量的催化剂、2.0 g硝基苯、8.0 g无水乙醇。在室温条件下,密封后反复通H28次,以排尽高压反应釜中的空气,通H2至一定压力。以10 ℃/min的速率升温至设定温度,并在600 r/min转速搅拌下开始反应,反应过程中不断通入H2以维持釜内压力,反应一段时间后结束,冷却离心分离出产物。采用岛津GC2010plus型气相色谱分析仪分析产物的组成,使用RTX-5毛细管色谱柱,FID检测器。载气N2的流速为30 mL/min,H2的流速为40 mL/min,空气流速为400 mL/min,进样器温度为220 ℃,检测器温度为280 ℃,目标产物苯胺的定量分析采用内标法,内标物为甲苯。
2 结果与讨论
2.1 Ni-W-P非晶态合金催化剂的XRD分析结果
图1为不同W含量的Ni-W-P非晶态合金催化剂的XRD谱图。由图1可知,各样品均在2θ=45°左右出现1个弥散的衍射峰。这是金属Ni与类金属P形成的非晶态合金的特征峰[21],表明W的引入未改变Ni-P合金的非晶态结构。随着W含量的增加,2θ=45°左右处的衍射峰变得更加弥散,表明Ni-W-P催化剂的非晶态结构的无序度逐渐增大。

图1 不同W含量的Ni-W-P催化剂样品的XRD谱图Fig.1 XRD patterns of Ni-W-P catalyst samples with different W contents
2.2 Ni-W-P非晶态合金催化剂的XPS分析结果
图2为不同W含量的Ni-W-P催化剂中Ni2p、P2p、B1s和W4f的XPS图谱,并依据各元素对应的峰区域进行了相对含量计算(结果见表1)。在Ni2p XPS谱图中,电子结合能852.4、855.6、861.0、869.5、873.4、879.3 eV处出现6个峰,其中852.4、869.5 eV归属于Ni0,其他4个峰归属于Ni2+[22-24],氧化态镍可能源于制备过程中部分未还原完全的Ni(OH)2,或是测试时被空气氧化生成的NiO。在P2p XPS谱图中,电子结合能129.1、129.9、132.4 eV处出现3个峰,129.1、129.9 eV归属于P0,132.4 eV归属于P的氧化物[25]。在B1s XPS谱图中,电子结合能187.2、190.3 eV处出现 2个峰,187.2 eV归属于B0,190.3 eV归属于B的氧化物[26-28]。文献[29-30]报道,Ni0标准结合能为 853.0、869.9 eV,P0标准结合能为130.4 eV,B0标准结合能为187.0 eV。与标准结合能对比,在Ni-W-P催化剂中Ni0、P0的结合能低于标准结合能,而B0的结合能高于标准结合能,说明Ni0、P0和B0之间存在电子转移。正是在电子转移作用下,使得Ni0呈现富电子状态,催化剂具有更多的不饱和活性位,有利于加氢反应的进行,这与文献[31]的结论相一致。在W4f XPS谱图中,电子结合能31.2、33.4 eV附近出现的峰归属于单质W0,在 34.8 eV和 37.1 eV附近出现的峰归属于WO3[32],W0的存在说明有少部分W6+被还原成单质W。
不同W含量的Ni-W-P催化剂样品的表面组成见表1。助剂W主要以W6+存在于催化剂中,随着Ni-W-P催化剂样品中W含量的增加,W6+也随着增加,而Ni0含量则先增加后减少。可能是因为在Ni-P非晶态合金中添加W组分后,以WO3形式存在的W组分起着类似载体的作用,能有效分散Ni0活性组分,而当W添加量过多时,W和P元素在催化剂表面迅速聚集,覆盖了部分Ni0活性中心,使得表面Ni0的相对含量减少。研究已证实WO3是催化剂中主要的脱氧反应活性中心,Ni0含量直接影响加氢的效果[32],在Ni-6%W-P催化剂表面上W6+和Ni0的相对摩尔分数高达94.14%和36.20%,这种非晶态催化剂的硝基苯加氢性能可能会更好。
2.3 Ni-W-P非晶态合金催化剂的SEM和BET分析结果
不同W含量的Ni-W-P非晶态催化剂的BET和SEM表征结果如表2和图3所示。Ni-P非晶态催化剂为直径在150 nm左右的球形颗粒状。Ni-2%W-P、Ni-4%W-P、Ni-6%W-P和Ni-8%W-P非晶态催化剂与Ni-P相比,当加入助剂W后,催化剂颗粒疏松,粒径明显变小而且更均匀,其中Ni-8%W-P的颗粒粒径最小(大约75 nm)。同时BET结果(见表2)显示在不加助剂的情况下,Ni-P非晶态合金催化剂的比表面积较小,只有5.91 m2/g,平均孔径为20.05 nm。随着助剂W的添加量不断增加,催化剂的比表面积不断增大,平均孔径不断减小,当W添加量为8%(摩尔分数,下同)时,Ni-8%W-P 非晶态合金催化剂的比表面积是Ni-P非晶态合金催化剂比表面积的2倍以上,而平均孔径减小到7.92 nm。Wang等[33]将Ni-W-P-B非晶态催化剂用于对甲苯酚加氢脱氧反应研究得出,W6+和P3+可以有效地阻止颗粒的凝聚,导致催化剂的高非晶态程度;相反,催化剂中存在的Ni0、P0、W0之间相互作用,促使了颗粒的团聚,催化剂表面Ni0、P0、W0含量越多,催化剂的非晶态程度越低。由表1不同W含量的Ni-W-P样品的表面组成可知,当W的添加量为6%时,W6+、P3+的相对含量总和达到最大,结合BET和SEM表征结果可知,W6+、P3+含量的增加有利于催化剂颗粒的分散。由XRD谱图(见图1)分析可知,随着W含量的增加,Ni-W-P催化剂的非晶态结构的无序度逐渐增大。笔者的XRD、XPS、BET和SEM表征分析结论与WANG等[33]所得结论相一致。

图2 不同W含量的Ni-W-P催化剂样品中Ni2p、P2p、B1s、W4f的XPS谱图Fig.2 XPS spectra of Ni2p,P2p,B1s and W4f of Ni-W-P catalyst samples with different W contents(a)Ni2p;(b)P2p;(c)B1s;(d)W4f
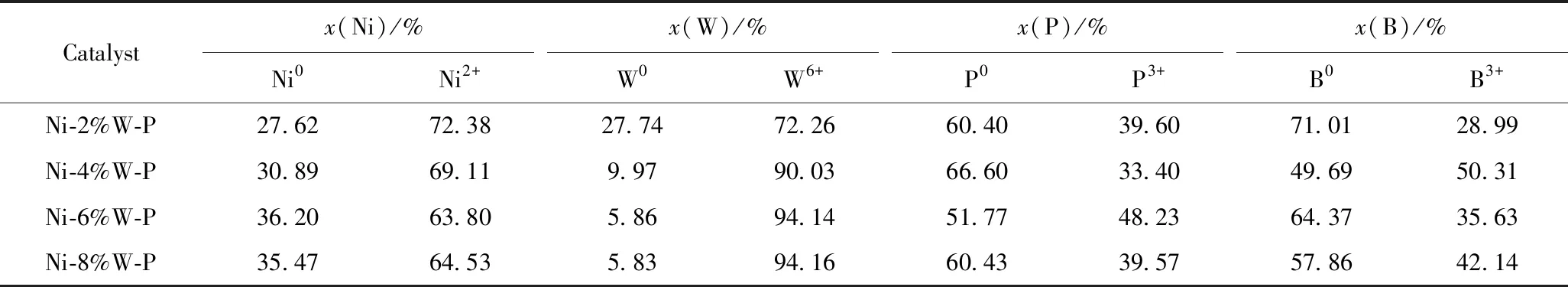
表1 不同W含量的Ni-W-P催化剂样品的表面组成Table 1 Surface composition of Ni-W-P catalyst samples with different W contents

图3 Ni-P、Ni-2%W-P、Ni-4%W-P、Ni-6%W-P和Ni-8%W-P催化剂样品的SEM照片Fig.3 SEM images of Ni-P,Ni-2%W-P,Ni-4%W-P,Ni-6%W-P and Ni-8%W-P catalyst samples(a)Ni-P;(b)Ni-2%W-P;(c)Ni-4%W-P;(d)Ni-6%W-P;(e)Ni-8%W-P

表2 不同W含量Ni-W-P催化剂样品的比表面积和平均孔径分析表征结果Table 2 Characterization of specific surface area (SBET)and average pore size (Dp)of Ni-W-P catalyst samples with different W contents
2.4 Ni-W-P非晶态合金催化剂的DSC分析结果
图4为不同W含量的Ni-W-P非晶态催化剂样品的DSC曲线。从图4可以看出,Ni-P非晶态合金催化剂在360 ℃附近出现了1个放热峰,此为非晶态合金的典型晶化峰。而Ni-8%W-P非晶态合金在430 ℃附近出现了1个放热峰,比Ni-P晶化温度提高了70 ℃,表明W的引入提高了Ni-P非晶态结构的热稳定性。Zhang等[34]研究发现,钐的加入提高了Ni-B非晶态合金的热稳定性,其原因是钐原子半径较大,阻碍了Ni和B原子的扩散。Walter等[35]研究表明,在Fe-B非晶态合金中引入原子半径较大的助剂,使得晶格变大容纳更多的B原子,降低了非晶态合金中的自由体积和原子的扩散速率,提高了非晶态合金结构的热稳定性。因此,推测Ni-W-P非晶态合金催化剂热稳定性的提高可归结于原子半径较大的W阻碍了Ni和P的扩散。

图4 不同W含量Ni-W-P催化剂样品的DSC曲线Fig.4 DSC curves of Ni-W-P catalyst samples with different W contents
2.5 W添加量对Ni-W-P非晶态合金硝基苯加氢性能的影响
在反应温度100 ℃、H2分压1.0 MPa、催化剂用量0.20 g、反应时间120 min条件下,考察W添加量对Ni-W-P非晶态合金催化剂加氢性能的影响。结果如图5所示。可以看出,当不添加W时,硝基苯的转化率和苯胺选择性分别为91.92%和95.45%,随着W添加量的增加,硝基苯的转化率先增大后保持不变,苯胺的选择性先增大后减小,当W添加量为6%时,硝基苯转化率和苯胺选择性均为100%。有报道指出W的氧化物和P的氧化物可以作为分散剂[36-39],在Ni-P非晶态合金中添加W组分后,以WO3形式存在的W组分起着类似载体的作用,能有效分散Ni活性组分,且催化剂表面的WO3可充当Brönsted (B)酸的吸附中心,与氧的孤对电子相互作用而吸附含氧化合物。因此,WO3是催化剂中主要的脱氧反应活性中心,催化剂表面WO3的含量直接影响催化剂的脱氧活性[32]。结合表1催化剂的表面组成可知,W添加量过多时,W和P元素在催化剂表面迅速聚集覆盖了部分Ni0活性中心,表面Ni0的相对含量减少,结果导致催化剂的选择性下降,反应生成部分中间体(如亚硝基苯、苯基羟胺、氧化偶氮苯、偶氮苯和氢化偶氮苯)。这与闫少伟等[40]报道的Mo引入到Ni-B非晶态合金中用于二硝基甲苯低压加氢反应结果一致。因此,选择W的添加量为6%。
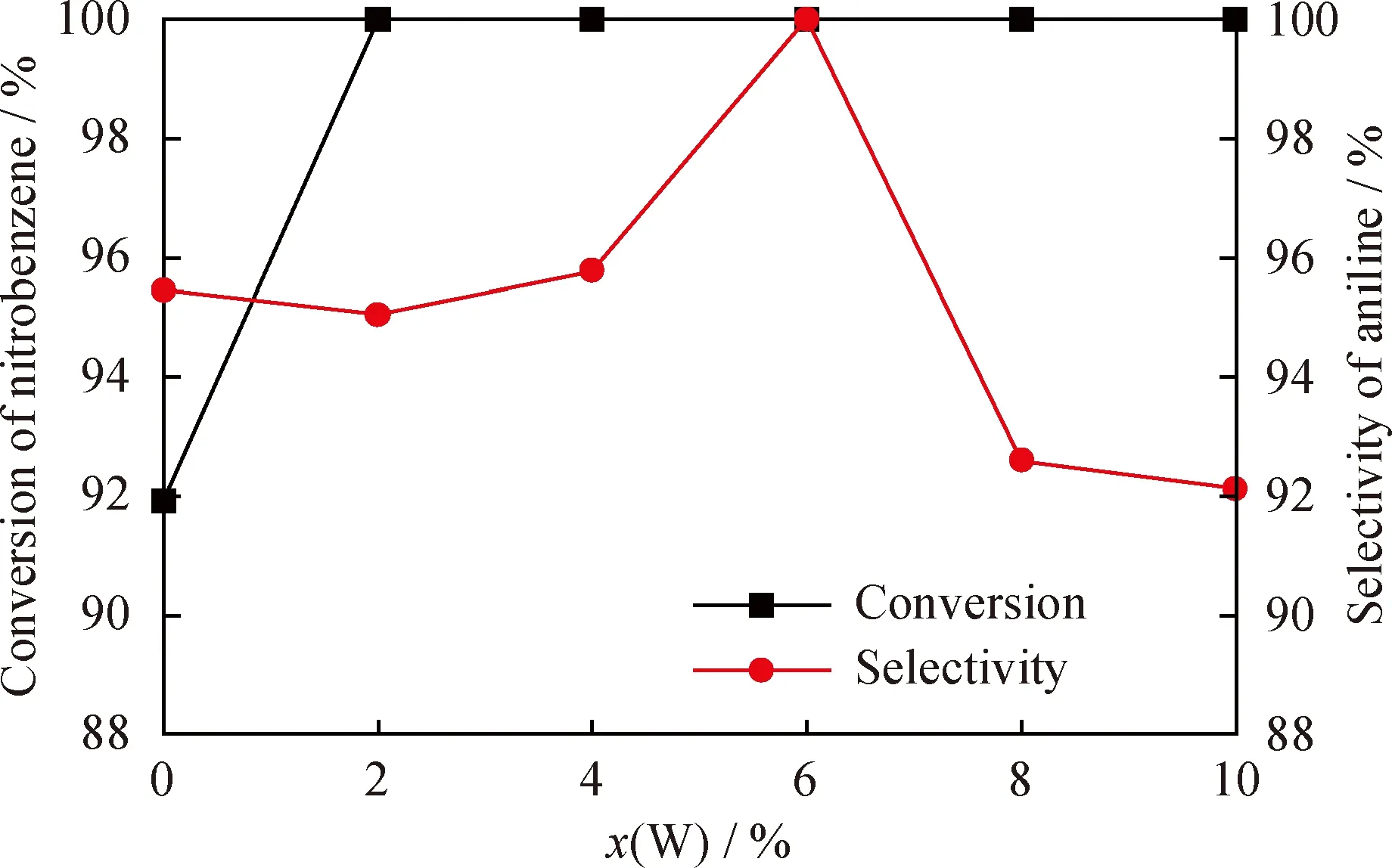
图5 W的摩尔分数对Ni-W-P非晶态合金催化剂加氢性能的影响Fig.5 Influence of W content on hydrogenation performance of Ni-W-P amorphous alloy catalystm(Catalyst)=0.20 g;t=120 min;T=100 ℃;p(H2)=1.0 MPa
2.6 H2分压对硝基苯加氢反应的影响
在催化加氢反应中,H2压力对反应的速率至关重要,H2压力会影响H2在反应介质中的溶解度,从而影响加氢速率。在反应温度100 ℃、催化剂用量0.20 g、反应时间120 min条件下,考察H2压力对硝基苯加氢合成苯胺的影响,如图6所示。可以看出,当H2压力为0.5 MPa时,硝基苯转化率和苯胺选择性较低,分别为50.64%和87.09%,这是由于H2压力较低,加氢速率慢,反应不完全。随着H2压力的增加,硝基苯转化率和苯胺选择性得到明显提高,当H2压力为1.0 MPa时,硝基苯转化率和苯胺选择性达到最大值,均为100%。此后,随着H2压力继续增加,硝基苯转化率和苯胺选择性保持不变,所以选择H2压力为1.0 MPa。
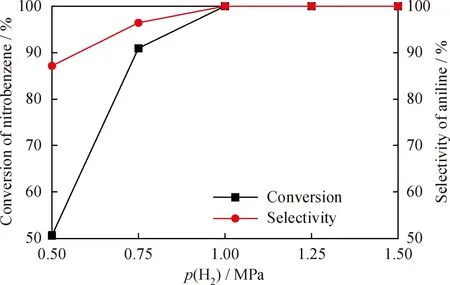
图6 H2压力(p(H2))对Ni-6%W-P非晶态合金催化剂加氢性能的影响Fig.6 Influence of H2 pressure (p(H2))on hydrogenation performance of Ni-6%W-P amorphous alloy catalystm(Ni-6%W-P)=0.20 g;t=120 min;T=100 ℃
2.7 反应温度对硝基苯加氢反应的影响
硝基苯加氢是一个放热反应[41],从热力学角度考虑,温度升高不利于反应正向移动,从而影响硝基苯的转化率和苯胺的选择性;而从动力学角度考虑,温度过低直接导致反应速率过慢,因此,需要考察硝基苯加氢制备苯胺的适宜温度。在H2分压1.0 MPa、催化剂用量0.20 g、反应时间120 min条件下,考察反应温度对Ni-6%W-P非晶态合金催化硝基苯加氢合成苯胺的影响,结果如图7所示。可以看出,当反应温度为80 ℃时,催化剂的催化活性不高,硝基苯转化率为8.94%,苯胺选择性为80.16%,反应物没有完全转化,且有副产物存在。当反应温度从80 ℃升到100 ℃的过程中,硝基苯的转化率和苯胺的选择性都不断增大。当温度在 100~110 ℃之间时,硝基苯转化率和苯胺选择性均达到100%。当温度高于110 ℃时,副反应增加,苯胺选择性降低。因此,反应的最佳温度为100 ℃。
2.8 反应时间对硝基苯加氢反应的影响
在H2分压1.0 MPa、催化剂用量0.20 g、反应温度100 ℃条件下,考察Ni-W-P非晶态合金催化剂上反应时间对硝基苯加氢合成苯胺的影响,结果如图8所示。可以看出,当反应时间为30 min时,硝基苯的转化率仅为10.58%,苯胺选择性为58.90%。随着反应时间的增加,硝基苯转化率和苯胺选择性显著增加,当反应时间为90 min时,出现最大值,此时硝基苯转化率和苯胺选择性均为100%;当反应时间大于90 min后,硝基苯转化率和苯胺选择性保持100%。这是由于当反应时间太短时,硝基苯未能够得到足够的活化,硝基苯的转化率不高,而且生成大量的中间产物(如亚硝基苯、苯基羟胺、氧化偶氮苯、偶氮苯和氢化偶氮苯[42]),使得苯胺的选择性很低,所以实验选择适宜的反应时间为90 min。
图7 反应温度(T)对Ni-6%W-P非晶态合金催化剂加氢性能的影响Fig.7 Influence of reaction temperature (T)on hydrogenation performance of Ni-6%W-P amorphous alloy catalystm(Ni-6%W-P)=0.20 g;t=120 min;p(H2)=1.0 MPa

图8 反应时间(t)对Ni-6%W-P非晶态合金催化剂加氢性能的影响Fig.8 Influence of reaction time (t)on hydrogenation performance of Ni-6%W-P amorphous alloy catalystm(Ni-6%W-P)=0.20 g;T=100 ℃;p(H2)=1.0 MPa
2.9 催化剂用量对硝基苯加氢反应的影响
在催化反应中,催化剂用量非常关键,适当的催化剂用量不仅可以提高反应效率,而且还可以降低成本。在H2分压1.0 MPa、反应温度100 ℃、反应时间90 min条件下,考察Ni-6%W-P非晶态合金催化剂用量对硝基苯合成苯胺的影响,结果如图9所示。可以看出,在反应体系中,当催化剂用量为0.05 g时,硝基苯的转化率和苯胺选择性较低,分别为37.96%和68.76%,这是由于催化剂用量小时,反应的活性中心较少,反应进行较慢,催化效率较低。随着催化剂用量的增加,硝基苯转化率和苯胺选择性逐渐增加,当催化剂用量为0.15 g时,硝基苯转化率和苯胺选择性达到最大值,均为100%。当催化剂用量超过0.15 g时,硝基苯转化率和苯胺选择性保持不变,均为100%,所以催化剂的最佳用量为0.15 g。

图9 Ni-6%W-P催化剂用量对硝基苯加氢合成苯胺的影响Fig.9 Influence of Ni-6%W-P catalyst amount on hydrogenation of nitrobenzene to anilinet=90 min;T=100 ℃;p(H2)=1.0 MPa
2.10 催化剂的重复使用性能
在H2分压1.0 MPa、反应温度100 ℃、反应时间90 min、催化剂用量0.15 g条件下,考察Ni-P和Ni-6%W-P非晶态合金催化剂的重复使用性能,结果如图10所示。由图10可知,Ni-P非晶态合金催化剂的稳定性极差,循环使用5次以后,基本没有活性。而Ni-6%W-P非晶态合金催化剂循环使用5次以后,硝基苯转化率仍高达99%,苯胺选择性保持在97%以上。说明W的引入能够明显提高 Ni-P 非晶态金抗氧化能力及稳定性,与前文DSC表征所得结论相一致。

图10 Ni-P和Ni-6%W-P催化剂的重复使用性能Fig.10 Reusability of Ni-P and Ni-6%W-P amorphous alloy catalystm(Catalyst)=0.15 g;t=90 min;T=100 ℃;p(H2)=1.0 MPa
3 结 论
通过添加助剂W对Ni-P非晶态合金进行改性,并且将Ni-W-P非晶态合金催化剂应用到硝基苯加氢反应中,得出以下结论:
(1)助剂W的引入并未改变Ni-P合金的非晶态结构,反而增加了Ni-P非晶态合金无序度;同时W的引入增大了Ni-P非晶态合金催化剂的比表面积及热稳定性。
(2)在硝基苯加氢反应中,将W引入Ni-P非晶态合金中,提高了其催化性能。在催化剂用量7.5%、H2压力1.0 MPa、反应温度100 ℃、反应时间90 min时,硝基苯转化率和苯胺选择性均达到100%,优于同等反应条件下的Ni-P非晶态合金的性能。
(3)W的引入大大提高了Ni-P非晶态合金的反应稳定性,Ni-6%W-P非晶态合金催化剂循环使用5次之后,硝基苯转化率仍高达99%,苯胺选择性保持在97%以上。
