剖宫产后瘢痕部位妊娠超声分型的临床意义
2019-07-30席如如
张 婷 原 婷 赵 菲 席如如 韩 蓁*
1.西安交通大学第一附属医院(710061);2.西北妇女儿童医院
剖宫产后瘢痕部位妊娠(CSP)处理不及时或不恰当,易引起无痛性阴道大出血、子宫破裂、丧失生育功能甚至危及生命[1]。由于该病临床表现多样,诊疗规范至今尚未形成共识。本研究回顾性分析剖宫产术后CSP患者临床资料,分析不同超声分型CSP的临床特征及诊治方法,为超声分型指导临床治疗提供参考。
1 资料与方法
1.1 一般资料
回顾性收集2015年1月—2018年1月本院收治的CSP患者107例临床资料。年龄(33.4±5.3)岁(26~41岁);剖宫产术史1次91例,2次16例;距本次妊娠时间6个月~18年。
1.2 CSP临床诊断及分型
临床诊断:根据临床症状、停经时间、血尿HCG,结合经阴道或经腹部超声明确诊断。超声诊断[2]:①宫腔内及宫颈管内无妊娠囊;②妊娠囊位于子宫峡部前壁或者其下缘达到子宫峡部前壁,超声可见卵黄囊、胚芽及原始心管搏动或仅见混合性回声包块;③妊娠囊与膀胱壁之间子宫肌层薄弱甚至出现连续性中断;④彩色多普勒血流显像(CDFI)示妊娠囊周边血流信号为低阻高速。结合参考文献[3]制定分型标准:Ⅰ型(部分位于宫腔型),妊娠囊位于宫腔下段,其下缘达到子宫前壁下段瘢痕处,瘢痕处局部肌层变薄,CDFI示妊娠囊周边可见血流信号;Ⅱ型(孕囊型),妊娠囊位于子宫前壁下段剖宫产瘢痕处,可向膀胱壁突起,妊娠囊着床部位局部肌层组织变薄,CDFI示周边血流信号较丰富;Ⅲ型(不均质包块型),子宫前壁下段瘢痕处可见不均质回声包块,与正常肌层界限不清,CDFI示周边丰富血流信号。
1.3 治疗方法
①B超引导下清宫术(超声清宫):在腹部超声引导下,选用卵圆钳钳夹或低压负压吸引,清除组织送病理。②双侧子宫动脉栓塞后B超引导下清宫术(动脉栓塞):局麻下采用Seldinger技术穿刺右侧股动脉,置入5F动脉鞘,用4FCobra导管超选择至双侧子宫动脉,经造影明确妊娠部位及供血情况,经导管缓慢向双侧子宫动脉内灌注明胶海绵颗粒,栓塞双侧子宫动脉至血流阻断。栓塞成功并造影证实后撤管。术后24~28 h在B超引导下清宫术,病灶组织送病理检查。③经腹瘢痕部位妊娠病灶切除及子宫修补术(经腹切除):常规腹部消毒、铺巾,取原剖宫产切口开腹,术中钝、锐性交替分离子宫前壁峡部与周围组织之粘连,打开膀胱子宫反折腹膜,下推膀胱,横行切开肌层,外翻切口,钳夹大部分妊娠组织后,小号刮匙刮净残剩妊娠组织,修整切口肌层组织,可吸收线双层连续缝合子宫肌层,关闭膀胱反折腹膜。将切除病灶组织送病理检查。
1.4 观察指标
观察各组患者临床特点、治疗方式、治疗结果。临床治愈标准为复查超声宫腔内及前壁下段瘢痕处无异常回声。
1.5.统计学方法

2 结果
2.1 CSP临床特征
患者均有停经史、剖宫产史,停经时间34~84d。107例患者中,因阴道少量不规则出血偶伴下腹隐痛就诊而发现50例(46.7%),孕后常规超声检查而发现42例(39.3%),因外院人工流产后出现阴道流血等症状来本院再次超声检查而确诊15例(14.0%)。I型与II型患者均因阴道不规则出血偶伴下腹痛及孕后常规超声检查而发现,比较无差异(P>0.05)。外院流产后来本院15例超声分型均为III型,I型、II型与III型就诊原因有差异(P<0.05),但患者年龄、人工流产次数、剖宫产次数、与前次剖宫产间隔时间均未见差异(P>0.05)。见表1。
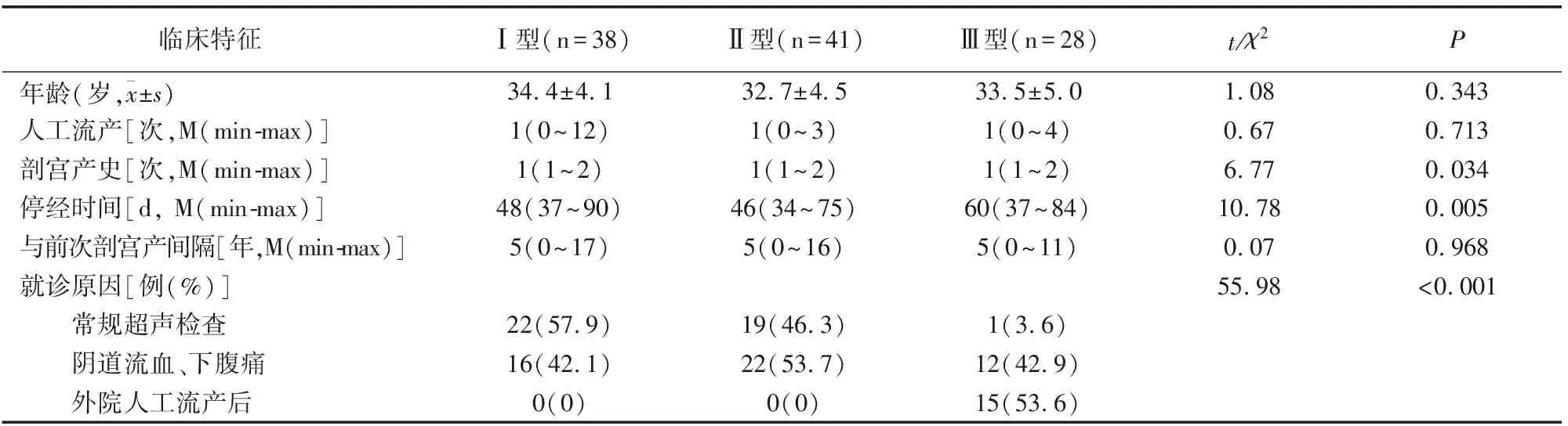
表1 各CSP不同超声分型治疗特征比较
2.2 CSP超声分型
107例患者中,经腹部超声确诊12例,经阴道超声确诊95例,其中部分患者初次经腹部超声提示CSP可疑,进一步经阴道超声而确诊为CSP;I型38例(35.5%),II型41例(38.3%),III型28例(26.2%)。
2.3 CSP治疗情况
107例患者中,接受B超引导下清宫术治疗42例(39.3%),接受双侧子宫动脉栓塞后B超引导下清宫术治疗27例(25.2%),接受经腹子宫瘢痕部位妊娠病灶清除术+子宫修补术治疗32例(29.9%);其余治疗方法包括单纯局部注射MTX+B超引导下清宫术4例,子宫动脉栓塞+局部注射 MTX+B超引导下清宫术1 例,子宫切除术1例。
2.4 CSP治疗效果
I型患者中,接受超声清宫治疗中有1例失败,因出血多改经腹切除方法治疗;II型患者中,接受超声清宫治疗中有2例失败,接受了二次治疗;III型患者中,接受超声清宫治疗有1例失败,接受动脉栓塞治疗有1例失败,均接受二次治疗(表2)。I、II与III型治疗方式比较有差异(P<0.05),I型与II型治疗方式选择无差异(P>0.05);I与II型主要采用B超引导下清宫术及动脉栓塞治疗,而III型患者多采用经腹切除治疗。

表2 CSP不同超声分型治疗方法的临床结果[例(%)]
2.5 CSP患者治疗前后血β-HCG变化
107例CSP患者中,入院后化验血β-hCG指标81例,其中选择超声清宫32例,β-hCG 31500.43±3.58 mIU/ml;动脉栓塞25例,β-hCG 71000.81±1.40mIU/ml;经腹切除24例,β-hCG 41000.10±5.01 mIU/ml;不同治疗方法患者血β-hCG值比较未见差异(F= 2.88,P>0.05)。余26例由于病情危急、尿妊娠试验阳性或超声诊断明确等,入院后未化验血β-hCG而直接选择治疗方法。
3 讨论
3.1 目前CSP诊治情况
CSP患者的临床表现缺乏特异性,常表现为停经后无痛性阴道少量流血,而一些患者根本没有任何临床症状,仅在检查时偶然发现。本研究也充分说明了这一点,在107例患者中,50例因停经后无痛性阴道少量流血,偶伴有轻度或中度下腹痛而检查发现,42例没有任何临床症状,仅在检查时偶然发现。15例因外院首次误诊为宫内妊娠而人工流产后来本院检查被发现。临床上对CSP主要通过剖宫产史、停经史、临床症状及超声检查而诊断。超声检查中经阴道超声检查更能清楚反映妊娠囊的位置、形态和大小等,准确判断妊娠囊与手术切口的位置关系,准确测量到子宫肌层厚度等指标,早期准确诊断剖宫产后瘢痕部位妊娠[7]。本研究107例中,有95例是经阴道超声检查确诊,12例经腹超声检查确诊,其中部分患者首次经腹超声检查提示CSP可疑,进一步选择经阴道超声检查而确诊。说明经阴道超声检查可为临床早期诊断CSP 提供更好影像依据。有研究统计,经阴道彩色超声检查对CSP诊断的敏感性达84.6%[8]。
3.2 CSP超声分型的临床特征
向阳等学者[3]依据超声声像图提出将CSP分为3型。本研究资料据此分型,I、II型患者多因停经后无痛性阴道少量流血及常规检查被发现, III型患者多因外院首次误诊为宫内妊娠而人工流产后来本院就诊被发现。I、II型与III型患者的就诊原因存在差异。由此推断,若能早期准确诊断CSP及其分型,避免盲目人工流产,可能避免III型发生。
3.3 不同超声分型CSP的治疗方式选择
CSP治疗方法目前主要有药物治疗后清宫术、子宫动脉栓塞介入治疗后清宫术、瘢痕部位妊娠病灶切除及瘢痕修补术[9]。多数学者认为CSP患者术时易发生大出血,术前预处理对保证手术安全性、提高疗效和降低不良结局至关重要[10-11]。而UACE 通过止血和杀胚双重作用作为CSP术前预处理,可明显减少出血,缩短手术时间,降低失血性休克以及切除子宫的风险,成为CSP术前预处理的推荐方式[12]。本文107例CSP患者,I型和II型患者主要采用超声下清宫和动脉栓塞即可达到治疗目的。B超引导下清宫术直接清除妊娠组织达到治疗目的。然而针对血供比较丰富的CSP患者,易导致术中、术后阴道大量流血,而采用双侧子宫动脉栓塞后B超引导下清宫术,由于双侧子宫动脉均被栓塞后可有效地控制阴道出血,胚胎没有血供无法正常生长[13],其清除率高、安全性高、阴道流血少,是临床上值得推荐的方法。而对III型患者,由于局部肌层组织变薄或缺如,与正常肌层界限不清,且常可探及丰富血流信号,若直接采用清宫术易导致大出血。因此,瘢痕病灶切除联合修补术是治疗此型最佳手段,手术不仅能切除瘢痕病灶,同时可修补可能存在的小憩室,降低瘢痕妊娠复发[14]。本研究III型患者71%采用经腹子宫瘢痕部位妊娠病灶清除术+子宫修补术。对于I型和II型患者多采用B超引导下清宫术和UACE后B超引导下清宫术就能解决问题,但需结合患者自身情况,必要时需经腹子宫瘢痕部位妊娠病灶清除+子宫修补术治疗;而III型患者由于自身病理解剖特点,清宫术或UACE后清宫术风险较大,瘢痕病灶切除联合修补术是最佳选择。
监测血β-hCG水平可了解滋养细胞的活性,其动态变化判断剖宫产术后瘢痕妊娠治疗疗效[15]。而血β-hCG值能否影响治疗方式的选择尚未定论。本研究发现,血β-hCG值并不影响CSP患者治疗方式的选择。但由于样本量少,存在一定的局限性,仍需后期进一步研究。
综上所述,子宫剖宫产后瘢痕部位妊娠作为临床较为复杂一类病症,在诊治过程中应尽量选择经阴道超声检查,早期准确诊断CSP及其分型,避免盲目人工流产,可降低患者不利影响。
